《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法

第四章酸碱滴定法 酸碱滴定法所涉及的反应是酸碱反应,因此,首先必须对酸碱平衡的基础理论进行简 要的讨论,然后再介绍酸碱滴定法的有关理论和应用。 §4一1酸碱平衡的理论基础 众所周知,根据酸碱电离理论,电解质离解时所生成的阳离子全部是的是酸,离解 时所生成的阴离子全部是OH一是碱。例如: 酸 HOAc =H*+OAc- NaOH—Na+OH 酸碱发生中和反应生成盐和水。 NaOH HOAc NaOAc HO 但电离理论有一定局限性,它只适用于水溶液,不适用于非水溶液,而且也不能解释 有的物质(如NH,等)不含OH~,但却具有碱性的事实。为了进一步认识酸碱反应的本 质和便于对水溶液和非水溶液中的酸碱平衡问题统一加以考虑,现引人酸碱质子理论。 酸碱质子理论 酸碱质子理论(proton theory)是在1923年由布朗斯台德(Br中nsted)提出的。根据 质子理论, 凡是能给出质子()的物质是酸:凡是能接受质子的物质是碱,它们之间的 关系可用下式表示之 酸一厨子+碱 例如: HOAc =H*+OAc 上式中的HOAC是酸,它给出质子后,转化成的OAC~对于质子具有一定的亲和力, 能接受质子,因而OC~是一种碱。这种因一个质子的得失而互相转变的每一对酸碱,称 为共轭酸碱对。关于共轭酸碱对还可再举数例如下: HCO,一H+ClO HSOH++SO N一H+NH H2PO:一H+HPO房 HPO一H+PO 失去结晶水,因此应把它保存在相对湿度为60%的恒湿器中。 硼砂 准物的标定反应为 NazB:O+2HCI 5H2O-4H,BO3+2NaCl 以甲基红指示终点,变色明显
第四章 酸碱滴定法 酸碱滴定法所涉及的反应是酸碱反应,因此,首先必须对酸碱平衡的基础理论进行简 要的讨论,然后再介绍酸碱滴定法的有关理论和应用。 §4—1 酸碱平衡的理论基础 众所周知,根据酸碱电离理论,电解质离解时所生成的阳离子全部是 H+的是酸,离解 时所生成的阴离子全部是 OHˉ 是碱。例如: 酸 碱 酸碱发生中和反应生成盐和水: 但电离理论有一定局限性,它只适用于水溶液,不适用于非水溶液,而且也不能解释 有的物质(如 NH3 等)不含 OHˉ,但却具有碱性的事实。为了进一步认识酸碱反应的本 质和便于对水溶液和非水溶液中的酸碱平衡问题统一加以考虑,现引人酸碱质子理论。 酸碱质子理论 酸碱质子理论(proton theory)是在 1923 年由布朗斯台德(BrФnsted)提出的。根据 质子理论,凡是能给出质子(H +)的物质是酸;凡是能接受质子的物质是碱,它们之间的 关系可用下式表示之: 例如: 上式中的 HOAc 是酸,它给出质子后,转化成的 OACˉ 对于质子具有一定的亲和力, 能接受质子,因而 OACˉ是一种碱。这种因一个质子的得失而互相转变的每一对酸碱,称 为共轭酸碱对。关于共轭酸碱对还可再举数例如下: 失去结晶水,因此应把它保存在相对湿度为 60%的恒湿器中。 硼砂基准物的标定反应为 以甲基红指示终点,变色明显

诚标准溶液 mol·L,但有时需用到浓度高达 NaCO,而且NaOH还可能含有硫酸盐、硅酸盐、氯化物等杂质,因此应采用间接法配制 其标准溶液,即配成近似浓度的碱溶液,然后加以标定。 含有Na,CO3的标准碱溶液在用甲基橙作指示剂滴定强酸时,不会因Na,CO,的存在而 NaCO,仅交换 用到生成NaHCO,于是就会引起 的标准减溶液。 可用不同方法配制不含CO,的标淮碱溶液。最常用的方法是取一份纯净NOH,加 人一份水,搅拌,使之溶解,配成50%的浓溶液。在这种浓溶液中NCO,的溶解度很小, 待NaCO沉降后,吸取卜层澄清液,稀释至所需浓度。 由于NaOH 一般只在其表面形成 ,因此亦可称取较多的NaOH固体 于烧杯中,以蒸馏水洗涤二三次,每次用水少许,以洗去表面的少许NCO,倾去洗涤液, 留下固体NOH,配成所需浓度的碱溶液。为了配制不含CO,的碱溶液,所用蒸缩水亦应 不含C01。 为了标定NaOH溶液,可用客种基准物,如HC,O·2H,O、KHCO、苯甲酸等。但 最常用的是邻苯二甲酸氢钾。这种基准物容易用重结晶法制得纯品,不含结晶水,不吸湖, 容易保存,标定时,由于称量而造成的误差也较小(见S3一5,例4),因而是一种良好的 基准物 标定反应为 COOK COOK +NH一C +HO COOH COONa 由于邻苯二甲酸的PKa2=5.54。因此采用酚鼠指示终点时,变色相当敏锐. 'H;N-R-NHj H'+*H3N-R-NH2 可见酸碱可以是阳离子、阴离子,也可以是中性分子。 上面各个共轭酸碱对的质子得失反应,称为酸碱半反应,它们和氧化还原反应中的半电 池反应相类似。由于质子的半径极小,电荷密度极高,它不可能在水溶液中独立存在(或者 说只能瞬间存在),因此上述的各种酸碱半反应在溶液中也不能单独进行 ,而是当 种酸 出质子时,溶液中必定有一种碱来接受质子。例如HOA©在水溶液中离解时,作为溶剂的 水就是接受质子的碱,它们的反应可以表示如下:
碱标准溶液 碱标准溶液一般用 NaOH 配制,最常用浓度为 0.lmol·L -l,但有时需用到浓度高达 lmol·L -l 或低到 0.01 mol·L -l 的。NaOH 易吸潮,也易吸收空气中的 CO2,以致常含有 Na2CO3,而且 NaOH 还可能含有硫酸盐、硅酸盐、氯化物等杂质,因此应采用间接法配制 其标准溶液,即配成近似浓度的碱溶液,然后加以标定。 含有 Na2CO3的标准碱溶液在用甲基橙作指示剂滴定强酸时,不会因 Na2CO3 的存在而 引人误差;如用来滴定弱酸,用酚酞作指示剂,滴到酚酞出现浅红色时,Na2CO3 仅交换二 个质子,即作用到生成 NaHCO3,于是就会引起一定的误差。因此应配制和使用不含 CO3 2- 的标准碱溶液。 可用不同方法配制不含 CO3 2-的标准碱溶液。最常用的方法是取一份纯净 NaOH,加 人一份水,搅拌,使之溶解,配成 50%的浓溶液。在这种浓溶液中 Na2CO3的溶解度很小, 待 Na2CO3沉降后,吸取卜层澄清液,稀释至所需浓度。 由于 NaOH 固体一般只在其表面形成一薄层 Na2CO3,因此亦可称取较多的 NaOH 固体 于烧杯中,以蒸馏水洗涤二三次,每次用水少许,以洗去表面的少许 Na2CO3,倾去洗涤液, 留下固体 NaOH,配成所需浓度的碱溶液。为了配制不含 CO3 2-的碱溶液,所用蒸馏水亦应 不含 CO2。 为了标定 NaOH 溶液,可用各种基准物,如 H2C2O4·2H2O、KHC2O4、苯甲酸等。但 最常用的是邻苯二甲酸氢钾。这种基准物容易用重结晶法制得纯品,不含结晶水,不吸潮, 容易保存,标定时,由于称量而造成的误差也较小(见§3—5,例 4),因而是一种良好的 基准物。 标定反应为 由于邻苯二甲酸的 PKa2=5.54。因此采用酚酞指示终点时,变色相当敏锐。 可见酸碱可以是阳离子、阴离子,也可以是中性分子。 上面各个共轭酸碱对的质子得失反应,称为酸碱半反应,它们和氧化还原反应中的半电 池反应相类似。由于质子的半径极小,电荷密度极高,它不可能在水溶液中独立存在(或者 说只能瞬间存在),因此上述的各种酸碱半反应在溶液中也不能单独进行,而是当一种酸给 出质子时,溶液中必定有一种碱来接受质子。例如 HOAc 在水溶液中离解时,作为溶剂的 水就是接受质子的碱,它们的反应可以表示如下:

HOAc H'+OAc 酸 碱, H,0+H* 碱2 酸2 HOAc+H,O一H,O+OA 酸1碱 酸2碱1 两个共轭酸碱对相互作用而达平衡,这也和两个半电池反应相互结合而成氧化还原反应 相类似。 同样,碱在水溶液中接受质子的过程,也必须有溶剂水分子参加。例如: NH+H' 0一H*+OH NHs+H.O OH+NH 司样也是两个共银酸碱对相互作用而达平衡。在这个平衡中作为溶剂的水起了酸的作用。与 HOAC在水中离解的情况相比较可知,水是一种两性溶剂 由于水分子的两性作用, 个水分子可以从另一个水分子夺取质子而形成H0和O州“,即 H,0+H,0一H0+OH 在水分子之间存在着的质子传递作用,称为水的质子自递作用。这种作用的平衡常数称为水 的质子自递常数,用Kw表示: K.=[HO*][OH- 水合质子H,0也常常简写作矿,因此水的质子自递常数常简写作: K.=[H'][OH- 这个常数就是水的离子积,在25℃时等于104,于是 K.=1014 pK.=14 根据质子理论,酸和碱的中和反应也是一种质子的转移过程,例如HCI与NH反应: HCI+H20一H0+C HO'+NH NH+H2O 反应的结果是各反应物转化为它们各自的共轭酸或共轭碱 人们通常说的盐的水解过程,实质上也是质子的转移过程。它们和酸碱离解过程在本质 上是相同的,例如:
两个共轭酸碱对相互作用而达平衡,这也和两个半电池反应相互结合而成氧化还原反应 相类似。 同样,碱在水溶液中接受质子的过程,也必须有溶剂水分子参加。例如: 同样也是两个共轭酸碱对相互作用而达平衡。在这个平衡中作为溶剂的水起了酸的作用。与 HOAc 在水中离解的情况相比较可知,水是一种两性溶剂。 由于水分子的两性作用,一 个水分子可以从另一个水分子夺取质子而形成 H3O +和 OHˉ,即 在水分子之间存在着的质子传递作用,称为水的质子自递作用。这种作用的平衡常数称为水 的质子自递常数,用 KW 表示: 水 合 质 子 H3O + 也 常 常 简 写 作 H + , 因 此 水 的 质 子 自 递 常 数 常 简 写 作 : 这个常数就是水的离子积,在 25℃时等于 10-14,于是 根据质子理论,酸和碱的中和反应也是一种质子的转移过程,例如 HCI 与 NH3 反应: 反应的结果是各反应物转化为它们各自的共轭酸或共轭碱。 人们通常说的盐的水解过程,实质上也是质子的转移过程。它们和酸碱离解过程在本质 上是相同的,例如:

HOAe+H,OH,O+OAe 离解 H2O NH3 NHi+OH- 离解 酸 碱 碱 H2O+OAc HOAc OH 水解 NH+H2O H:O'+NH 水解 酸! 酸2碱 上述的最后两个反应式也可分别看作HOAc的共轭碱OAC的离解反应和NHB的共 钜酸N4+的离解反应。总之,各种酸碱反应过程都是质子转移过程,因此运用质子理论就 可以找出各种酸碱反应的共同基本特征。 酸威离解平衡 酸碱的强弱取决于物质给出质子或接受质子能力的强弱。给出质子的能力越强,酸性 就越强:反之就越弱。同样,接受质子的能力越强,碱性就越强:反 这就定量说明了,酸越强,其共轭碱越弱:反之,酸越弱,它的共钜碱越强的规律 4一2不同pH溶液中酸碱存在形式的分布情况——一分布曲线 从酸(或碱)离解反应式可知,当共轭酸碱对处于平衡状态时,溶液中存在着0利 不同的酸碱形式。这时它们的浓度称为平衡浓度(equilibrium con-一centration),各种存在形 式平衡浓度之和称为总浓度或分析浓度(analytical con-一centration),某一存在形式的平衡 浓度占总浓度的分数,即为该存在形式的分布系数(dstribution coef伍icient),以6表示之。 当溶液的p发生变化时,平衡随之移动,以致酸碱存在形式的分布情祝也跟着变化。分布 系数6 溶液PH间的关系曲线称为分布曲线 distribution curve ) 讨论分布曲线可帮助我 们深人理解酸碱滴定的过程、终点误差以及分步滴定的可能性,而且也有利于了解配位滴定 与沉淀反应条件的选择原则。现对一元酸、二元酸和三元酸的分布系数的计算和分布曲线分 别讨论如下。 一元酸例如HOAc,设它的总浓度为c。它在溶液中以HOAc和OAc两种形式存 在,它们的平 衡浓度 分别为 HOAc]和OAG ],则C=[HOAc]+OAe~,又设HOA 所占的分数为6,OAc所占的分数为8,则 H1 THOA IH I
上述的最后两个反应式也可分别看作 HOAc 的共轭碱 OACˉ 的离解反应和 NH3 的共 轭酸 NH4+的离解反应。总之,各种酸碱反应过程都是质子转移过程,因此运用质子理论就 可以找出各种酸碱反应的共同基本特征。 酸碱离解平衡 酸碱的强弱取决于物质给出质子或接受质子能力的强弱。给出质子的能力越强,酸性 就越强;反之就越弱。同样,接受质子的能力越强,碱性就越强;反 这就定量说明了,酸越强,其共轭碱越弱;反之,酸越弱,它的共轭碱越强的规律。 4-2 不同 pH 溶液中酸碱存在形式的分布情况-分布曲线 从酸(或碱)离解反应式可知,当共轭酸碱对处于平衡状态时,溶液中存在着 H3O +和 不同的酸碱形式。这时它们的浓度称为平衡浓度(equilibrium con-centration),各种存在形 式平衡浓度之和称为总浓度或分析浓度(analytical con-centration),某一存在形式的平衡 浓度占总浓度的分数,即为该存在形式的分布系数(dstribution coefficient),以δ表示之。 当溶液的 pH 发生变化时,平衡随之移动,以致酸碱存在形式的分布情况也跟着变化。分布 系数δ与溶液 PH 间的关系曲线称为分布曲线(distribution curve)。讨论分布曲线可帮助我 们深人理解酸碱滴定的过程、终点误差以及分步滴定的可能性,而且也有利于了解配位滴定 与沉淀反应条件的选择原则。现对一元酸、二元酸和三元酸的分布系数的计算和分布曲线分 别讨论如下。 一元酸 例如 HOAc,设它的总浓度为 c。它在溶液中以 HOAc 和 OAcˉ两种形式存 在,它们的平衡浓度分别为[HOA c]和[OAcˉ],则 C=[HOA c]+[OAcˉ]。又设 HOAc 所占的分数为δ1,OAcˉ所占的分数为δ0,则

同理可得 显然,各种组分分布系数之和等于1,即 6,+8。=1 如果以pH为横坐标,各存在形式的分布系数为纵坐标, 可得如图4一1所示的分布曲线。从图中可以看到: pH=pKa时,6=6=0.5,即溶 密H的关系曲线 液中HOAc与OAcˉ两种形式各占50%: 当P阳6。,即溶液中HOAc为主要的存在形式 当pH>pK。时,1>8,溶液中 出C:O为主要的存在形式: 1.0 当PH62和81>8 0.86 溶液中HCOˉ为主要的存在形式: 0.6 当PD>PK2时,6>61溶液中C02为主要 存在形式。 0.2 由于草酸的PK=1·23,PK=4.19,比较接 12 近,因此在HC0的优势区内,各种形式的存在 情祝比较复杂。计算表明,在PH2.2一3.2时, 图4一2草酸溶液中各种存在形式的 明显出现三种组分同时存在的状况,而在pH2.71 分布系数与溶液H的关系曲线
同理可得 显然,各种组分分布系数之和等于 1,即 δ1+δ0 =1 如果以 pH 为横坐标,各存在形式的分布系数为纵坐标, 可得如图 4—1 所示的分布曲线。从图中可以看到: 当 pH=pKa 时,δ1=δ0 =0.5,即溶 液中 HOAc 与 OAcˉ两种形式各占 50%; 当 PH>δ0,即溶液中 HOAc 为主要的存在形式; 当 pH>>pK。时,δ1>δ1,溶液中 H2C2O4为主要的存在形式; 当 PH>δ2 和δ1>>δ0, 溶液中 HC2O4ˉ为主要的存在形式; 当 PH>>PKa2 时,δ0>>δ1 溶液中 C2O4 2-为主要 存在形式。 由于草酸的 PKa1=1·23,PKa2= 4.19,比较接 近,因此在 HC2O4ˉ的优势区内,各种形式的存在 情况比较复杂。计算表明,在 PH 2.2~3.2 时, 明显出现三种组分同时存在的状况,而在 pH 2.71

时,虽然HC0,ˉ的分布系数达到最大(0.938),但8,与6,的数值也各占0.031。 三元酸例如HPO4,情况更复杂些,以6,8:6,和6。分别表示HPO4,HPO:~HPO: 和PO,:的分布系数,仿照二元酸分布系数的推导方法,可得下列各分布系数的计算公式: 「H+13 83=KHK.K[H]+K.KK (4-3m) K[H]2 -K.[.[H]+K.K.K (4-36) KK [H' 0-K[[H]K.KK (4-3c) KKK。 8-HK.HK.K.[H]+K.K.K. (4-3d) 图4一3为磷酸溶液中各种存在形式的分布曲线.由于H3P04的pK1=2.12,pK2=7.20, pK=12.36,三者相差较大,各存在形式同时共存的情况不如草酸明显: 当PH6:,溶液中 PO,为主要的存在形式: 当PKal6,和 8>6,溶液中HP0,ˉ占优势: 当PK。6:和 8≥>6。,溶液中HPO2占优势: 当PH>PK时,6,>6:,溶液中 PO为主要的存在形式: 0 寸4子6片80品位市分 应该指出,在P=4.7时,虽然 P 比P0,占99,4%,而另外两种形式 图4一3陵酸溶液中各种存在形式的 (H,PO和HPO,2)各占0.3%。同样, 当 pH=9.8时,HO2占绝对优势(99.5 分布系数与溶液pH的关系曲线 %),而HPO,和PO产也各占0.3%。这两种pH情况下,由于各次要的存在形式所 根据实际测定,酚臧在H小于8的溶液中呈无色,当溶液的pH大于10时酚酞呈红 色,pH从8到10是酚酞逐渐由无色变为红色的过程,称为酚酞的“变色范围”。甲基橙则 当溶液H小于31时是红色,大于4.4时早蕾伍,H从31到44品甲某橙的变色范围 由于各种指示剂的平衡常数不同 它们的变色范围也不相同。表 中列出了几种 常用酸碱指示剂的变色范用。由于变色范用是由目视判断得到的,而每个人的眼睹对颜色的 敏感度不相同,所以各书刊报道的变色范围也略有差异
时,虽然 HC2O4ˉ的分布系数达到最大(0.938),但δ2与δ0的数值也各占 0.031。 三元酸 例如 H3PO4,情况更复杂些,以δ3δ2δ1和δ0分别表示 H3PO4、H2PO4ˉ、HPO4 2- 和 PO4 3-; 的分布系数,仿照二元酸分布系数的推导方法,可得下列各分布系数的计算公式; 图 4—3为磷酸溶液中各种存在形式的分布曲线。由于 H3 PO4 的pKa1=2.12,pKa2=7.20, pKa3=12.36,三者相差较大,各存在形式同时共存的情况不如草酸明显: 当 PH>δ2 ,溶液中 H3PO4为主要的存在形式; 当 PKa1 >δ3 和 δ2>>δ1,溶液中 H2PO4ˉ占优势; 当 PKa2 >δ2 和 δ1>>δ0,溶液中 HPO4 2-占优势; 当 PH>>PKa3 时,δ3>>δ2 ,溶液中 PO4 3-为主要的存在形式; 应该指出,在 PH=4.7 时,虽然 H2PO4ˉ占 99.4%,而另外两种形式 (H3PO4和 HPO4 2-)各占 0.3%。同样, 当 pH=9.8 时,HPO4 2- 占绝对优势(99.5 %),而 H2PO4ˉ和 PO4 3-也各占 0.3%。这两种 pH 情况下,由于各次要的存在形式所 根据实际测定,酚酞在 pH 小于 8 的溶液中呈无色,当溶液的 pH 大于 10 时酚酞呈红 色,pH 从 8 到 10 是酚酞逐渐由无色变为红色的过程,称为酚酞的“变色范围”。甲基橙则 当溶液 pH 小于 3.1 时呈红色,大于 4.4 时呈黄色,pH 从 3.1 到 4.4 是甲基橙的变色范围。 由于各种指示剂的平衡常数不同,它们的变色范围也不相同。表 4—3 中列出了几种 常用酸碱指示剂的变色范围。由于变色范围是由目视判断得到的,而每个人的眼睛对颜色的 敏感度不相同,所以各书刊报道的变色范围也略有差异
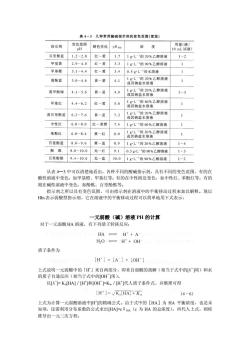
表4一3几种常用酸碱指示剂的变色范围(室温】 指示剂 变色范颜色变化pK 度 百里酚蓝 1.2-2.8 红~黄17 1gL-1的20%乙醇溶液 1~2 甲基黄 2.9-4.0 红-黄3.3 1g·L”1的90%乙醇溶礼 1 甲基橙 3.1-4.4 红~黄 3 0.5gL的水溶液 1 澳酚蓝 3.0-4.6 黄~紫 4.1 澳甲酚绿 4.1-5.6 黄一蓝 4.9 或买钠盐水液乙酵審液 1~3 甲基红 4.4-6.2 红一黄 5.0 或武纳盐的水常乙惊溶液 1 溴百里酚盖 6.2-7.6 黄一蓝 7.3 中性红 6.8-8.0 红~黄橙 7.4 1gL1的60%乙醇溶液 苯酚红 6.8-8.4 黄一红 8.0 1 百里酚蓝8.0-9.6黄- 8.9 1gL的20%乙醇溶液 14 酚酞8.0-10.0无一红 9.1 0.5gL'的90%乙醇溶液 1-3 百里酞9.4-10.6无-蓝10.01gL的90%乙醇溶液1~2 从表4一3中可以清楚地看出,各种不同的酸碱指示剂,具有不同的变色范围,有的在 酸性溶液中变色,如甲基橙、甲基红等:有的在中性附近变色,如中性红、苯酚红等:有的 则在碱性溶液中变色,如酚酞、百里酚酞等。 指示剂之所以具有变色范围 可由指示剂在溶液中的平 衡移动过程来加以解释。现以 表示弱酸型指示剂,它在溶液中的平衡移动过程可以简单地用下式表示: 一元弱酸(碱)溶液PH的计算 对于一元弱酸HA溶液,有下列质 转移反应: HAH'+A H2OH*+OH 质子条件为 [H]=[A1+[OH] 上式说明一元弱酸中的「H」来自两部分,即来自弱酸的离解(相当于式中的A项)和水 的质子自递反应(相当于式中的O州项). 以AFK,HA]/旧门和[OH=K./旧门代人质子条件式,并整理可得 [H]=√KHA+K (4-6) 上式为计算一元弱酸溶液中[旧门的精确公式。由于式中的[H]为HA平衡浓度,也是术 知项,还需利用分布系数的公式求出HA]=c8A(c为HA的总浓度),再代人上式,则将 推导出一元三次方程:
从表 4—3 中可以清楚地看出,各种不同的酸碱指示剂,具有不同的变色范围,有的在 酸性溶液中变色,如甲基橙、甲基红等;有的在中性附近变色,如中性红、苯酚红等:有的 则在碱性溶液中变色,如酚酞、百里酚酞等。 指示剂之所以具有变色范围,可由指示剂在溶液中的平衡移动过程来加以解释。现以 HIn表示弱酸型指示剂,它在溶液中的平衡移动过程可以简单地用下式表示: 一元弱酸(碱)溶液 PH 的计算 对于一元弱酸 HA 溶液,有下列质子转移反应: 质子条件为 上式说明一元弱酸中的「H +」来自两部分,即来自弱酸的离解(相当于式中的[A - ]项)和水 的质子自递反应(相当于式中的[OH- ]项)。 以[A - ]= Ka[HA]/[H+ ]和[OH- ]=Kw/[H+ ]代人质子条件式,并整理可得 上式为计算一元弱酸溶液中[H+ ]的精确公式。由于式中的[HA]为 HA 平衡浓度,也是未 知项,还需利用分布系数的公式求出[HA]=cδHA(c 为 HA 的总浓度),再代人上式,则将 推导出一元三次方程:

[H]3+K,H]2-(cK.+K)[H]-KK.=0 显然,解上述方程的计算相当麻烦。考虑到计算中所用的常数,一般来说,其本身即有百分 之几的误差,而且又未使用活度,仅以浓度代人计算,因此这类分析化学的计算通常允许日门 有5%的误差,所以对于具体情况,可以合理简化,作近似处理。 若考虑到弱酸的浓度不是大低,HA虽有部分离解,但HA的平衡浓度HA可以认为近似等 于总浓度c,即略去弱酸本身的离解,以c代替A]。通 过计算可知,若允许有5%误差,需满足c/K≥105条件,式(4一6)可简化为近似公式: [H]=√cK。+Kw (4-7) 另一方面,如果弱酸的凡不是非常小,可以推断,由酸离解提供的「矿小,将高于水离 解所提供的[H小,对于5%的允许误差可计算出当cK≥I0Kw时,可将式(46)中的 K项略去,则得 [H】=√KHAJ=K,(c-[H]) 式(4一8)也为近似计算式。 如果同时满足c/K≥105和cK≥10K两个条件,则式(4-6)可进一步简化为 [H]=√cK (4-9) 这就是常用的最简式 式(4一10)为精确计算式。 如果HA放出质子与接受质子的能力都比较弱,则可以认为「HA」≈C:另根据计算 可知,若允许有5%误差,在cK≥IOK时,HA提供的「H」比水提供的H中大得多, 所以可略去K项,则得近似计算式: m离 (4-11) 如果c/K,≥10,则分母中的K!可略去,经整理可得 [H]=√KK (4-12) 式4一12)为常用的最简式。当满足cK2≥10K,和c/K≥10两个条件时,用最简式计算 出的与用精确式求得的」相比,其误差在允许的5%以内。 式(4-10)为精确计算式。 如果HA一放出质子与接受质子的能力都比较弱,则可以 认为「HA。C:另根据计算可知,若允许有5%误差,在cK。>10Kw时,HA一提供 的「H”计水提供的卜刁大得多,所以可略去K_项,则得近似计算式: 如果t/K。>10,则分母中的K。可略去,经整理可得 厂」一Pt:j(-
显然,解上述方程的计算相当麻烦。考虑到计算中所用的常数,一般来说,其本身即有百分 之几的误差,而且又未使用活度,仅以浓度代人计算,因此这类分析化学的计算通常允许[H+ ] 有 5%的误差,所以对于具体情况,可以合理简化,作近似处理。 若考虑到弱酸的浓度不是大低,HA 虽有部分离解,但 HA 的平衡浓度[HA]可以认为近似等 于总浓度 c,即略去弱酸本身的离解,以 c 代替[H A]。通 过计算可知,若允许有 5%误差,需满足 c/Ka≥105 条件,式(4-6)可简化为近似公式: 另一方面,如果弱酸的凡不是非常小,可以推断,由酸离解提供的「H +」,将高于水离 解所提供的「H +」,对于 5%的允许误差可计算出当 cKa≥10Kw 时,可将式(4—6)中的 Kw 项略去,则得 即 式(4-8)也为近似计算式。 如果同时满足 c/Ka≥105 和 cKa≥10Kw 两个条件,则式(4-6)可进一步简化为 这就是常用的最简式。 式(4-10)为精确计算式。 如果 HA-放出质子与接受质子的能力都比较弱,则可以认为「HA」≈c ;另根据计算 可知,若允许有 5%误差,在 cKa2≥10Kw 时,HA-提供的「H +」比水提供的[H+ ]大得多, 所以可略去 Kw 项,则得近似计算式: 如果 c/Ka1≥10,则分母中的 Ka1可略去,经整理可得 式(4-12)为常用的最简式。当满足 cKa2≥10Kw 和 c/Ka1≥10 两个条件时,用最简式计算 出的[H+」与用精确式求得的[H+」相比,其误差在允许的 5%以内。 式(4-10)为精确计算式。 如果 HA-放出质子与接受质子的能力都比较弱,则可以 认为「HA」。C ;另根据计算可知,若允许有 5%误差,在 cK。>10Kw 时,HA-提供 的「H”计水提供的卜刁大得多,所以可略去 K_项,则得近似计算式: 如果 t/K。>10,则分母中的 K。可略去,经整理可得 厂”」一 Pt:j{---

根据式(4-12) (4-11D (4-12) 式N-I2)为常用的最简式。当满足CK。>1OKw和C/K。:>10两个条件时,用最简 式计算出的H”」与用精确式求得的(H”)相比,其误差在允许的5%以内 例6计算 0.I0mol·L一的邻苯二甲酸氢钾溶液的pH。解:查表得邻苯二甲酸氢钾的PK。 2·89,PKa7=5·54- PKbZ“14-2·89=11.11从批和昨可 知,邻苯二甲酸氢根高子的酸性和碱性都比较弱,可以认为「HA刁。C。 C/厂为”0·X10554H10K C/K。一0,二/10289-7.6w10'H-人 了刁叮于7E=10-422mol-1 pH=4.22例7分别计算0.05m0L1N。 HZpO4和3.33X102mOL-N。ZHp04溶液的pH。解:查表得几★04的吐。一2.12, 1。=7.20, Pk. 12.36 NSHZPO4-和N82HPO4都属于两性物质,但是它们的酸 性和碱性都比较弱,可以认为平衡浓度等于总浓度,因此可根据题设条件,采用适当的计算 式进行计算。 (1)对于0·05molL-INaHZPO4溶液 汲。一0.05飞且0720the10厂 C/K。=0.05/10-212=659 <10所以应采用式(4一11)计算: -卜”卜币正了r亢丁厅刁灭工】厂L面=2.0. 10-5mol.L- PH=4.70 ()对3 石3XIO2l.LINdsHPO4溶液由于本题涉及K。和凡,所以在运用公式及判别式时,应 将有关公式中的凡和K_分别换
根据式(4—12) (4—11) (4—12) 式 N-12)为常用的最简式。当满足 CK。>10Kw 和 C/K。;>10 两个条件时,用最简 式计算出的 IH”」与用精确式求得的{H”)相比,其误差在允许的 5%以内。 例 6 计算 0.10 mol·L-l 的邻苯二甲酸氢钾溶液的 pH。 解:查表得邻苯二甲酸氢钾的 PK。- 2·89,PKa7=5·54- PKbZ“14-2·89=11.11 从批和咋可 知,邻苯二甲酸氢根离子的酸性和碱性都比较弱,可以认为「HA 刁。C。 C/厂勺”0·IX10554H10K C/K。一 0,二/10289—77.6W10’H”」-人 了刁叮于 7E=10-422molL-1 pH=4.22 例 7 分别计算 0.05mOIL1N。 HZpO4 和 3.33X102mOIL-lN。ZHpO4 溶液的 pH。 解:查表得几*04 的吐。一 2.12, /。=7.20,pK。一 12.36 NSHZPO4 和 N82HPO4 都属于两性物质,但是它们的酸 性和碱性都比较弱,可以认为平衡浓度等于总浓度,因此可根据题设条件,采用适当的计算 式 进 行 计 算 。 ( 1 ) 对 于 0 . 05 molL - lNaHZPO4 溶 液 汲。一 0.05 飞且 0720the10 厂 C/K。=0.05/10-212=659 <10 所以应采用式(4—11)计算: -卜”卜币正了 r 亢丁厅刁灭工】厂 L 面=2.0。 10-5mol·L-l PH=4.70 (2)对于 3 石 3 X 102mol.L1NdsHPO4 溶液由于本题涉及 K。和凡,所以在运用公式及判别式时,应 将有关公式中的凡和 K_分别换
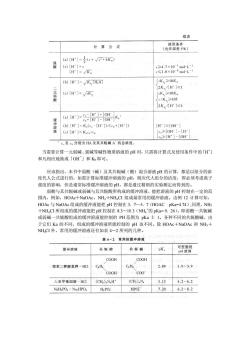
续表 计算公式 (允年限货。) (a)[H]=(c++4K) 鬟o[r]=c c≥4.7×10-1mlL-1 [H]=√K c≤1.0×10-8md-L (b)[H]=√/RHA ∫cK,≥10K 2K.H]1 元酸 (e)[H]=K. cK≥10K. e/K≥105 2K./八H*]《1 or-产8k (b)[H]=K(c.-[F])(c+[H]D [H]为[OH (c)[H']=K.c./c ,及,分别为HA及其共轭碱A的总浓度。 当需要计算一元弱碱、强碱等碱性物质溶液的pH时,只需将计算式及使用条件中的「矿 和凡相应地换成「OH厂」和K即可。 应该指出,本书中弱酸(碱)及其共轭碱(酸)混合溶液pH的计算,都是以组分的浓 度代人公式进行的,如需计算标准缓冲溶液的pH,则应代人组分的活度,即必须考虑离子 强度的影响,但是通常标准缓冲溶液的pH 都是通过精细的实验测定而得到的。 弱酸与其共轭碱或弱碱与其共轭酸所构成的缓冲溶液,能把溶液的山控制在一定的范 围内,例如,HOAc十NaOAc,NH+NHCI组成最常用的缓冲溶液。由例12计算可知, HOAc与NaOAc组成的缓冲液能把pH控制在3.7~5.7(HOAC pKa=4.74):同理,NH +NHCI所组成的缓冲液能把pH控制在8.3~10.3(NH+的pKa=9.26),即弱酸一共扼碱 或弱碱一共轭酸组成的缓冲溶液能控制的PH范围为pKa士1。各种不同的共轭酸碱,由 于它们Ka的不同,组成的缓冲溶液所能控制的pH也不同。除HOAc+NaOAc和NH NHCI外,常用的缓神溶液还有如表4一2所列的几种。 表4-2常用的缓冲溶波 缓冲溶液 共额酸 共却碱 pK. 可控制的 nH范围 COOH COOH 邻二钾酸氢钾-HC C.H 2.89 1.93.9 COOH C00 六亚甲基四胺-HC (CH)N.H" (CH)N. 5.15 4.2-6.2 NaH-PO.-NHPO HPO 7.20 6.2-8.2
当需要计算一元弱碱、强碱等碱性物质溶液的 pH 时,只需将计算式及使用条件中的「H +」 和凡相应地换成「OH-」和 Kb 即可。 应该指出,本书中弱酸(碱)及其共轭碱(酸)混合溶液 pH 的计算,都是以组分的浓 度代人公式进行的,如需计算标准缓冲溶液的 pH,则应代人组分的活度,即必须考虑离子 强度的影响,但是通常标准缓冲溶液的 pH,都是通过精细的实验测定而得到的。 弱酸与其共轭碱或弱碱与其共轭酸所构成的缓冲溶液,能把溶液的 pH 控制在一定的范 围内,例如,HOAc+NaOAc,NH3+NH4CI 组成最常用的缓冲溶液。由例 12 计算可知, HOAc 与 NaOAc 组成的缓冲液能把 pH 控制在 3.7~5.7(HOAC pKa=4.74);同理,NH3 +NH4CI 所组成的缓冲液能把 pH 控制在 8.3~10.3(NH4 +的 pKa= 9.26),即弱酸一共轭碱 或弱碱一共轭酸组成的缓冲溶液能控制的 PH 范围为 pKa 士 1。各种不同的共轭酸碱,由 于它们 Ka 的不同,组成的缓冲溶液所能控制的 pH 也不同。除 HOAc+NaOAc 和 NH3+ NH4CI 外,常用的缓冲溶液还有如表 4-2 所列的几种
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十章 醇、酚、醚.pdf
- 《基础化学》课程授课教案(物理化学讲义)第一章 第零定律与物态方程.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十三章 羧酸衍生物.pdf
- 《基础化学》课程授课教案(物理化学讲义)第二章 热力学第一定律.pdf
- 《基础化学》课程授课教案(物理化学讲义)第五章 化学平衡.pdf
- 《基础化学》课程授课教案(物理化学讲义)第四章 溶液(Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第三章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第二部分 电解与极化作用(electrolysis and polarization).pdf
- 《基础化学》课程授课教案(物理化学讲义)第六章 相平衡(Phase equilibrium).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第三部分 第三部分 可逆电池(Reversible Cell).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第一部分 电解质溶液(Electrolytic Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第九章 化学动力学.pdf
- 《基础化学》课程授课教案(物理化学讲义)第十章 胶体.pdf
