《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法

第五章配位滴定法 §5一1慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用AgNO,标准溶液滴定 CN,发生如下反应: Ag*+2CN[Ag(CN)z] 滴定到达化学计量点时,多加一滴AgNO3溶液,Ag就与[Ag(CN)2]ˉ反应生成白 色的Ag[Ag(CN)Σ]沉淀,以指示终点的到达。终点时的反应为 [Ag(CN)2]-+Ag'-Ag[Ag(CN)2] 配合物(complex)的稳定性以配合物稳定常数K稳表示,如上例中 Ke-TAg ICN10 [Ag(CN) [Ag(CN)2]的K®=102,说明反应进行得完全。各种配合物都有其一定的稳定常数, 从配合物稳定常数的大小可以判断配位反应的完全程度以及能否满足滴定分析的要求。 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类: 一类是无机配位剂 另一类是有机配位剂. 一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求:②在配位过程中有逐级配位现象,而 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式的配位离子(简称配离 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如C 与CN~的配位反应分四级进行,存在下列四种形式: C++CN一[CdCN)]'一CdCN)2[Cd(CN)3]一[Cd(CN). K83.02×10 1.38×1033.63×105 3.80×10 因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计最关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[一N(CH,COOH)为基体的有机配位剂(或 0 称螫合剂(chelant),这类配位剂中含有配位能力很强的氨氮 和羧氧 例如,铜及铜合金中的A1(GB512104一1996)和水处理剂A1C1(GB15892一1995) 测定都是在试液中加人过量的EDTA,使与AI配位完全,用Z溶液去除过量的EDTA, 然后加NaF或KF,置换出与AI配位的EDTA,再以Zn标准溶液滴定之。 又如,测定锡合金中的Sn时 ,也是采用类似的方式 ,于试液中加人过量的EDTA 可能存在的如Pb、Zn、Cd2、Bi等与Sn"一起发生配位反应。用Zn2标准溶液除去过 量的EDTA。加人N4F,使与SnY中的Sn“发生配位反应,并将EDTA释放置换出米,再 用Z2标准溶液滴定释放出的EDTA,即可求得S"的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围
第五章 配位滴定法 §5—1 慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用 AgNO3标准溶液滴定 CN,发生如下反应: 滴定到达化学计量点时,多加一滴 AgNO3 溶液,Ag+就与[Ag(CN)2] -反应生成白 色的 Ag[Ag(CN)2]沉淀,以指示终点的到达。终点时的反应为 配合物(complex)的稳定性以配合物稳定常数 K 稳表示,如上例中: [Ag(CN)2]-的 K 稳=1021.l,说明反应进行得完全。各种配合物都有其一定的稳定常数, 从配合物稳定常数的大小可以判断配位反应的完全程度以及能否满足滴定分析的要求。 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类:一类是无机配位剂, 另一类是有机配位剂。一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求;②在配位过程中有逐级配位现象,而 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式的配位离子(简称配离 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如 Cd2+ 与 CN-的配位反应分四级进行,存在下列四种形式: 因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计量关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[-N(CH2COOH)2]为基体的有机配位剂(或 称螫合剂(chelant)),这类配位剂中含有配位能力很强的氨氮 和羧氧 这两种配位原子,它们能与多种金属离子形成 的含量。 例如,铜及铜合金中的 Al(GB 512104 一 1996)和水处理剂 AlCl3(GB15892—1995) 测定都是在试液中加人过量的 EDTA,使与 AI 配位完全,用 Zn2+溶液去除过量的 EDTA, 然后加 NaF 或 KF,置换出与 AI 配位的 EDTA,再以 Zn2+标准溶液滴定之。 又如,测定锡合金中的 Sn 时,也是采用类似的方式,于试液中加人过量的 EDTA,将 可能存在的如 Pb2+、Zn2+、Cd2+、Bi3+等与 Sn Ⅳ一起发生配位反应。用 Zn2+标准溶液除去过 量的 EDTA。加人 N4F,使与 SnY 中的 Sn Ⅳ发生配位反应,并将 EDTA 释放置换出来,再 用 Zn2+标准溶液滴定释放出的 EDTA,即可求得 Sn Ⅳ的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围

再如,铬黑T与Ca+显色的灵敏度较差,但与Mg+显色却很灵敏,为此,在pH10 的溶液中,用EDTA滴定Ca2时,常于溶液中先加人少量MgY,由于Ig KcaY=10.69,g Mey=8.69,此时发生下列置换反应 MgY Ca2" CaY Mg? 置换出来的Mg与铬黑T的配合物显很深的红色。滴定时,EDTA先与Ca配位(请读 者思考一下,为什么?),到滴定终点时,EDTA夺取Mg一铬黑T配合。物中的Mg, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少量MgY与最后生成的MgY 的量相等,故加人的MgY不影响测定结果。这是通过置换滴定, 提高指示剂指示终点敏 锐性的例子 用CY一PAN作指示剂时,也是利用置换滴定法的原理。 间接滴定对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与EDTA形成稳定配合物的金属高子作沉淀剂,以沉淀待测离子 过量沉淀剂用EDTA滴定。或将沉淀分高、溶解后,再用EDTA滴定其中的金属离子。例 如测定PO- 可加一定量过量的Bi(NO,),使之生成BPO4沉淀,再用EDTA滴 剩余的Bi,又如测定Na时,将Na沉淀为醋酸鈾酚锌钠NaOAc·Zn(OAc)2·3UO: (OAc)2·9H,0,分离沉淀,溶解后,用EDTA滴定Zn2,从而求得Na含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法 第五章配位滴定法 §5—1慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用AgNO,标准溶液滴定 CN,发生如下反应: Ag+2CN[Ag(CN)2] 滴定到达化学计量点时,多加一滴AgNO,溶液,Ag就与[Ag(CN)2]ˉ反应生成白 色的Ag[Ag(CN)]沉淀,以指示终点的到达。终点时的反应为 [Ag(CN)2]-+Ag'=Ag[Ag(CN)2] 配合物(complex)的稳定性以配合物稳定常数K稳表示,如上例中: K。=eC5=10 [Ag(CN)]的K=102山,说明反应进行得完全。各种配合物都有其一定的稳定常数 从配合物稳定常数的大小可以判新配位反应的完全程度以及能否满足滴定分析的要求 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类:一类是无机配位剂, 另一类是有机配位剂。一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求:②在配位过程中有逐级配位现象 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式 位离子(简称配 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如Cd 与CN的配位反应分四级进行,存在下列四种形式:
再如,铬黑 T 与 Ca2+显色的灵敏度较差,但与 Mg2+显色却很灵敏,为此,在 pH=10 的溶液中,用 EDTA 滴定 Ca2+时,常于溶液中先加人少量 MgY,由于 Ig KCaY= 10.69,lg KMgY=8.69,此时发生下列置换反应: 置换出来的 Mg2+与铬黑 T 的配合物显很深的红色。滴定时,EDTA 先与 Ca2+配位(请读 者思考一下,为什么?),到滴定终点时,EDTA 夺取 Mg-铬黑 T 配合。物中的 Mg2+, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少量 MgY 与最后生成的 MgY 的量相等,故加人的 MgY 不影响测定结果。这是通过置换滴定,提高指示剂指示终点敏 锐性的例子。 用 CuY 一 PAN 作指示剂时,也是利用置换滴定法的原理。 间接滴定 对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与 EDTA 形成稳定配合物的金属离子作沉淀剂,以沉淀待测离子, 过量沉淀剂用 EDTA 滴定。或将沉淀分离、溶解后,再用 EDTA 滴定其中的金属离子。例 如测定 PO4 3-,可加一定量过量的 Bi(NO3)3,使之生成 BiPO4 沉淀,再用 EDTA 滴定 剩余的 Bi3+。又如测定 Na+时,将 Na+沉淀为醋酸铀酚锌钠 NaOAc·Zn(OAc)2·3UO2 (OAc)2·9H2O,分离沉淀,溶解后,用 EDTA 滴定 Zn2+,从而求得 Na+含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法. 第五章 配位滴定法 §5—1 慨述 配位滴定法是以配位反应为基础的一种滴定分析方法。早期,用 AgNO3标准溶液滴定 CN,发生如下反应: 滴定到达化学计量点时,多加一滴 AgNO3 溶液,Ag+就与[Ag(CN)2] -反应生成白 色的 Ag[Ag(CN)2]沉淀,以指示终点的到达。终点时的反应为 配合物(complex)的稳定性以配合物稳定常数 K 稳表示,如上例中: [Ag(CN)2]-的 K 稳=1021.l,说明反应进行得完全。各种配合物都有其一定的稳定常数, 从配合物稳定常数的大小可以判断配位反应的完全程度以及能否满足滴定分析的要求。 配位滴定中常用的滴定剂即配位剂(complexing agent)有二类:一类是无机配位剂, 另一类是有机配位剂。一般无机配位剂很少用于滴定分析,这是因为①这类配位剂和金属离 子形成的配合物不够稳定,不能符合滴定反应的要求;②在配位过程中有逐级配位现象,而 且各级配合物的稳定常数相差较小,故溶液中常常同时存在多种形式的配位离子(简称配离 子),使滴定过程中突跃不明显,终点难以判断,而且也无恒定的化学计量关系。例如 Cd2+ 与 CN-的配位反应分四级进行,存在下列四种形式:

Cd++CN-[Cd(CN)]*=Cd(CN)2=[Cd(CN)3]-[Cd(CN) K3.02×103 1.38×10 3.63×105 3.80×103 因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计量关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[一N(CHCOOH)]为基体的有机配位剂(或 (N)(C-0-) 0 称螫合剂(chelant)),这类配位剂中含有配位能力很强的氨氨 和羧氧 这两种配位原子,它们能与多种金属离子形成 的含量。 例如,铜及铜合金中的A(GB512104一1996)和水处理剂A1C(GB15892-1995) 测定都是在试液中加人过量的EDTA,使与AI配位完全,用Zn溶液去除过量的EDTA, 然后加NaF或KF,置换出与AI配位的EDTA,再以Zn+标准溶液滴定之. 又如,测定锡合金中的S知时,也是采用类似的方式,于试液中加人过量的EDTA,将 可能存在的如Pb2、Zn2、Cd24、B等与SW一起发生配位反应。用Zn2标准溶液除去过 量的EDTA.加人N4F,使与SY中的Sn发生配位反应,并将EDTA释放置换出来,再 用Zn标准溶液滴定释放出的EDTA,即可求得Sn"的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围。 再如,铬黑T与Ca+显色的灵敏度较差,但与Mg+显色却很灵敏,为此,在p10 的溶液中,用EDTA滴定Ca2时,常于溶液中先加人少量MgY,由于gkCv=10.69,g eY=8.69,此时发生下列置换反应: MgY Ca2 CaY Mg2 置换出来的Mg2与铬黑T的配合物显很深的红色。滴定时,DTA先与Ca配位(请读 者思考一下,为什么?),到滴定终点时,EDTA夺取Mg一铬黑T配合。物中的Mg, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少最MgY与最后生成的MgY 的量相等,故加人的MgY不影响测定结果。这是通过置换滴定,提高指示剂指示终点敏 锐性的例 用CuY一PAN作指示剂时,也是利用置换滴定法的原理。 间接滴定对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与EDTA形成稳定配合物的金属离子作沉淀剂,以沉淀待测离子, 过量沉淀剂用EDTA滴定。或将沉淀分离、溶解后,再用EDTA滴定其中的金属离子。例 如测定PO 一定量过量的Bi(NO)3,使之生成 BPO4沉淀,再用EDTA滴 剩余的B。又如测定Na时,将Na沉淀为醋酸铀酚锌钠NaOAc·Zn(OAc),·3UO, (OAc)2·9H,O,分离沉淀,溶解后,用EDTA滴定Zn2,从而求得Na含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法 第稳定的可溶性配合物。氨骏配位剂的种类很多,常见的有以下几种: 乙H胺四乙酸,简称EDTA:
因为各级稳定常数相差很小,因而滴定时产物的组成不定,化学计量关系也不恒定。 所以无机配位剂在分析化学中的应用受到一定的限制。大多数有机配位剂与金属离子的配位 反应不存在上述的缺陷,故配位滴定中常用有机配位剂,其中最常用的是氨梭类配位剂。 氨竣配位剂大部分是以氨基二乙酸基团[-N(CH2COOH)2]为基体的有机配位剂(或 称螫合剂(chelant)),这类配位剂中含有配位能力很强的氨氮 和羧氧 这两种配位原子,它们能与多种金属离子形成 的含量。 例如,铜及铜合金中的 Al(GB 512104 一 1996)和水处理剂 AlCl3(GB15892—1995) 测定都是在试液中加人过量的 EDTA,使与 AI 配位完全,用 Zn2+溶液去除过量的 EDTA, 然后加 NaF 或 KF,置换出与 AI 配位的 EDTA,再以 Zn2+标准溶液滴定之。 又如,测定锡合金中的 Sn 时,也是采用类似的方式,于试液中加人过量的 EDTA,将 可能存在的如 Pb2+、Zn2+、Cd2+、Bi3+等与 Sn Ⅳ一起发生配位反应。用 Zn2+标准溶液除去过 量的 EDTA。加人 N4F,使与 SnY 中的 Sn Ⅳ发生配位反应,并将 EDTA 释放置换出来,再 用 Zn2+标准溶液滴定释放出的 EDTA,即可求得 Sn Ⅳ的含量。 置换滴定法是提高配位滴定选择性的途径之一,同时也扩大了配位滴定的应用范围。 再如,铬黑 T 与 Ca2+显色的灵敏度较差,但与 Mg2+显色却很灵敏,为此,在 pH=10 的溶液中,用 EDTA 滴定 Ca2+时,常于溶液中先加人少量 MgY,由于 Ig KCaY= 10.69,lg KMgY=8.69,此时发生下列置换反应: 置换出来的 Mg2+与铬黑 T 的配合物显很深的红色。滴定时,EDTA 先与 Ca2+配位(请读 者思考一下,为什么?),到滴定终点时,EDTA 夺取 Mg-铬黑 T 配合。物中的 Mg2+, 游离出蓝色的指示剂,颜色变化很明显。此处,滴定前加人的少量 MgY 与最后生成的 MgY 的量相等,故加人的 MgY 不影响测定结果。这是通过置换滴定,提高指示剂指示终点敏 锐性的例子。 用 CuY 一 PAN 作指示剂时,也是利用置换滴定法的原理。 间接滴定 对于不能形成配合物或者形成的配合物不稳定的情况可采用间接滴定。 此法是加人过量的、能与 EDTA 形成稳定配合物的金属离子作沉淀剂,以沉淀待测离子, 过量沉淀剂用 EDTA 滴定。或将沉淀分离、溶解后,再用 EDTA 滴定其中的金属离子。例 如测定 PO4 3-,可加一定量过量的 Bi(NO3)3,使之生成 BiPO4 沉淀,再用 EDTA 滴定 剩余的 Bi3+。又如测定 Na+时,将 Na+沉淀为醋酸铀酚锌钠 NaOAc·Zn(OAc)2·3UO2 (OAc)2·9H2O,分离沉淀,溶解后,用 EDTA 滴定 Zn2+,从而求得 Na+含量。 间接滴定方式操作较繁,当然,引人误差的机会也增多,不是一种很好的分析测定的 方法. 第稳定的可溶性配合物。氨骏配位剂的种类很多,常见的有以下几种: 乙 H 胺四乙酸,简称 EDTA:

HOOCHC CH2COOH N-CH:-CH2-N HOOCHC CHCOOH 环己烷二胺四乙酸,简称CyDTA: CHCOOH HC CH CHCOOH HC CH-N CH-COOH 乙二醇二乙醚二胺四乙酸(EGTA): CH2COOH CH2-O-CH2-CH2-N CHCOOH CH-COOH CH2-O-CH2-CH2-N CH.COOH 乙二胺四丙酸(EDTP): CH2-N CH2CH.COOH CH2CH2COOH CH,CH,COOH 氨竣配位剂中应用最为广泛的是EDTA,它可以直接滴定或间接滴定几十种金属离子。 本章主要讨论以EDTA为配位剂,滴定金属离子的配位滴定法。 §5一2EDTA与金属离子的配合物及其稳定性 EDTA的性质 乙一胺四乙酸(ethylen diamine tetraacetic acid,EDTA或EDTA酸),它是个多元酸, 可用HY表示, 在水中的溶解度很小(22℃时,100 m水中仅能溶解0. 02g),也 难溶于酸和 氨溶液和苛性碱溶液中 生成 相 的 ,故实际使月 时,常用其二钠盐,即乙二胺四乙酸二钠(Nhv·2H,0,相对分子质量372.24),一般 也简称EDTA。它在水溶液中的溶解度较大(22℃时,100mL水中能溶解11.1g),其饱和 水溶液的浓度约为0.3mol·L小H约为4.5
环己烷二胺四乙酸,简称 CyDTA: 乙二醇二乙醚二胺四乙酸(EGTA): 乙二胺四丙酸(EDTP): 氨竣配位剂中应用最为广泛的是 EDTA,它可以直接滴定或间接滴定几十种金属离子。 本章主要讨论以 EDTA 为配位剂,滴定金属离子的配位滴定法。 §5—2 EDTA 与金属离子的配合物及其稳定性 EDTA 的性质 乙一胺四乙酸(ethylen diamine tetraacetic acid,EDTA 或 EDTA 酸),它是个多元酸, 可用 H4Y 表示。EDTA 在水中的溶解度很小(22℃时,100 rnl 水中仅能溶解 0.02 g),也 难溶于酸和一般的有机溶剂,但易溶于氨溶液和苛性碱溶液中,生成相应的盐,故实际使用 时,常用其二钠盐,即乙二胺四乙酸二钠(Na2H2Y·2H2O,相对分子质量 372.24),一般 也简称 EDTA。它在水溶液中的溶解度较大(22℃时,100 mL 水中能溶解 11.1g),其饱和 水溶液的浓度约为 0.3 mol·L -l小 H 约为 4.5

在EDTA的结构中,两个竣基上的H可转移到N原子上,形成双偶极离子: OOCH:C H HOOCH.C 若EDTA溶于酸度很高的溶液,它的两个竣基可以再接受H离子而形成H,Y+,相当 于形成一个六元酸,EDTA在水溶液中的六级离解平衡为 HeY2=H'+HY* 等-K,=0. HY*一H+HY H=K,=106 [HsY HY一H+HY [HY1=K=102 HY] HY一Ht+H2Y2 [H1Y21=K,=102 「HaY-l HY2-=H'+HY3- [HHY-]-K.=10 「H,y2-1 HY3-H+Y- 联系六级离解关系,存在下列平衡: YHYWHYH,YP是HYY (5-1) 由于分步离解,已质子化了的EDTA在水溶液中总是以HY+、HY、H,Y、HY 比Y2一、HY一和Y一等七种形式存在。从式(5一1)可以看出,EDTA中各种存在形式间 的浓度比例取决于溶液的pH。若溶液酸度增大,pH减小,上述平衡向左移动,H,Y+离子 浓度增加:反之,若溶液酸度减小,pH增大,则上述平衡右移,Y离子的浓度增加。EDTA 各种存在形式的分配情况与H之间的分布曲线如图5一1所示。 .00 .80 H Y pH 图5-1EDTA各种存在形式在不同pH时的分布曲线 图5一I可以清楚地看出不同pH时EDTA各种存在形式的分配情况。在pH<1的强酸 性溶液中,EDTA主要以H。Y形式存在,在pH=1~l6的溶液中,主要以H5Y形式存在
在 EDTA 的结构中,两个竣基上的 H +可转移到 N 原子上,形成双偶极离子: 若 EDTA 溶于酸度很高的溶液,它的两个竣基可以再接受 H +离子而形成 H6Y 2+,相当 于形成一个六元酸,EDTA 在水溶液中的六级离解平衡为 联系六级离解关系,存在下列平衡: 由于分步离解,已质子化了的 EDTA 在水溶液中总是以 H6Y 2+、H5Y +、H4Y、H3Y 一、 H2Y 2 一、HY3 一和 Y 4 一等七种形式存在。从式(5 一 1)可以看出,EDTA 中各种存在形式间 的浓度比例取决于溶液的 pH。若溶液酸度增大,pH 减小,上述平衡向左移动,H6Y 2+离子 浓度增加;反之,若溶液酸度减小,pH 增大,则上述平衡右移,Y 4-离子的浓度增加。EDTA 各种存在形式的分配情况与 pH 之间的分布曲线如图 5—1所示。 图 5—1可以清楚地看出不同 pH 时 EDTA 各种存在形式的分配情况。在 pH<1 的强酸 性溶液中,EDTA 主要以 H6Y 2+形式存在;在 pH=1~l.6 的溶液中,主要以 H5Y +形式存在;

在p=1.6~2.0的溶液中,主要以H,Y形式存在:在P=2.0~2.67的溶液中,主要 存在形式是HY在PH2.67~6.16的溶液中,主要存在形式是H2Y2-:在pH=6.16一 10.26的 液中,主要存在形式是HY,在pH很大(一12)时才儿平完全以Y形式存 在。 EDTA与金属离子的配合物 在EDTA分子的结构中,具有六个可与金属离子形成配位键的原子(两个氨基氨和四 个按基氧,它们都有孤对电子,能与金屈离子形成阳位键),因而,EDTA可以与金屈离了 形成配位数为4或6的稳定的配合物。EDTA与金属离子的配位反应具有以下几方面的特点: (I)EDTA与许多的金属离于可形成配位比为1:1的稳定配合物,例如: Ca2*+Y4-一CaY2 Fe3++y4-FeY 故反应中无逐级配位现象,反应的定量关系明确。只有极少数金属离子「如Z:(V)和Mo (M)等」例外。 (2)EDTA与多数金属离子形成的配合物具有相当的稳定性。从EDTA与Ca+。Fe 的配合物的结构图(如图5一2所示)可以看出,EDTA与金屈离子配位时形成五个五元环 其中四 个是 五 元环 一个 -CS五元环,具有这种环状结构的配合物称为整合物(chd©.从配合物的研 究可知,具有五元环或六元环的整合物很稳定,而且所形成的环愈多,整合物愈稳定。因而 EDTA与大多数金属离子形成的整合物具有较大的稳定性 图5-2EDTA与C2,F的配合物的结构示意图 (3)DTA与金屈离子的配合物大多带电荷,水溶性好,反应速率较快,而且无色金属离 子与EDTA生成的配合物 深。滴定时 ,如遇有色的金属离子 上述特点说明EDTA和金属离子的配位反应能够符合滴定分析对反应的要求。 金属离子与EDTA(简单表示成Y)的配位反应,略去电荷,可简写成: M+Y-MY 其稳定常数KY为 K-[MIY] (5-2)
在 pH=1.6~2.0 的溶液中,主要以 H4Y 形式存在;在 PH=2.0~2.67 的溶液中,主要 存在形式是 H3Y 一;在 PH=2.67~6.16 的溶液中,主要存在形式是 H2Y 2 一;在 pH=6.16~ 10.26 的溶液中,主要存在形式是 HY3 一,在 pH 很大(>12)时才几乎完全以 Y 4-形式存 在。 EDTA 与金属离子的配合物 在 EDTA 分子的结构中,具有六个可与金属离子形成配位键的原子(两个氨基氮和四 个竣基氧,它们都有孤对电子,能与金属离子形成配位键),因而,EDTA 可以与金属离子 形成配位数为 4或6 的稳定的配合物。EDTA 与金属离子的配位反应具有以下几方面的特点: (1)EDTA 与许多的金属离于可形成配位比为 1:1 的稳定配合物,例如: 故反应中无逐级配位现象,反应的定量关系明确。只有极少数金属离子「如 Zr(Ⅳ)和 Mo (Ⅵ)等」例外。 (2)EDTA 与多数金属离子形成的配合物具有相当的稳定性。从 EDTA 与 Ca2+。Fe3+ 的配合物的结构图(如图 5—2 所示)可以看出,EDTA 与金属离子配位时形成五个五元环 ( 其 中 四 个 是 五 元 环 , 一 个 五元环),具有这种环状结构的配合物称为螫合物(chelate)。从配合物的研 究可知,具有五元环或六元环的鳌合物很稳定,而且所形成的环愈多,鳌合物愈稳定。因而 EDTA 与大多数金属离子形成的鳌合物具有较大的稳定性。 (3)EDTA 与金属离子的配合物大多带电荷,水溶性好,反应速率较快,而且无色金属离 子与 EDTA 生成的配合物仍为无色,但有色的金属离子与 EDTA 形成的配合物其颜色将加 深。滴定时,如遇有色的金属离子,则试液的浓度不宜过大,否则将影响指示剂的终点显示。 上述特点说明 EDTA 和金属离子的配位反应能够符合滴定分析对反应的要求。 金属离子与 EDTA(简单表示成 Y)的配位反应,略去电荷,可简写成: 其稳定常数 KMY 为

一些常见金属离子与EDTA配合物的稳定常数参见表5一1。 表5一1D门TA与一些常见金属离子的配合物的稳定常数 (溶液离子强度1■0.1moL-1,温度293K) 阳离子 阳离子 阳离子gKw Na" 1.66 Ce 15.98 C2+ 18.80 Li 2.79 16.3 20.3 Ag 7.32 Co* 16.31 Ti3 21.3 B 7.8 16.3 Hg. 21.8 8.69 16.46 22.1 8.73 16.50 23.2 9.20 p%2+ 18.04 C2+ 23.4 Ca2 10.69 18.09 25.1 Mn 13.87 18.1 25.8 Fe 14.33 18.60 3+ 27.94 Le. 15.50 188 36.0 由表5一可见,金属离子与EDTA形成的配合物的稳定性与金属离子的种类有关。碱 金属离子的配合物最不稳定:碱土金属离子的配合物电gKv=8~11:过渡元素、稀士元 素、AI计的配合物gK=15~19:其他三价、四价金屈离子和Hg2的配合物gKMY>20。 这些配合物稳定性的差别,主要决定于金属离子本身的离子电荷、离子半径和电子层结构。 这些是金属离子影响配合物稳定性大小的本质因素。 EDTA与金属离子形成的配合物的稳定性对配位滴定反应的完全程度有着重要的影响 可以用gKY衡量在不发生副反应情况下,配合物的稳定程度。但外界条件如溶液的酸度 其他配位剂的存在、干扰离子等对配位滴定反应的完全程度也都有着较大的影响,尤其是溶 液的酸度对EDTA在溶液中的存在形式、金属离子在溶液中的存在形式和EDTA与金属离 子形成的配合物的稳定性均产生显著的影响。因此在几种外界条件中,酸度对金属离子与 EDTA形成的配合物的稳定性的影响常常是配位滴定中首先应考虑的问题。 §5一3外界条件对EDTA与金属离子配合物稳定性的影响 在EDTA滴定中, 被测金属离子M与EDI 配位 生成配合物MY,此为主反应 反 应物MY及反应产物MY都可能同溶液中其他组分发生副反应,使MY配合物的稳定性 到影响,如下式所示:
一些常见金属离子与 EDTA 配合物的稳定常数参见表 5一 1。 由表 5—l 可见,金属离子与 EDTA 形成的配合物的稳定性与金属离子的种类有关。碱 金属离子的配合物最不稳定;碱土金属离子的配合物电 lg KMY=8~11;过渡元素、稀土元 素、AI3+的配合物 lg KMY= 15~19 ;其他三价、四价金属离子和 Hg2+的配合物 lg KMY>20。 这些配合物稳定性的差别,主要决定于金属离子本身的离子电荷、离子半径和电子层结构。 这些是金属离子影响配合物稳定性大小的本质因素。 EDTA 与金属离子形成的配合物的稳定性对配位滴定反应的完全程度有着重要的影响, 可以用 lg KMY衡量在不发生副反应情况下,配合物的稳定程度。但外界条件如溶液的酸度、 其他配位剂的存在、干扰离子等对配位滴定反应的完全程度也都有着较大的影响,尤其是溶 液的酸度对 EDTA 在溶液中的存在形式、金属离子在溶液中的存在形式和 EDTA 与金属离 子形成的配合物的稳定性均产生显著的影响。因此在几种外界条件中,酸度对金属离子与 EDTA 形成的配合物的稳定性的影响常常是配位滴定中首先应考虑的问题。 §5—3 外界条件对 EDTA 与金属离子配合物稳定性的影响 在 EDTA 滴定中,被测金属离子 M 与 EDTA 配位,生成配合物 MY,此为主反应。反 应物 M,Y 及反应产物 MY 都可能同溶液中其他组分发生副反应,使 MY 配合物的稳定性受 到影响,如下式所示:

M MY 主反应 M(OH)ML HY NY MHY MOHY 副反应 M(OH).ML 羟基配位辅助配位 酸效应干找离子 混合配位 效应效应 效应 效应 式中L为辅助配位剂,N为干扰离子。 金属离子与OH或辅助配位剂L发生的副反应,EDTA与H或干扰离子发生副反应, 都不利于主反应的进行,而反应产物MY发生的副反应,在酸度较高情况下,生成酸式配 合物MHY:在碱度较高时,生成M(OH)Y、M(OH)Y等威式阳合物,这些副反 应称为混合配位效应,它有利于主反应的进行。但其产物大多数不太稳定,其影响可以忽略 不计。下面者重对酸效应、配位效应分别加以讨论 EDTA的酸效应及酸效应系数ayD: EDTA与金屈离子的反应本质是Y离子与金屈离子的反应。由EDTA的离解平衡可 知,Y离子只是EDTA各种存在形式中的一种,只有当pH≥12时,EDTA才全部以Y离 子形式有车,溶液出减小,将使式51回所示的平衡向左移动,产生Y比Y Y离子减少,因而使EDTA与金属离子的反应能力降低。这种由于H离子与Y离子作用 而使Y离子参与主反应能力下降的现象称为EDTA的酸效应。酸效应的大小用酸效应系数 aD来衡量。酸效应系数表示在一定P阳下EDTA的各种存在形式的总浓度[Y'」与能 参加配位反应的Y+的平衡浓度之比。即 (5-3) 式中:[Y]=[Y-]+[HY3-]+[HY2-]+[HY]+[HY]+ [HsY']+[HY2 ov-[Y]+[HY]+[HY]+[Hy]+[HY]+(HY]+[HY] Y -默以头 「H+]4 KKKK人KK 「H16 =1+H]+[H2+[H]+a4[H]+ B[H*]5+B[H'] (5-4) 式中B为累积稳定常数,其中: 月=1/Ka2=1/八K,K,3=1/(KKK), 由上述计算关系可见,酸效应系数与EDTA的各级离解常数和溶液的酸度有关。在 定温度下,离解常数为定值,因而aY仅随着溶液酸度而变。溶液酸度越大,a值越 大,表示酸效应引起的剧反应越严重。如果氢离子与Yˉ之间没有发生副反应,即未参加配
式中 L 为辅助配位剂,N 为干扰离子。 金属离子与 OH-或辅助配位剂 L 发生的副反应,EDTA 与 H +或干扰离子发生副反应, 都不利于主反应的进行,而反应产物 MY 发生的副反应,在酸度较高情况下,生成酸式配 合物 MHY ;在碱度较高时,生成 M(OH)Y、M(OH)2Y 等碱式配合物,这些副反 应称为混合配位效应,它有利于主反应的进行。但其产物大多数不太稳定,其影响可以忽略 不计。下面着重对酸效应、配位效应分别加以讨论。 EDTA 的酸效应及酸效应系数αY(H). EDTA 与金属离子的反应本质是 Y 4-离子与金属离子的反应。由 EDTA 的离解平衡可 知,Y 4-离子只是 EDTA 各种存在形式中的一种,只有当 pH≥12 时,EDTA 才全部以 Y 4-离 子形式存在。溶液 pH 减小,将使式 5一 1回所示的平衡向左移动,产生 HY3-、H2Y 2- Y 4-离子减少,因而使 EDTA 与金属离子的反应能力降低。这种由于 H +离子与 Y 4-离子作用 而使 Y 4-离子参与主反应能力下降的现象称为 EDTA 的酸效应。酸效应的大小用酸效应系数 αY(H)来衡量。酸效应系数表示在一定 PH 下 EDTA 的各种存在形式的总浓度[Y′」与能 参加配位反应的 Y 4-的平衡浓度之比。即 式中β为累积稳定常数,其中: 由上述计算关系可见,酸效应系数与 EDTA 的各级离解常数和溶液的酸度有关。在一 定温度下,离解常数为定值,因而αY(H)仅随着溶液酸度而变。溶液酸度越大,αY(H)值越 大,表示酸效应引起的副反应越严重。如果氢离子与 Y 4-之间没有发生副反应,即未参加配
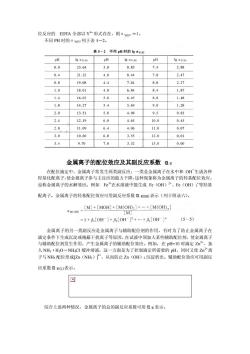
位反应的EDTA全部以Y形式存在,则aYm=1. 不同PH时的aYm列于表5-2。 表5-2不同pH时的gam PH Ig avuo pH lg avn H Ig ay(H) 0.0 23.64 3.8 8.85 7.4 2.88 0.4 21.32 4.0 8.44 7.8 2.47 0.8 19.08 4.4 7.64 8.0 2.27 1.0 18.01 4.8 6.84 8.4 1.87 1.4 16.02 5.0 6.45 88 1.48 1.8 14.27 5.4 5.69 9.0 1,28 2.0 13.51 5.8 4.98 9.5 0.3 2.4 12.19 6.0 4.65 10.0 0.45 2.8 11.09 6.4 4.06 11.0 0.07 3.0 10.60 6.8 3.55 12.0 0.01 3.4 9.70 7.0 3.32 13.0 0.00 金属离子的配位效应及其副反应系数α 在配位滴定中,金属离子常发生两类副反应:一类是金属离子在水中和O生成各种 羟基化配离子,使金属离子参与主反应的能力下降,这种现象称为金属离子的羟基配位效应, 也称金属离子的水解效应。例如Fe在水溶液中能生成Fe(OH)2+、Fe(OH)等羟基 配离子。金属离子的羟基配位效应可用副反应系数(M(O用表示(列于附录六)。 [M]+[MOH]+[M(D(M(OH)] =1+月[OH]+g2[OH]2+.+B.[OH]" (5-5) 金屈离子的另一类副反应是金属离子与辅助配位剂的作用,有时为了防止金属离子在 滴定条件下生成沉淀或掩蔽干扰离子等原因,在试液中须加人某些辅助配位剂,使金属离子 与辅助配位剂发生作用,产生金属离子的辅助配位效应。例如,在pH=10时滴定Z+,加 人NH·HO一NHC1缪冲溶液,这一方面共为了控制滴定所需要的H,同时又使Z+离 子与NH配位形成Z(NH)了”,从而防止Z(OH)2沉淀析出。辅助配位效应可用副反 应系数aM)表示。 因 综合上述两种情况,金属离子的总的副反应系数可用αM表示:
位反应的 EDTA 全部以 Y 4-形式存在,则αY(H)=1。 不同 PH 时的αY(H)列于表 5-2。 金属离子的配位效应及其副反应系数 α M 在配位滴定中,金属离子常发生两类副反应:一类是金属离子在水中和 OH-生成各种 羟基化配离子,使金属离子参与主反应的能力下降,这种现象称为金属离子的羟基配位效应, 也称金属离子的水解效应。例如 Fe3+在水溶液中能生成 Fe(OH)2+、Fe(OH)2 +等羟基 配离子。金属离子的羟基配位效应可用副反应系数α M(OH)表示(列于附录六)。 金属离子的另一类副反应是金属离子与辅助配位剂的作用,有时为了防止金属离子在 滴定条件下生成沉淀或掩蔽干扰离子等原因,在试液中须加人某些辅助配位剂,使金属离子 与辅助配位剂发生作用,产生金属离子的辅助配位效应。例如,在 pH=10 时滴定 Zn2+,加 人 NH3·H2O-NH4CI 缓冲溶液,这一方面是为了控制滴定所需要的 pH,同时又使 Zn2+离 子与 NH3 配位形成[Zn(NH3)] 2+,从而防止 Zn(OH)2 沉淀析出。辅助配位效应可用副反 应系数α M(L)表示。 综合上述两种情况,金属离子的总的副反应系数可用α M 表示:

aw阁 (5-7) 式中[M为游离金属离子浓度:M']为M叶MO+MOH2++ [M(OH)n]+[ML]+[ML2]++[MLn]. 对含辅助配位剂L的溶液,经推导可得 aM=AM(L)+aM(OH)-1 (5-8) 条件稳定常数 由于实际反应中存在诸多副反应,它们对EDTA与金属离子的主反应有着不同程度的 影响,因此,必须对式(S一2)表示的配合物的稳定常数进行修正,现仅考虑EDTA的酸 效应的影响,则从式(5一3)可得 = (5-9) 将式(5一9)代人式(5一2),则得 (5-10) 上式中K'W是考虑了酸效应后EDTA与金属离子配合物的稳定常数,称为条件稳定常 数。即在一定酸度条件下用EDTA溶液总浓度表示的稳定常数。它的大小说明溶液的酸度 对配合物实际稳定性的影响,pH越大,gαYm值越小,条件稳定常数越大,配位反应越完全, 对滴定越有利:反之pH降低,条件稳定常数将减小,不利于滴定。 K'是条件稳定常数的笼统表示。为了明确表示哪些组分发生了副反应,可将“, 标在发生副反应的组分的右上方.例如仅是EDTA发生副反应,写作Kr':苦综合考虑EDTA 的酸效应和金属离子的配位效应,则应同时考虑αY和α,此时的条件稳定常数应写作 KY': ☒ 条件稳定常数K'Y',是以EDTA总浓度和金属离子总浓度表示的稳定常数,其大小 说明溶液酸碱度和辅助配位效应对配合物实际稳定程度的影响。采用K:Y能更正确地判 断金属离子和EDTA的配位情况。同时,利用式(5一11)可以计算金属离子浓度,但所算 得的是[M']而不是M,需要再通过α的校正才能求得M
式中[M]为游离金属离子浓度;[M′] 为 [M]+ [MOH]+ [M(OH)2]+.+ [M(OH)n]+[ML]+[ML2]+.+[MLn]。 对含辅助配位剂 L 的溶液,经推导可得 条件稳定常数 由于实际反应中存在诸多副反应,它们对 EDTA 与金属离子的主反应有着不同程度的 影响,因此,必须对式(5—2)表示的配合物的稳定常数进行修正,现仅考虑 EDTA 的酸 效应的影响,则从式(5一 3)可得 将式(5—9)代人式(5—2),则得 上式中 K′MY 是考虑了酸效应后 EDTA 与金属离子配合物的稳定常数,称为条件稳定常 数。即在一定酸度条件下用 EDTA 溶液总浓度表示的稳定常数。它的大小说明溶液的酸度 对配合物实际稳定性的影响。pH 越大,lgα Y(H)值越小,条件稳定常数越大,配位反应越完全, 对滴定越有利;反之 pH 降低,条件稳定常数将减小,不利于滴定。 K′MY 是条件稳定常数的笼统表示。为了明确表示哪些组分发生了副反应,可将“′’ 标在发生副反应的组分的右上方。例如仅是 EDTA发生副反应,写作 KMY′;苦综合考虑EDTA 的酸效应和金属离子的配位效应,则应同时考虑α Y(H)和α M,此时的条件稳定常数应写作 KM′Y′: 条件稳定常数 KM′Y′,是以 EDTA 总浓度和金属离子总浓度表示的稳定常数,其大小 说明溶液酸碱度和辅助配位效应对配合物实际稳定程度的影响。采用 KM′Y′能更正确地判 断金属离子和 EDTA 的配位情况。同时,利用式(5-11)可以计算金属离子浓度,但所算 得的是[M′]而不是[M],需要再通过α M 的校正才能求得[M]
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第三章 酸碱反应和沉淀反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第二章 化学反应的方向、速率和限度.pdf
- 《基础化学》课程授课教案(无机化学讲义)第一章 化学反应中的质量关系和能量关系.pdf
- 内蒙古科技大学:《基础化学》课程教学大纲 Basic Chemistry(负责人:李国祥).pdf
- 《物理化学》课程教学资源(名词术语)物理化学专业术语中英文对照表.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十章 醇、酚、醚.pdf
- 《基础化学》课程授课教案(物理化学讲义)第一章 第零定律与物态方程.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十三章 羧酸衍生物.pdf
- 《基础化学》课程授课教案(物理化学讲义)第二章 热力学第一定律.pdf
- 《基础化学》课程授课教案(物理化学讲义)第五章 化学平衡.pdf
- 《基础化学》课程授课教案(物理化学讲义)第四章 溶液(Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第三章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第二部分 电解与极化作用(electrolysis and polarization).pdf
