《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素
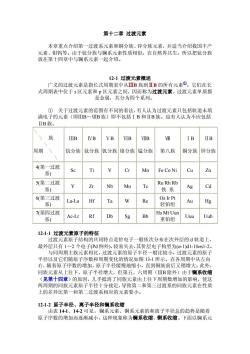
第十二章过渡元素 本章重点介绍第一过渡系元素和铜分族、锌分族元素,并适当介绍我国丰产 12-1过渡元素概述 广义的过渡元素是指长式周期表中从ⅢB族到ⅡB的所有元素①。它们在长 式周期表中位于s区元素和p区元素之间,因而称为过渡元素。过渡元素单质都 是金属,共分为四个系列。 ① 关于过渡元素的范围有不同的看法,有人认为过渡元素只包括轨道未填 满电子的元素(即IB~WB族)即不包括IB和ⅡB族。也有人认为不应包括 IⅡB族。 IB IVB VB VIB VIIB IB IIB 周期 钪分族钛分族钒分族铬分族锰分族 第八族 铜分族锌分族 4第一过渡 系) Se Ti Cr Mn Fe Co Ni Cu Zn 5(第二过渡 Ru Rh Rb Zr Nb Mo Tc 系) 铁系 Ag Cd 6(第三过渡 Os Ir Pt La-Lu Hf Ta Re Au Hg 系) 轻铂组 7(第四过渡 Hs Mt Uun Ac-Lr Rf Db Sg Bh Uuu Uub 系) 重细组 12-1-1过渡元素原子的特征 过渡元素原子结构的共同特点是价电子一般依次分布在次外层的轨道上 最外层只有1~2个电子(Pd例外),较易失去,其价层电子构型为(n-1)d1-10sl-2。 与同周期主族元素相比,过渡元素的原子半径一般比较小,过渡元素的原子 半径以及它们随原子序数和周期变化的情况如图13-1所示。在各周期中从左向 右,随着原子序数的增加,原子半径缓慢地缩小,直到铜族前后又稍增大。此外 同族元素从上往下,原子半径增大,但第五、六周期(ⅢB除外)由于镧系收缩 (见第十四章)的原因,几乎抵消了同族元素由上往下周期数增加的影响,使这 两周期的同族元素原子半径十分接近,导致第二和第三过渡系的同族元素在性质 上的差异比第一和第二过渡系相应的元素要小。 12.12佰子华径、离子华径知物系收馆 由表14-1 142可见 钢系元 钢系元素的和离子半径总的趋势是随着 原子序数的增加而逐渐减小,这种现象称为镧系收缩、锕系收缩。下面以镧系元
第十二章 过渡元素 本章重点介绍第一过渡系元素和铜分族、锌分族元素,并适当介绍我国丰产 元素、钼钨等。由于钪分族与镧系元素性质相似,在自然界共生,所以把钪分族 放在第十四章中与镧系元素一起介绍。 12-1 过渡元素概述 广义的过渡元素是指长式周期表中从ⅢB 族到ⅡB 的所有元素①。它们在长 式周期表中位于 s 区元素和 p 区元素之间,因而称为过渡元素。过渡元素单质都 是金属,共分为四个系列。 ① 关于过渡元素的范围有不同的看法,有人认为过渡元素只包括轨道未填 满电子的元素(即ⅢB~ⅦB族)即不包括ⅠB 和ⅡB族。也有人认为不应包括 ⅡB族。 \ \ 族 \ 周期 \ \ ⅢB 钪分族 ⅣB 钛分族 ⅤB 钒分族 ⅥB 铬分族 ⅦB 锰分族 Ⅷ 第八族 ⅠB 铜分族 ⅡB 锌分族 4(第一过渡 系) Sc Ti V Cr Mn Fe Co Ni Cu Zn 5(第二过渡 系) Y Zr Nb Mo Tc Ru Rh Rb 铁 系 Ag Cd 6(第三过渡 系) La-Lu Hf Ta W Re Os Ir Pt 轻铂组 Au Hg 7(第四过渡 系) Ac-Lr Rf Db Sg Bh Hs Mt Uun 重铂组 Uuu Uub 12-1-1 过渡元素原子的特征 过渡元素原子结构的共同特点是价电子一般依次分布在次外层的 d 轨道上, 最外层只有 1~2 个电子(Pd 例外),较易失去,其价层电子构型为(n-1)d1-10ns1-2。 与同周期主族元素相比,过渡元素的原子半径一般比较小,过渡元素的原子 半径以及它们随原子序数和周期变化的情况如图 13-1 所示。在各周期中从左向 右,随着原子序数的增加,原子半径缓慢地缩小,直到铜族前后又稍增大。此外, 同族元素从上往下,原子半径增大,但第五、六周期(ⅢB除外)由于镧系收缩 (见第十四章)的原因,几乎抵消了同族元素由上往下周期数增加的影响,使这 两周期的同族元素原子半径十分接近,导致第二和第三过渡系的同族元素在性质 上的差异比第一和第二过渡系相应的元素要小。 12-1-2 原子半径、离子半径和镧系收缩 由表 14-1、14-2 可见,镧系元素、锕系元素的和离子半径总的趋势是随着 原子序数的增加而逐渐减小,这种现象称为镧系收缩、锕系收缩。下面以镧系元

素为例说明。 1.原子半径 在镧系元素的原子中,电子逐个填充4f亚层,由于f电子对原子核的屏蔽 效应较大,所以随着原子序数的增加,有效核电荷缓慢增大,结果使原子半径缓 慢缩小。但从图14-2可以看到,在总的收缩趋势中,Eu和Yb原子半径比较大。 原因是Eu和Yb分别具有半充满(4)和全充满(44)电子层结构,这一相对稳定 结构对核电荷的屏蔽增强,它们的原子半径便明显增大 镧系元素 子半径在Eu和 b处出现骤升的峰值(图142) 与其相对应的 是镧系元素的熔点随着原子序数的增加逐渐升高的过程中,在Eu和Yb处出现 陡降的谷值[图143(a小:Eu(4f)和Yb(4f)为稳定构型,镧系元素原子第 三电离能总和,随着原子序数的增加而增大的过程中,在Eu,Yb处出现骤升的 峰值(图14-3b),就像出现两个山峰或山谷一样,这种现象叫做镧系元素性质递 变的 “双峰效应 2.离子半径 Ln*半径在86~103pm之间,与其它氧化值相同的金属离子相比是比较大的 (A+为53.5pm,Cr3+为61.5pm,Fe3+为64.5pm:Co3为63pm),与原子半径由 La到Lu在Eu、Yb处会出现峰的变化有所不同,Ln*半径的变化是十分有规律 的,如图144所示。Ln*己无6s和5d电子,最外层皆为5s25p结构,La到 L有效核电荷依 增加比 中显著:从La到L心 总共收缩17pm。Ln 带电荷相同,而且Ln3的构型及半径相差不大,致使Ln”性质极为相似:其离 子化合物的溶解度、氢氧化物的酸碱性、配合物的稳定常数,离子晶体的品格能 等彼此都很接近,造成L间分离上的困难。 3期系收缩的后里 系收缩 钢系收缩是元素化学中的一个重要现象。受镧系收缩的影响 方面铕以后的镧系元素的离子半径接近钇,构成性质极为相似的一组元素,称为 钇组元素,它们在自然界中共生,性质十分相似,难于分离:另一方面,第三过 渡系与第二过渡系的同族元素在原子半径(或离子半径)上相近,其中尤以ⅣB族 中的Zr和Hf、VB族中的Nb和Ta、VIB族中的Mo和W更为相近,以致Zr 和Hf、Nb和Ta、Mo和W的性质非常相似, 分离十分闲难 121-2单质的物理性质 过渡金属外观多呈银白色或灰白色,有光泽。除钪和钛属轻金属外,其余均 属重金属,其中以重铂组元素最重,饿、铱、铂的密度依次为22.61、22.65、 21.45gcm3。 多数过渡金属(ⅡB族元素除外)的熔点、沸点高,硬度大。熔点、沸点最 高的是钨(熔点3410C 沸点566 硬度最大的是铬(仅次于金刚石) 究其原因,一般认为是过渡元素的原子半径较小而彼此堆积很紧密,同时金属原 子间除了主要以金屈键结合外,还可能有部分共价性,这与金属原子中未成对 的(n1)d电子也参与成键有关。 12.13会属活滑性 过渡金属在水溶液中的活泼性,可根据标准电极电势(E)来判断
素为例说明。 1. 原子半径 在镧系元素的原子中,电子逐个填充 4f 亚层,由于 f 电子对原子核的屏蔽 效应较大,所以随着原子序数的增加,有效核电荷缓慢增大,结果使原子半径缓 慢缩小。但从图 14-2 可以看到,在总的收缩趋势中,Eu 和 Yb 原子半径比较大。 原因是 Eu 和 Yb 分别具有半充满(4f7 )和全充满(4f14)电子层结构,这一相对稳定 结构对核电荷的屏蔽增强,它们的原子半径便明显增大。 镧系元素的原子半径在 Eu 和 Yb 处出现骤升的峰值(图 14-2),与其相对应的 是镧系元素的熔点随着原子序数的增加逐渐升高的过程中,在 Eu 和 Yb 处出现 陡降的谷值[图 14-3(a)];Eu(4f7 )和 Yb(4f14)为稳定构型,镧系元素原子第一、二、 三电离能总和,随着原子序数的增加而增大的过程中,在 Eu,Yb 处出现骤升的 峰值(图 14-3(b)),就像出现两个山峰或山谷一样,这种现象叫做镧系元素性质递 变的“双峰效应”。 2. 离子半径 Ln3+半径在 86~103pm 之间,与其它氧化值相同的金属离子相比是比较大的 (Al3+为 53.5pm,Cr3+为 61.5 pm,Fe3+为 64.5 pm;Co 3+为 63pm),与原子半径由 La 到 Lu 在 Eu、Yb 处会出现峰的变化有所不同,Ln3+半径的变化是十分有规律 的,如图 14— 4 所示。Ln3+已无 6s 和 5d 电子,最外层皆为 5s2 5p6结构,La 到 Lu 有效核电荷依次增加比在原子中显著;从 La3+到 Lu3+总共收缩 17pm。Ln3+所 带电荷相同,而且 Ln3+的构型及半径相差不大,致使 Ln3+ 性质极为相似:其离 子化合物的溶解度、氢氧化物的酸碱性、配合物的稳定常数,离子晶体的晶格能 等彼此都很接近,造成 Ln3+间分离上的困难。 3. 镧系收缩的后果 镧系收缩、锕系收缩是元素化学中的一个重要现象。受镧系收缩的影响,一 方面铕以后的镧系元素的离子半径接近钇,构成性质极为相似的一组元素,称为 钇组元素,它们在自然界中共生,性质十分相似,难于分离;另一方面,第三过 渡系与第二过渡系的同族元素在原子半径(或离子半径)上相近,其中尤以ⅣB 族 中的 Zr 和 Hf、VB 族中的 Nb 和 Ta、ⅥB 族中的 Mo 和 W 更为相近,以致 Zr 和 Hf、Nb 和 Ta、Mo 和 W 的性质非常相似,分离十分困难。 12-1-2 单质的物理性质 过渡金属外观多呈银白色或灰白色,有光泽。除钪和钛属轻金属外,其余均 属重金属,其中以重铂组元素最重,锇、铱、铂的密度依次为 22.61、22.65、 21.45g·cm-3。 多数过渡金属(ⅡB 族元素除外)的熔点、沸点高,硬度大。熔点、沸点最 高的是钨(熔点 3410℃,沸点 5660℃),硬度最大的是铬(仅次于金刚石)。 究其原因,一般认为是过渡元素的原子半径较小而彼此堆积很紧密,同时金属原 子间除了主要以金属键结合外,还可能有部分共价性 ,这与金属原子中未成对 的(n-1)d 电子也参与成键有关。 12-1-3 金属活泼性 过渡金属在水溶液中的活泼性,可根据标准电极电势(E Ө)来判断
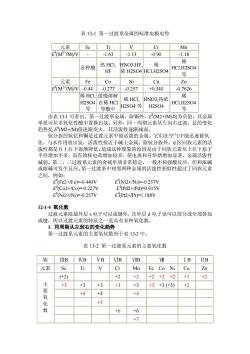
表13-1第一过渡系金属的标准电极电势 元素 Se Ti Mn E(MM/V -1.63 -113 -0.90 -118 各种酸 热HC 浓H2S04HC1H2S04 等 元素 Fe Co Ni Cu Zn M2*M/W-0.44-0.277 -0.257 +0.340 -0.7626 稀HC1缓慢容解 希HCL HNO3执浓 H2SO4在稀HC1 HCLH2S04 H2S04等 H2S04 等酸中 由表131可看出,第 过渡系金属,除铜外 E(M2 +M均为负值, 其金 单质可从非氧化性酸中置换出氢。另外,同一周期元素从左向右过渡,总的变化 趋势是M2+M值逐渐变大,其活泼性逐渐减弱。 钪分族的钪钇和镧是过波元素中最活泼的金属。它们在空气中能迅速被氧 化,与水作用放出氢,活泼性接近于碱土金属。除钪分族外,d区同族元素的活 性都是自上往 下逐渐 造成这种现象的原因是由 素从上往 径增加不多,而有效核电荷增加较多,使电离和升华焓增加显著,金属活泼 减弱。第二、三过渡系元素的金属单质非常稳定,一般不和强酸反应,但和浓碱 或熔碱可发生反应。第一过渡系中相邻两种金属的活泼性相似性超过了同族元素 之间,例如: EFe2+/Fe)=0.440 E(Co2+/Co0.227八 ENi2+/Ni)=0.257V E(Pt2+/Pt)=1.188V 12-1-4氧化数 过渡元素除最外层s电子可以成键外,次外层电子也可以部分或全部参加 成键,所以过渡元素的特征之一是具有多种氧化数】 1.同周期从左到右的变化趋势 第一过渡系元素的主要氧化数列于表132中。 表13-2第一过渡系元素的主要氧化数 族UIB IVB VB VIB VIB 元素Sc Ti V Cr Mn Fe Co Ni Cu Zn (+2) +2 +2+2+2+2+1 +2 主要氧 +3 +3 +3 +3 +3 +3+3(+3) +2 +4 +4 +5 6 +6 +7
表 13-1 第一过渡系金属的标准电极电势 元素 Sc Ti V Cr Mn E θ (M2+/M)/V - -1.63 -1.13 -0.90 -1.18 各种酸 热 HCl, HF HNO3,HF, 浓 H2SO4 稀 HCl,H2SO4 稀 HCl,H2SO4 等 元素 Fe Co Ni Cu Zn E θ (M2+/M)/V -0.44 -0.277 -0.257 +0.340 -0.7626 稀 HCl, H2SO4 等 缓慢溶解 在稀 HCl 等酸中 稀 HCl, H2SO4 等 HNO3,热浓 H2SO4 稀 HCl,H2SO4 等 由表 13-1 可看出,第一过渡系金属,除铜外,E θ (M2+/M)均为负值,其金属 单质可从非氧化性酸中置换出氢。另外,同一周期元素从左向右过渡,总的变化 趋势是 E θ (M2+/M)值逐渐变大,其活泼性逐渐减弱。 钪分族的钪钇和镧是过渡元素中最活泼的金属。它们在空气中能迅速被氧 化,与水作用放出氢,活泼性接近于碱土金属。除钪分族外,d 区同族元素的活 泼性都是自上往下逐渐降低。造成这种现象的原因是由于同族元素从上往下原子 半径增加不多,而有效核电荷增加较多,使电离和升华焓增加显著,金属活泼性 减弱。第二、三过渡系元素的金属单质非常稳定,一般不和强酸反应,但和浓碱 或熔碱可发生反应。第一过渡系中相邻两种金属的活泼性相似性超过了同族元素 之间,例如: E θ (Fe2+/Fe)=-0.440V E θ (Ni2+/Ni)=-0.257V E θ (Co2+/Co)=-0.227V E θ (Pd2+/Pd)=0.915V E θ (Ni2+/Ni)=-0.257V E θ (Pt2+/Pt)=1.188V 12-1-4 氧化数 过渡元素除最外层 s 电子可以成键外,次外层 d 电子也可以部分或全部参加 成键,所以过渡元素的特征之一是具有多种氧化数。 1. 同周期从左到右的变化趋势 第一过渡系元素的主要氧化数列于表 13-2 中。 表 13-2 第一过渡系元素的主要氧化数 族 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn (+2) - - +2 +2 +2 +2 +2 +1 +2 +3 +3 +3 +3 +3 +3 +3 (+3) +2 - - +4 +4 - +4 - - - - - +5 - - - - - - - - +6 +6 - - - 主 要 氧 化 数 - - - - +7 - - -

表中红色字氧化数是稳定的氧化数,有括号的表示不稳定的氧化数。由表 13-2可见从左向右,随原子序数增加(21S -2s Mn) 元素最高氧化数逐渐增高, 但当3d轨道中电子数超过5时,元素最高氧化数又转向降低6一→2N,最后 与IB族元素的低氧化数相衔接。 图132中的弗洛斯特图可清楚的说明第一过渡系金属各氧化态的热力学稳 定性的变化趋势。 2.同族从上往下的变化趋势 铬分族VB)的弗洛斯特图见图133。 由表13-2及图13-3可以看出:(1)过 渡元素相邻两个氧化态的氧化数间的差值为1或2,而p区元素常为2。(2)ⅢB VⅦB族元素(个别镧系元素除外)的最高氧化态的氧化数与族号相等,但Ⅷ族元素 大多达不到+8。Sc、Ti族IIB一几VB)的高氧化态比较稳定。第一过度系的VB IB族元素最高氧化态的化合物不稳定:而第二、三过波系的高氧化态比较稳定, 即从上往下趋向于形成高氧化态化合物,这与p区ⅢA、NA、VA族元素恰好 相反 此外,许多过渡元素还能形成氧化数为0,1,-2,3的化合物,例如: 配合物 [Ni(CO)4] [Co(Co[Cr(Co为 [Mn(CO)]3 形成体氧化 0 -2 12-1-5非整比化合物 过渡元素的另 一个特点是易形成非整比(或称非化学计量)化合物。非整比 个较小的范围内变 寺基本结构不变。 例 O按立方密堆积排列,而Fe”在八面体空穴内,当Fe未占满所有空穴时,为 了保持电中性,在附近的空穴上由两个Fe+所占据(见图13-4)。 近年来发现非整比化合物有多方面的用途,例如作为固体电解质(ZO2】 12-1-6化合物的颜色 过渡元素的另一特征是它们所形成的配离子大都显色,这主要与过渡元素离 子的d轨道未填满电子有关。第一过渡系元素低氧化数水合离子的颜色如表13-3 所示。 表133第一过渡系元素的氧化数水合离子的颜色 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn M*中d电子数 234 5 6 789 10 MH,O2+颜· 褐紫天蓝浅桃红(儿浅绿粉红绿浅蓝无色
表中红色字氧化数是稳定的氧化数,有括号的表示不稳定的氧化数。由表 13-2 可见从左向右,随原子序数增加(21Sc→25Mn),元素最高氧化数逐渐增高, 但当 3d 轨道中电子数超过 5 时,元素最高氧化数又转向降低(26Fe→ 28Ni),最后 与ⅠB族元素的低氧化数相衔接。 图 13-2 中的弗洛斯特图可清楚的说明第一过渡系金属各氧化态的热力学稳 定性的变化趋势。 2. 同族从上往下的变化趋势 铬分族( B) Ⅵ 的弗洛斯特图见图 13-3。由表 13-2 及图 13-3 可以看出:(1)过 渡元素相邻两个氧化态的氧化数间的差值为 1 或 2,而 p 区元素常为 2。(2) B Ⅲ ~ ⅦB族元素(个别镧系元素除外)的最高氧化态的氧化数与族号相等,但Ⅷ族元素 大多达不到+8。Sc、Ti 族( B Ⅲ ~ⅣB)的高氧化态比较稳定。第一过渡系的ⅤB~ ⅦB族元素最高氧化态的化合物不稳定;而第二、三过渡系的高氧化态比较稳定, 即从上往下趋向于形成高氧化态化合物,这与 p 区ⅢA、ⅣA、ⅤA 族元素恰好 相反。 此外,许多过渡元素还能形成氧化数为 0,-1,-2,-3 的化合物,例如: 配合物 [Ni(CO)4] [Co(CO)4] - [Cr(CO)5] 2- [Mn(CO)4] 3- 形成体氧化 数 0 -1 -2 -3 12-1-5 非整比化合物 过渡元素的另一个特点是易形成非整比(或称非化学计量)化合物。非整比化 合物的化学组成不定,可在一个较小的范围内变动,而又保持基本结构不变。例 如 1000℃时 FeO 的组成实际在 Fe0.89O 到 Fe0.96O 之间变动。在 FeO 晶体中, O 2-按立方密堆积排列,而 Fe2+在八面体空穴内,当 Fe2+未占满所有空穴时,为 了保持电中性,在附近的空穴上由两个 Fe3+所占据(见图 13-4)。 近年来发现非整比化合物有多方面的用途,例如作为固体电解质(ZrO2, HfO2)用于各类化学电源和电化学器件中;还用作半导体(ZnO,Cu2O)以及超导体 (YBaCu3O7-x,x≤0.1)材料等。 12-1-6 化合物的颜色 过渡元素的另一特征是它们所形成的配离子大都显色,这主要与过渡元素离 子的 d 轨道未填满电子有关。第一过渡系元素低氧化数水合离子的颜色如表 13-3 所示。 表 13-3 第一过渡系元素的氧化数水合离子的颜色 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn M 2+中 d 电子数 - 2 3 4 5 6 7 8 9 10 [M(H2O)6] 2+ 颜 - 褐 紫 天蓝 浅桃红(几 浅绿 粉红 绿 浅蓝 无色

色 乎无色) M+中d电子数0 123 4 [MHO)颜色无紫绿蓝紫红浅紫绿粉红 同一中心离子与不同配体形成配合物时,由于品体场分裂能不同,则d一d 跃迁时所需能量也不同,亦即吸收光的波长不同,因此显不同的颜色。例如: [Ni0H,O62+ [Ni(NH3)12 d-d跃迁时吸收光的波长(O/nm 1176 925 配离子的颜色 果绿 蓝 由表13-3可以看出,d°和d°构型的中心离子形成的配合物,在可见光照射 下不发生d-d跃迁,如[Sc(HO)6(d、[Zn(H2O)62*(d)均为无色。 元 最 氧化态 电荷分别为M Vs+ 均为 电子构型,似也应为无色,之所以呈颜色是由电荷迁移引起的,例如MO:的紫 色是由于02→Mn电子跃迁(p-d跃迁)的吸收峰在可见光区18500cm处。 12-1-7配合性和催化性 过渡元素容易形成配合物。通常认为:过渡元素的原子或离子具有能级相近 的价层电子轨道n-1)d、 s和 其中s和p轨道是空的,(m1)d轨道是部分 本的孤电子对:而且过渡元素的 般具有较高的电荷和 不的半径极化力强,对配休有较强的吸引力。因此,进波元素具有根强的蜀 配合物的倾向。 许多过度元素及其化合物具有独特的催化性能。例如,在反应过程中,过渡 元素可形成不稳定的配合物,这些配合物作为中间产物可起到配位催化作用:又 如过渡元素也可通过提供适宜的反应表面,起到接触催化作用,以V0为触媒 制五SO4即为一例。 12-1-8磁性 多数过渡元素的原子或离子有未成对的电子,所以具有顺磁性。未成对的d 电子越多,磁矩4也越大(如表13-4所示)。 表13-4未成对d电子数与物质磁性的关系 离子V02+v+Cr*Mm㎡2+Fe2+Co2+N2*Cu2+ d电子数12356789
色 乎无色) M 3+中 d 电子数 0 1 2 3 4 5 6 7 [M(H2O)6] 3+颜色 无 紫 绿 蓝紫 红 浅紫 绿 粉红 同一中心离子与不同配体形成配合物时, 由于晶体场分裂能不同,则 d— d 跃迁时所需能量也不同,亦即吸收光的波长不同,因此显不同的颜色。例如: [Ni(H2O)6] 2+ [Ni(NH3)6] 2+ d-d 跃迁时吸收光的波长(λ)/nm 1176 925 配离子的颜色 果绿 蓝 由表 13-3 可以看出,d 0和 d 10 构型的中心离子形成的配合物,在可见光照射 下不发生 d-d 跃迁, 如 [Sc(H2O)6] 3+(d0 )、[Zn(H2O)6] 2+(d10)均为无色。 对于某些含氧酸根离子如 MnO4 - (紫色)、CrO4 2- (黄色)、VO4 3- (淡黄色),它们 中的金属元素均处于最高氧化态,其形式电荷分别为 Mn7+、Cr6+、V 5+,均为 d 0 电子构型,似也应为无色,之所以呈颜色是由电荷迁移引起的,例如 MnO4 -的紫 色是由于 O 2-→ Mn 7+电子跃迁(p-d 跃迁)的吸收峰在可见光区 18500cm-1处。 12-1-7 配合性和催化性 过渡元素容易形成配合物。通常认为:过渡元素的原子或离子具有能级相近 的价层电子轨道(n-1)d、ns 和 np,其中 ns 和 np 轨道是空的,(n-1)d 轨道是部分 空的,可以接受配体的孤电子对;而且过渡元素的离子一般具有较高的电荷和较 小的半径,极化力强,对配体有较强的吸引力。因此,过渡元素具有很强的形成 配合物的倾向。 许多过渡元素及其化合物具有独特的催化性能。例如,在反应过程中,过渡 元素可形成不稳定的配合物,这些配合物作为中间产物可起到配位催化作用;又 如过渡元素也可通过提供适宜的反应表面,起到接触催化作用, 以 V2O5为触媒 制 H2SO4 即为一例。 12-1-8 磁性 多数过渡元素的原子或离子有未成对的电子,所以具有顺磁性。未成对的 d 电子越多,磁矩 μ也越大(如表 13-4 所示)。 表 13-4 未成对 d 电子数与物质磁性的关系 离子 VO2+ V 3+ Cr3+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ d 电子数 1 2 3 5 6 7 8 9

未成对d电子 数 12354321 磁矩(B.M1.732.833.875.924.903.872.831.73 *1219金属原子簇化合物 过渡元素金属原子间有直接的键合作用,即可以形成含有金属一金属键的簇 状化合物。尤其是第 三过渡系元素,由于(m-1)轨道伸展较远,原子实之间 力较小,低氧化态离子半径又较大, 可形成较稳定的金属 -金属键,如Re2Clg 配离子,其中含有Rc一Re键(参见8-4-1中的相关内容): 近年来,此类簇化合物已合成出数千种,发展十分迅速。由于簇状化合物具 有特殊性质,如催化活性、光敏性等,而且其化学键不符合经典的成键规律,因 此具有理论意义和应用价值。例如铁一钉异核羰基簇氢化物FeRusH2(CO)1:对水 煤气转换反应有催化作用 FaRu2CO3,OHr亿二整膳A C0+H20 →h+C02 84配合物的类型和制备方法 841配合物的类型 5.原子簇状化合物 原子簇状化合物是指具有两个或两个以上金属原子以金属·金属(MM键)直 接结合而形成的化合物,简称簇合物。 过渡金属簇合物有很多类型:按配体分为:羰基簇、卤素簇:按金属原子 数分类,则有二核簇、三核簇、四核簇(金属原子数分别为2、3、4、余类推)等。 为便于理解,我们以最简单的双核簇合物R©C1g]为例,介绍其健型和性质。 RezCls]结构示意于图8-6中。 由该图提供的数据可见,Re-Re键长特别短(约224pm),比金属徕中Re-Re 键长(约276pm)短很多,而且两个Re原子上的C1原子之间距离(332pm)也 短于两个C原子的范德华半径之和,使RCI键处于排斥力最大的位置。 分析可以推测ReRe之间形成了多重键。ReCl共有24个价电子,8个Re-Cl 键用去I6个,剩下8个用来形成ReRe键,它们填充在一个o、两个π和一个8 分子轨道中,共有4个成键分子轨道,相当于一个四重键。如此高的键级可理解 为什么Re=Re键长缩短很多、键能较大(约为300~50 OkJ-mor),亦即[Re.Cls] 能够稳定存在
未成对 d 电子 数 1 2 3 5 4 3 2 1 磁矩(μ)/B.M 1.73 2.83 3.87 5.92 4.90 3.87 2.83 1.73 *12-1-9 金属原子簇化合物 过渡元素金属原子间有直接的键合作用,即可以形成含有金属— 金属键的簇 状化合物。尤其是第二、三过渡系元素,由于(n-1)d 轨道伸展较远,原子实之间 斥力较小,低氧化态离子半径又较大,可形成较稳定的金属— 金属键,如[Re2Cl8] 2- 配离子,其中含有 Re— Re 键(参见 8-4-1 中的相关内容): 近年来,此类簇化合物已合成出数千种,发展十分迅速。由于簇状化合物具 有特殊性质,如催化活性、光敏性等,而且其化学键不符合经典的成键规律,因 此具有理论意义和应用价值。例如铁— 钌异核羰基簇氢化物 FeRu3H2(CO)13对水 煤气转换反应有催化作用: CO + H2O H2 + CO2 8-4 配合物的类型和制备方法 8-4-1 配合物的类型 5. 原子簇状化合物 原子簇状化合物是指具有两个或两个以上金属原子以金属-金属(M-M 键)直 接结合而形成的化合物,简称簇合物。 过渡金属簇合物有很多类型;按配体分为:羰基簇、卤素簇.;按金属原子 数分类,则有二核簇、三核簇、四核簇(金属原子数分别为 2、3、4、余类推)等。 为便于理解,我们以最简单的双核簇合物[Re2Cl8] 2-为例,介绍其键型和性质。 [Re2Cl8] 2-结构示意于图 8-6 中。 由该图提供的数据可见,Re-Re 键长特别短(约 224pm),比金属铼中 Re-Re 键长(约 276pm)短很多,而且两个 Re 原子上的 Cl 原子之间距离(332pm)也 短于两个 Cl 原子的范德华半径之和,使 Re-Cl 键处于排斥力最大的位置。以上 分析可以推测 Re-Re 之间形成了多重键。[Re2Cl8] 2-共有 24 个价电子,8 个 Re-Cl 键用去 16 个,剩下 8 个用来形成 Re-Re 键,它们填充在一个 σ、两个 π和一个 δ 分子轨道中,共有 4 个成键分子轨道,相当于一个四重键。如此高的键级可理解 为什么 Re Re 键长缩短很多、键能较大(约为 300~500kJ·mol-1 ),亦即[Re2Cl8] 2- 能够稳定存在

12-2钛族、钒族元素 12-2-1钛族、钒族元素概述 周期表中d区VB族包括钛TD、锆(Z、铪HD、轳(RD四种元素:VB 族包括钒(V、能Nb、钽(Ta、(Db)四种元素。Rr、Db为人工合成的放射性 元素。 1.钛、错、给 为是 种稀有金属,是由于在自然界中存在分散和难于提取。但其相 对丰度在所有元素中居第十位。钛重要的矿石有金红石TiO2以钛铁矿(FeTiOs), 以及钒钛铁矿。我国钛资源丰富,攀西地区(四川攀枝花和西昌)的钒钛铁矿就有 几十亿吨,占全国储量92%以上。世界上已探明的钛储量中,我国约占一半。 皓和铪是稀有金属,主要矿石有英石ZSi04,铪常与皓共 度小、 低温、无磁性、 性好,并且具有优越的抗腐蚀性,尤其是对海水。钛表面形成一层致密的氧化物 保护膜,使之不被酸、碱侵蚀。基于上述优点,钛及其合金广泛地用于制造喷气 发动机、超音速飞机和潜水艇(防雷达、防磁性水雷)以及海军化工设备。此外, 钛与生物体组织相容性好,结合牢固,用于接骨和制造人工关节:钛具有隔热 高度稳定、质轻、坚固等特性,由纯钛制造的假牙是任何金属材料无法比拟的 所以钛又被称为生物金属。因此,继F、A之后,预计Ti将成为应用广泛的 第三金属。 金属错是反应堆核燃元件的外壳材料,也是耐腐蚀材料。给在反应堆中用做 控制棒。 锆和铪的性质极为相似,分离十分困难,早期采用分步结晶或分步沉淀法, 目前主要应用离子交换和溶剂萃取等方法。例如利用强碱型酚醛树脂 一N(CHCI阴离子交换剂,可达满意的分离效果;在溶剂萃取中,用三辛胺 优先举取皓的硫酸盐配合物受到广泛重视,获得的ZO,含Hf<0.006%,被认为 是目前最佳的方案 2.钒、铌、细 铌、钽均为分散稀有元素,钒重要的矿石除钒钛铁矿外,还有铀钒钾矿 IK(UO:)VO.32H-O ,钒酸铅矿Pbs 我因钒矿储量虽居世界首位 但91%是伴生的,回收率低。铌、钽在矿物中共生,其矿物通式以(F©、Mn)Nb Ta2O6表示,若以铌为主,称为铌铁矿,若以钽为主,称为钽铁矿。 金属钒 呈银白色,有光泽,熔点高,易呈钝态,常温下不与碱及非氧化性的酸作用,但 能溶于氢氯酸、浓硝酸、浓硫酸和王水。钒主要用作锅的添加剂。含钒01 03 的钢材, 目右 弹性好 磨损、抗 污用 制造高递 切削钢、弹簧钢、钢轨等。近年来发现钒的某些化合物具有重要的生理功能, 如胆固醇的生物合成、牙齿和骨骼的矿化、葡萄糖的代谢等等都与钒有相当密切 的关系,这更显出钒化学的重要性。 铌和钒是我国重要的丰产元素。铌是某些硬质钢的组分元素,特别适宜制造 耐高温钢。由于钽的低生理反应性和不被人体排斥,它常用于制作修复严重骨折
12-2 钛族、钒族元素 12-2-1 钛族、钒族元素概述 周期表中 d 区ⅣB 族包括钛(Ti)、锆(Zr)、铪(Hf)、 (Rf)四种元素;ⅤB 族包括钒(V)、铌(Nb)、钽(Ta)、 (Db)四种元素。Rf、Db 为人工合成的放射性 元素。 1. 钛、锆、铪 钛被认为是一种稀有金属,是由于在自然界中存在分散和难于提取。但其相 对丰度在所有元素中居第十位。钛重要的矿石有金红石(TiO2)、钛铁矿(FeTiO3), 以及钒钛铁矿。我国钛资源丰富,攀西地区(四川攀枝花和西昌)的钒钛铁矿就有 几十亿吨,占全国储量 92%以上。世界上已探明的钛储量中,我国约占一半。 锆和铪是稀有金属,主要矿石有锆英石 ZrSiO4,铪常与锆共生。 金属钛呈银白色,有光泽、熔点高、密度小、耐磨、耐低温、无磁性、延展 性好,并且具有优越的抗腐蚀性,尤其是对海水。钛表面形成一层致密的氧化物 保护膜,使之不被酸、碱侵蚀。基于上述优点,钛及其合金广泛地用于制造喷气 发动机、超音速飞机和潜水艇(防雷达、防磁性水雷)以及海军化工设备。此外, 钛与生物体组织相容性好,结合牢固,用于接骨和制造人工关节;钛具有隔热、 高度稳定、质轻、坚固等特性,由纯钛制造的假牙是任何金属材料无法比拟的, 所以钛又被称为“生物金属”。因此,继 Fe、Al 之后,预计 Ti 将成为应用广泛的 第三金属。 金属锆是反应堆核燃元件的外壳材料,也是耐腐蚀材料。铪在反应堆中用做 控制棒。 锆和铪的性质极为相似,分离十分困难,早期采用分步结晶或分步沉淀法, 目前主要应用离子交换和溶剂萃取等方法。例如利用强碱型酚醛树脂 R— N(CH3)3 +Cl-阴离子交换剂,可达满意的分离效果;在溶剂萃取中,用三辛胺 优先萃取锆的硫酸盐配合物受到广泛重视,获得的 ZrO2 含 Hf<0.006%,被认为 是目前最佳的方案。 2. 钒、铌、钽 钒、铌、钽均为分散稀有元素,钒重要的矿石除钒钛铁矿外,还有铀钒钾矿 [K(UO2)VO4·3/2H2O]、钒酸铅矿[Pb5(VO4)3Cl]等。我国钒矿储量虽居世界首位, 但 91%是伴生的,回收率低。铌、钽在矿物中共生,其矿物通式以(Fe、Mn)(Nb、 Ta)2O6 表示,若以铌为主,称为铌铁矿,若以钽为主,称为钽铁矿。 金属钒 呈银白色,有光泽,熔点高,易呈钝态,常温下不与碱及非氧化性的酸作用,但 能溶于氢氟酸、浓硝酸、浓硫酸和王水。钒主要用作钢的添加剂。含钒(0.1%— 0.3 %)的钢材,具有强度大、弹性好、抗磨损、抗冲击等优点,广泛用于制造高速 切削钢、 弹簧钢、钢轨等。近年来发现钒的某些化合物具有重要的生理功能, 如胆固醇的生物合成、牙齿和骨骼的矿化、葡萄糖的代谢等等都与钒有相当密切 的关系,这更显出钒化学的重要性。 铌和钒是我国重要的丰产元素。铌是某些硬质钢的组分元素,特别适宜制造 耐高温钢。由于钽的低生理反应性和不被人体排斥,它常用于制作修复严重骨折

所需的金属板材以及缝合神经的丝和箔等。 铌与钽和锆与铪类似,由于离子半径相近,分离比较困难 122-2钛的重要化合物 钛原子的价层电子构型为3d4s2,最高氧化数为+4,此外还有+3和+2氧化 数,其中+4氧化数的化合物最重要。 1.钛TV的化合物 1二氧化铁Ti0) TiO2在自然 有三种品型: 金红石、锐铁矿和板铁矿。其中最重要的为 金红石,由于含有少量杂质而呈红色或橙色。纯的二氧化钛为白色难熔固体,受 热变黄,冷却又变白。 TO2难溶于水,具有两性(以碱性为主),由T(V)溶液与碱反应所制得的 TO(实际为水合物)可溶于浓酸和浓碱,生成硫酸氧钛和偏钛酸钠: Ti02+5S0.(浓)A→Ti0S04+H0 TiO2+2NaOH(浓) △PNa:TiO:+H0 由于T*电荷多、半径小,极易水解,所以TiV)溶液中不存在Ti艹。TO, 看作是由T二级水解产物脱水而形成的。TO2也可与碱共熔,生成偏钛酸盐 此 Ti0,还可溶于氢氟酸中: TiO2+6HF-[TiF6]+2H+2H2O TO2的化学性质不活泼,且覆盖能力强、折射率高,可用于制造高级白色 油漆。Ti02在工业上称为钛白”,它兼有锌白(ZnO)的持久性和铅白Pb(OH2CO3】 的遮盖性,是高档白色新料,其最大的优占是无蠹,在高级化妆品中用作增白剂 TO2也用作高级铜板纸的表面覆盖剂, 以及用于生产增白尼龙】 在陶瓷中加入 TO2可提高陶瓷的耐酸性。TO2粒子具有半导体性能,且以其无毒、廉价、催 化活性高、稳定性好等特点,成为目前多相光催化反应最常用的半导体材料。此 外,TO2也用作乙醇脱水、脱氢的催化剂。世界钛矿开采量的90%以上是用于 生产钛白的。钛白的制备方法随其用途而异。 工业上生产TO2的方法主要有疏酸法和氯化法。目前我国生产TO2主要用 疏酸法 硫酸法的主要反应如下: FeTiO3+2H2SO4(浓) )FeS0:+T0S0+2H0 (钛铁矿) 冷却所得滤液、除去FSO47阳20后加热至沸腾: TOSO.+2H,HTO+HSO, 将沉淀滤出、烘干,在900~950℃下焙烧: hTi0,量装Ti0,+H0 氯化法的主要操作: 将粉碎后的金红石或高钛渣与焦炭混合,在流化床氯化炉中与氯气反应生成
所需的金属板材以及缝合神经的丝和箔等。 铌与钽和锆与铪类似,由于离子半径相近,分离比较困难。 12-2-2 钛的重要化合物 钛原子的价层电子构型为 3d2 4s2,最高氧化数为+4,此外还有+3 和+2 氧化 数,其中+4 氧化数的化合物最重要。 1.钛( ) Ⅳ 的化合物 (1)二氧化钛(TiO2) TiO2在自然界中有三种晶型:金红石、锐钛矿和板钛矿。其中最重要的为 金红石,由于含有少量杂质而呈红色或橙色。纯的二氧化钛为白色难熔固体,受 热变黄,冷却又变白。 TiO2难溶于水,具有两性(以碱性为主), 由 Ti( ) Ⅳ 溶液与碱反应所制得的 TiO2(实际为水合物)可溶于浓酸和浓碱,生成硫酸氧钛和偏钛酸钠: TiO2 + H2SO4(浓) TiOSO4 + H2O TiO2 + 2NaOH(浓) Na2TiO3 + H2O 由于 Ti4+电荷多、半径小,极易水解,所以 Ti( ) Ⅳ 溶液中不存在 Ti4+。TiO2 可看作是由 Ti4+二级水解产物脱水而形成的。TiO2也可与碱共熔,生成偏钛酸盐。 此外,TiO2还可溶于氢氟酸中: TiO2 + 6HF ─→ [TiF6] 2- + 2H+ + 2H2O TiO2的化学性质不活泼,且覆盖能力强、折射率高,可用于制造高级白色 油漆。TiO2在工业上称为“钛白”,它兼有锌白(ZnO)的持久性和铅白[Pb(OH)2CO3] 的遮盖性,是高档白色颜料,其最大的优点是无毒,在高级化妆品中用作增白剂。 TiO2也用作高级铜板纸的表面覆盖剂,以及用于生产增白尼龙。在陶瓷中加入 TiO2可提高陶瓷的耐酸性。TiO2粒子具有半导体性能,且以其无毒、廉价、催 化活性高、稳定性好等特点,成为目前多相光催化反应最常用的半导体材料。此 外,TiO2也用作乙醇脱水、脱氢的催化剂。世界钛矿开采量的 90%以上是用于 生产钛白的。钛白的制备方法随其用途而异。 工业上生产 TiO2的方法主要有硫酸法和氯化法。目前我国生产 TiO2主要用 硫酸法。 硫酸法的主要反应如下: FeTiO3 + 2H2SO4(浓) FeSO4 + TiOSO4 + 2H2O (钛铁矿) 冷却所得滤液、除去 FeSO4·7H2O 后加热至沸腾: TiOSO4 + 2H2O H2TiO3↓+ H2SO4 将沉淀滤出、烘干,在 900~950℃下焙烧: H2TiO3 TiO2 + H2O 氯化法的主要操作: 将粉碎后的金红石或高钛渣与焦炭混合,在流化床氯化炉中与氯气反应生成

四氯化钛,经净化,于 1000C左右通氧气使TiCL转化为TiO2: 2TiO:+3C+4Clz -A2TiClt+2COT+CO21 盖Ti02+2Cl1 通常,光催化剂TO2是通过液相法或气相法来制备的。液相法是将钛的卤 化物或钛醇盐经水解生成氢氧化钛(或羟基氧钛),再经煅烧得到T02 TiOR4或TiP→TiOH,或TiO(OH- 线→Ti02 (2)钛酸盐和钛氧盐 TO,为两性偏碱性氧化物,可形成两系列盐一钛酸盐和钛氧盐,钛酸盐大 都难溶于水。 要的 压电陶瓷材料( 电子信息技术和光电技术领域。 BaTiO,主要通过“混合一预烧一球磨流程大规模生产: BaCO3 TiO2BaTiO3 CO2t 苦婴制各高度粉体或薄爽材相一脱界用蓬胶一胶法如制备B9O中 用Ba(OAc[或BaNO,h和 乙 溶剂。先制成溶胶 贮,经加入(或吸收)适量水,发生水解一聚合反应变成凝胶,在经热处理可制得 所斋样品。 硫酸氧TOSO)为白色粉末,可溶于冷水。在溶液或晶体内实际上不存在 简单的钛酰离子T02,而是以Ti02聚合形成的锯齿状长链TiO)a”形式存在: 在晶体中这些长链彼此之间由$O,“连接起来 TO2为两性氧化物,酸、碱性都很弱,对应的钛酸盐和钛氧盐皆易水解,形 成白色偏钛酸(HTO)沉淀: Na TiO:+2H2O-H2TiOal+2NaOH TiOSO+2H2O-A>H2TiO:+HSO (3)四氯化钛 四氯化钛(TiC14)是钛最重要的卤化物,通常由TO2、氯气和焦碳在高温下反 应制 TC14为共价化合柳正四面体构型),其熔点和沸点分别为-23.2℃和136.4℃ 常温下为无色液体,易挥发,具有刺激气味,易溶于有机溶剂。TC4极易水解, 在潮湿空气中由于水解而冒烟: TiCl4+3Hz0-→HTiO3+4HCI↑ 利用此反应可以制造烟幕。 TC14是制备钛的其它化合物的原料。利用氨等离子体,由TiCl,可获得仿 金镀层TiN: 2TiC4+N2子述→2TiN+4C2
四氯化钛,经净化,于 1000℃左右通氧气使 TiCl4 转化为 TiO2: 2TiO2 + 3C + 4Cl2 2TiCl4↑+ 2CO↑+ CO2↑ TiCl4 + O2 TiO2 + 2Cl2↑ 通常,光催化剂 TiO2是通过液相法或气相法来制备的。液相法是将钛的卤 化物或钛醇盐经水解生成氢氧化钛(或羟基氧钛),再经煅烧得到 TiO2: Ti(OR)4或 TiX4 Ti(OH)4或 TiO(OH)2 TiO2 (2) 钛酸盐和钛氧盐 TiO2为两性偏碱性氧化物,可形成两系列盐──钛酸盐和钛氧盐,钛酸盐大 都难溶于水。BaTiO3(白色)、PbTiO3(淡黄)介电常数高,具有压电效应,是最重 要的压电陶瓷材料(是一种可以使电能和机械能相互转换的功能材料),广泛用于 电子信息技术和光电技术领域。 BaTiO3主要通过“混合— 预烧— 球磨”流程大规模生产: BaCO3 + TiO2 ─→ BaTiO3 + CO2↑ 若要制备高纯度粉体或薄膜材料,一般采用溶胶— 凝胶法,如制备 BaTiO3,选 用 Ba(OAc)2[或 Ba(NO3)2]和 Ti(OC4H9)4, 乙醇作溶剂。先制成溶胶,在空气中存 贮,经加入(或吸收)适量水,发生水解— 聚合反应变成凝胶,在经热处理可制得 所需样品。 硫酸氧钛(TiOSO4)为白色粉末,可溶于冷水。在溶液或晶体内实际上不存在 简单的钛酰离子 TiO2+,而是以 TiO2+聚合形成的锯齿状长链(TiO) 形式存在: 在晶体中这些长链彼此之间由 SO4 2-连接起来。 TiO2为两性氧化物,酸、碱性都很弱, 对应的钛酸盐和钛氧盐皆易水解,形 成白色偏钛酸(H2TiO3)沉淀: Na2TiO3 + 2H2O ─→ H2TiO3↓+ 2NaOH TiOSO4 + 2H2O H2TiO3↓+ H2SO4 (3) 四氯化钛 四氯化钛(TiCl4)是钛最重要的卤化物,通常由 TiO2、氯气和焦碳在高温下反 应制得。 TiCl4为共价化合物(正四面体构型),其熔点和沸点分别为-23.2℃和 136.4 , ℃ 常温下为无色液体,易挥发,具有刺激气味,易溶于有机溶剂。TiCl4极易水解, 在潮湿空气中由于水解而冒烟: TiCl4 + 3H2O ─→ H2TiO3↓+ 4HCl↑ 利用此反应可以制造烟幕。 TiCl4 是制备钛的其它化合物的原料。利用氮等离子体,由 TiCl4可获得仿 金镀层 TiN: 2TiCl4 + N2 2TiN + 4Cl2

2.钛(Π)的化合物 钛的氧化数为+3的化合物中,较重要的是紫色的三氯化钛(TC)。在 500-800℃用氢气还原干燥的气态TiC14,可得TiCs粉末: 2TiCl+H2 A→2TiC3+2HCI 在酸性溶液中,钛的电势图为: WTi02*01T*037T*-163Ti 无色) (紫色) (深褐色) 可见T*有较强的还原性。TiC1与TiCL4一样,均可作为某些有机合成反应 的催化剂。 在TiV)盐的酸性溶液中加入HO2则生成较稳定的橙色配合物TiOH,O)2: Ti02*+H0。a→mi0H02 可利用此反应测定钛。 *1223钒、铌、钽的重要化合物 钒原子的价层电子构型为3d4s2,可形成+5,+3,+2等氧化数的化合物,其 中以氧化数为+5的化合物较重要。钒的某些化合物具有催化作用和生理功能。 1五氧化二钒 五氧化二钒(V205)为橙黄至砖红色固体,无味、有毒(钒的化合物均有毒), 微溶于水,其水溶液呈淡黄色并显酸性。目前工业上是以含钒铁刊矿熔炼钢时所获 得的富钒炉渣(含Fc0-V2O,)为原料制取V2O5: 先与纯碱反应: 4Fc0V,03+4Na2C03+502△→8NaV0,+2Fe,03+4C02t 然后用水从烧结块中浸出NaVO,用酸中和至pH=5~6时加入硫酸铵,调节 pH=2一3,可析出六聚钒酸铵,再设法转化为V2O5。 V2O5为两性氧化物(以酸性为主),溶于强碱(如NaOH溶液中: V,05+60H速)2v0,+3H,0 (正钒酸根,无色) V,05+20r2v05+H,0 (偏钒酸根,黄色) VO也可溶于强酸(如SO),但得不到V,而是形成淡黄色的VO2 V0s+2H→2V02+H20 (淡黄) VO:为中强氧化剂,如与盐酸反应,VV)可被还原为VW),并放出氯气: V205+6+2CI- 2V02++C2t+3H0 VO在硫酸工业中作催化剂:石油化工中用作设备的缓蚀剂, 2.钒酸盐 钒酸盐的形式多种多样。在一定条件下,向钒酸盐溶液中加酸,随着pH值 的逐渐减小,钒酸根会逐渐脱水 VO 240,0,-9
2. 钛(Ⅲ)的化合物 钛的氧化数为+3 的化合物中,较重要的是紫色的三氯化钛(TiCl3)。在 500-800℃用氢气还原干燥的气态 TiCl4, 可得 TiCl3 粉末: 2TiCl4 + H2 2TiCl3 + 2HCl 在酸性溶液中,钛的电势图为: TiO2+ -0.1 Ti3+ -0.37 Ti2+ -1.63 Ti (无色) (紫色) (深褐色) 可见 Ti3+有较强的还原性。TiCl3与 TiCl4一样,均可作为某些有机合成反应 的催化剂。 在 Ti(Ⅳ)盐的酸性溶液中加入 H2O2则生成较稳定的橙色配合物[TiO(H2O2)]2+: TiO2+ + H2O2 [TiO(H2O2)]2+ 可利用此反应测定钛。 *12-2-3 钒、铌、钽的重要化合物 钒原子的价层电子构型为 3d3 4s2 , 可形成+5,+3,+2 等氧化数的化合物,其 中以氧化数为+5 的化合物较重要。钒的某些化合物具有催化作用和生理功能。 1. 五氧化二钒 五氧化二钒(V2O5)为橙黄至砖红色固体,无味、有毒(钒的化合物均有毒), 微溶于水,其水溶液呈淡黄色并显酸性。目前工业上是以含钒铁矿熔炼钢时所获 得的富钒炉渣(含 FeO·V2O3)为原料制取 V2O5: 先与纯碱反应: 4FeO·V2O3 + 4Na2CO3 + 5O2 8NaVO3 + 2Fe2O3 + 4CO2↑ 然后用水从烧结块中浸出 NaVO3,用酸中和至 pH=5~6 时加入硫酸铵,调节 pH=2~3,可析出六聚钒酸铵,再设法转化为 V2O5。 V2O5为两性氧化物(以酸性为主),溶于强碱(如 NaOH)溶液中: V2O5 + 6 OH - 2VO4 3- + 3H2O (正钒酸根,无色) V2O5 + 2OH- 2VO3 - + H2O (偏钒酸根,黄色) V2O5 也可溶于强酸(如 H2SO4), 但得不到 V 5+ , 而是形成淡黄色的 VO2 + : V2O5 + 2H+ ─→ 2VO2 + + H2O (淡黄) V2O5为中强氧化剂,如与盐酸反应,V( ) Ⅴ 可被还原为 V( ) Ⅳ ,并放出氯气: V2O5 + 6H+ + 2Cl- ─→ 2VO 2+ + Cl2↑+ 3H2O (蓝) V2O5在硫酸工业中作催化剂;石油化工中用作设备的缓蚀剂。 2. 钒酸盐 钒酸盐的形式多种多样。在一定条件下,向钒酸盐溶液中加酸,随着 pH 值 的逐渐减小,钒酸根会逐渐脱水 VO4 3- V2O7 4-
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第三章 酸碱反应和沉淀反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第二章 化学反应的方向、速率和限度.pdf
- 《基础化学》课程授课教案(无机化学讲义)第一章 化学反应中的质量关系和能量关系.pdf
- 内蒙古科技大学:《基础化学》课程教学大纲 Basic Chemistry(负责人:李国祥).pdf
- 《物理化学》课程教学资源(名词术语)物理化学专业术语中英文对照表.pdf
- 《物理化学》课程教学资源(习题解答)第1章 气体.doc
- 《物理化学》课程教学资源(习题解答)第2章 热力学第一定律.doc
- 《物理化学》课程教学资源(习题解答)第3章 热力学第二定律.doc
- 《物理化学》课程教学资源(习题解答)第4章 多组分系统热力学及其在溶液中的应用.doc
- 《物理化学》课程教学资源(习题解答)第5章 相平衡.doc
- 《物理化学》课程教学资源(习题解答)第6章 化学平衡.doc
- 《物理化学》课程各章习题(含参考答案)第八章.pdf
- 《物理化学》课程各章习题(含参考答案)第九章 可逆电池的电动势及其应用.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
