《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃

第五章脂环烃 学习要求 1.了解脂环烃的分类和命名: 2.掌握脂环烃的性质: 3.理解脂环烃的结构及其稳定性的解释: 4.理解脂环烃的典型构象及其稳定性的解释 5.了解脂环烃的制备。 §5-1脂环烃的分类命名和异构现象 一、分 饱和脂环经,环烷经如:(口了口) 不饱和脂环烃环烯烃如:(O○了) 环炔烃 了环的大小:小环(3~4元):普通环(5~7元):中环(8 12元)和大环(十二碳以上)。 2。环的多少:单环:多环(桥环,螺环) 二、命名 1.环烷烃的命名 (1)根据分之中成环碳原子数目,称为环某烷。 (2)把取代基的名称写在环烷烃的前面。 (3)取代基位次按“最低系列”原则列出,基团顺序按“次序规则” 小的优先列出。 例如: CH3 ○JCH-CH 1,3=甲基环戊烷 异丙基环己炕 41
·41· 第五章 脂 环 烃 学习要求 1.了解脂环烃的分类和命名; 2.掌握脂环烃的性质; 3.理解脂环烃的结构及其稳定性的解释; 4.理解脂环烃的典型构象及其稳定性的解释; 5.了解脂环烃的制备。 1. § 5-1 脂环烃的分类命名和异构现象 一、分类 饱和脂环烃, 环烷烃 如:( ) 1. 不饱和脂环烃 环烯烃 如:( ) 环炔烃 环的大小: 小环(3~4元);普通环(5~7元);中环((8~ 12元)和大环(十二碳以上)。 2. 环的多少: 单环; 多环(桥环, 螺环) 二、命名 1.环烷烃的命名 (1) 根据分之中成环碳原子数目,称为环某烷。 (2) 把取代基的名称写在环烷烃的前面。 (3) 取代基位次按“最低系列”原则列出,基团顺序按“次序规则” 小的优先列出。 例如: CH3 CH3 CH CH3 CH3 CH3 1,3-=甲基环戊烷 异丙基环己烷 1-甲基-3-异丙基 环己烷 1,4-=甲基-4-乙基 环己烷

2.环烯烃的命名 (1)称为环某烯。 (2)以双键的位次和取代基的位置最小为原则 例如: CH 可 环戊烯 1甲基环成烯 3.多环烃的命名 (1)桥环烃(二环、三环等) 分之中含有两个或多个碳环的多 环化合物中,其中两个环共用两个或 多个碳原子的化合物称为桥环化合 物。 编号原则:从桥的一端开始,沿 最长桥编致桥的另一端,再沿次长桥 致始桥头,最短的桥最后编号。 命名:根据成环碳原子总数目称 为环某烷,在环字后面的方括号中标出除桥头碳原子外的桥碳原子数(大的数 目排前,小的排后),(如左图)。其它同环烷烃的命名。 例如:上化合物名为7,7-二甲基二环[2,2,1]庚烷 4 2 CH2CH3 11 2-甲基-5异丙基二环3,1,已烷 2-乙基-6-氯二环3,2,1辛烷 42
·42· 2.环烯烃的命名 (1)称为环某烯。 (2)以双键的位次和取代基的位置最小为原则。 例如: 3. 多环烃的命名 (1) 桥环烃(二环、三环等) 分之中含有两个或多个碳环的多 环化合物中,其中两个环共用两个或 多个碳原子的化合物称为桥环化合 物。 编号原则:从桥的一端开始,沿 最长桥编致桥的另一端,再沿次长桥 致始桥头,最短的桥最后编号。 命名:根据成环碳原子总数目称 为环某烷,在环字后面的方括号中标出除桥头碳原子外的桥碳原子数(大的数 目排前,小的排后),(如左图)。其它同环烷烃的命名。 例如: 上化合物名为 7,7-二甲基二环[2,2,1]庚烷 CH3 CH3 CH3 环戊烯 1-甲基环戊烯 3,4-=甲基 环己烯 1,3-环戊烯 2-甲基-1,3- 环己二烯 1 2 3 4 5 6 7 桥头碳 CH2CH3 Cl 2-甲基-5-异丙基二环[3,1,0]己烷 2-乙基-6-氯二环[3,2,1]辛烷 1 2 3 4 5 6 7 8 1 2 3 5 4 6
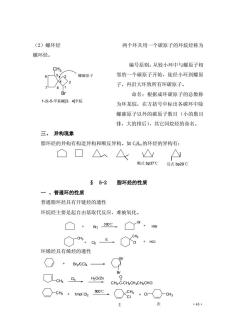
(2)螺环烃 两个环共用一个碳原子的环烷烃称为 螺环烃。 编号原则:从较小环中与螺原子相 CH3 「螺碳原子 邻的一个碳原子开始,徒经小环到螺原 子,再沿大环致所有环碳原子。 命名:根据成环碳原子的总数称 1-澳-5甲基蝶3,4辛烷 为环某烷,在方括号中标出各碳环中除 螺碳原子以外的碳原子数目(小的数目 排,大的排后),其它同烷烃的命名。 三、异构现象 脂环烃的异构有构造异构和顺反异构。如C,H。的环烃的异构有: □口△△△ 顺式bp37℃反式bp29℃ §5-2脂环烃的性质 一、普通环的性质 普通脂环烃具有开链烃的通性 环烷烃主要是起自由基取代反应,难被氧化。 ◇,ttX8,阳 环烯烃具有烯烃的通性 ○+B,cc4 G Br CH 0s torzn CHs-C-CHCHCH2CHO ○cw+1 a,.8+a○ 主 次 43
·43· (2)螺环烃 两个环共用一个碳原子的环烷烃称为 螺环烃。 编号原则:从较小环中与螺原子相 邻的一个碳原子开始,徒经小环到螺原 子,再沿大环致所有环碳原子。 命名:根据成环碳原子的总数称 为环某烷,在方括号中标出各碳环中除 螺碳原子以外的碳原子数目(小的数目 排,大的排后),其它同烷烃的命名。 三、 异构现象 脂环烃的异构有构造异构和顺反异构。如 C5H10的环烃的异构有: § 5-2 脂环烃的性质 一 、普通环的性质 普通脂环烃具有开链烃的通性 环烷烃主要是起自由基取代反应,难被氧化。 环烯烃具有烯烃的通性 Br CH3 螺碳原子 1 2 3 4 5 6 7 8 1-溴-5-甲基螺[3,4]辛烷 CH3 Br2 Cl2 300℃ 光 Br Cl CH3 HBr HCl 顺式 bp37℃ 反式 bp29℃ CH3 CH3 Br2 /CCl4 Br Br O3 H2O/Zn CH3 -C-CH2CH2CH2CHO O 1mol Cl2 500℃ CH3 Cl Cl CH3 主 次
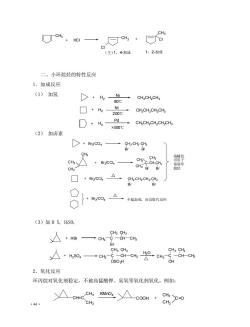
(主)1,4加成1,2-加成 二、小环烷烃的特性反应 1.加成反应 (1)加氢 CHgCH2CHg 80℃ ☐+Hh2000 Ni CHgCH2CH2CHs Pd +H2>300c CHCH2CH2CH-CHg (2)加卤素 CHzCHz-CH2 BrBr H CH3 cy+Bc,一 CHa ☐+wcC△ g4cworg O1 八】+e©©:公不起加成,而起收代反把 (3)加HX,HS0, CHs CHs →CHC-OH-CH Br CHs CH3 CH3 CHa +so一c46-cH-cHRc -CH-CHs 0s0州 2.氧化反应 环丙烷对氧化剂稳定,不被高猛酸钾、臭氧等氧化剂氧化。例如: .△coH+ 44 CH3
·44· 二、小环烷烃的特性反应 1.加成反应 (1) 加氢 (2) 加卤素 (3)加 H X, H2SO4 2.氧化反应 环丙烷对氧化剂稳定,不被高猛酸钾、臭氧等氧化剂氧化。例如: H2 Ni 80℃ CH3CH2CH3 H2 Ni 200℃ CH3CH2CH2CH3 H2 Pd >300℃ CH3CH2CH2CH2CH3 Br2 /CCl4 CH2 -CH2 -CH2 Br Br CH3 CH3 CH3 Br2 /CCl4 C-CH-CH2 Br CH3 Br CH3 CH3 Br2 /CCl4 CH2 -CH2 -CH2 -CH2 Br Br Br2 /CCl4 溴褪色 可用于 鉴别环 烷烃 不起加成,而是取代反应 HBr H2SO4 C CH CH3 CH3 CH3 Br CH3 C CH CH3 CH3 CH3 OSO3H CH3 H2O C CH CH3 CH3 CH3 OH CH3 CH=C CH3 CH3 KMnO4 COOH CH3 CH3 C=O CH3 HCl CH3 Cl CH3 Cl (主)1,4-加成 1,2-加成

故可用高猛酸钾溶液来区别烯烃与环丙烷衍生物。 环烃性质小结: (1) 小环烷烃(3,4元环)易加成,难氧化,似烷似烯。 普通环以上难加成,难氧化,似烷。 (2) 环烯烃、共轭二烯烃,各自具有其相应烯烃的通性。 §5-3胎环烃的结构 从环烷烃的化学性质可以看出,环丙烷最不稳定,环丁烷次之,环戊烷 比较稳定,环己烷以上的大环都稳定,这反映了环的稳定性与环的结构有着密 切的联系。 一、环丙烷的结构与张力学说 一、张力学说 l.Baeyer的张力学说 1=n2江(n为正多边形的边数) Baeyer根据正四面体的模型并假设C原子在成环后都在同一平面。 环丙烷60°,环丁烷90°,环戊烷108°,环已烷120°。 2.角张力 这些与正常的四面体角的偏差,引起分子的张力,称为角张力。 角张力越大越不稳定,各环烷烃每个C-C键向内压缩或向外扩张的偏差 度数可算如下:环丙烷(109.5°-60°)/2=+24.8 环丁烷(109.5°-90°)/2=+9.8 环戊烷(109.5°-108°)/2=+0.8° 环已烷为-5.3°,环庚烷-9.5°,环癸烷-17.3 90 108 角偏差492819281·28 1032 45
·45· 故可用高猛酸钾溶液来区别烯烃与环丙烷衍生物。 环烃性质小结: (1) 小环烷烃(3,4 元环)易加成,难氧化,似烷似烯。 普通环以上难加成,难氧化,似烷。 (2) 环烯烃、共轭二烯烃,各自具有其相应烯烃的通性。 § 5-3 脂环烃的结构 从环烷烃的化学性质可以看出,环丙烷最不稳定,环丁烷次之,环戊烷 比较稳定,环己烷以上的大环都稳定,这反映了环的稳定性与环的结构有着密 切的联系。 一、 环丙烷的结构与张力学说 一、张力学说 1.Baeyer 的张力学说 Baeyer 根据正四面体的模型并假设 C 原子在成环后都在同一平面。 环丙烷 60°,环丁烷 90°,环戊烷 108°,环已烷 120°。 2.角张力 这些与正常的四面体角的偏差,引起分子的张力,称为角张力。 角张力越大越不稳定,各环烷烃每个 C-C 键向内压缩或向外扩张的偏差 度数可算如下:环丙烷(109.5°-60°)/2 = + 24.8° 环丁烷(109.5°-90°)/2 = + 9.8° 环戊烷(109.5°-108°)/2 = + 0.8° 环已烷为-5.3°,环庚烷-9.5°,环癸烷-17.3°。 α π n = (n -2) (n 为正多边形的边数) 60 。 90 。 108 。 120 。 角偏差 49。28' 19。28' 1。28' 10。32

3.环的稳定性:环戊烷>环丁烷>环丙烷 4.Baeyer张力学说中的错误 ①假设不符合实际(假设环是平面的,实际环是非平面)。 ②历史的局限。 二、近代结构理论的概念 1.现代共价键的概念成环C以sp3杂化。 2.弯曲键 根据量子力学计算,环丙烷分子中: 碳环的键角为105.5°:HCH键角为114 HCYCH2 在环丙烷分子中碳原子究竞是以怎样的杂化方式成键的呢?有的认为碳 原子在饱和烃中都是成s3杂化轨道的,在环丙烷中只是重叠较少,所以成弯 键。杂化的概念原是为了形成有利于成键的价电子轨道而设想出来的。环丙烷 碳虽有四个价键,但键角已发生了显著变化,似己不能再是s3杂化的了。然 而,即使从根据键角的实际值求杂化轨道的观点看,无论s和p的哪种杂化轨 道,键角都在90°以上。因此,不存在那种以环的键角60°作为键的共轴的s 和·杂化轨道。所以,在这种情况下,杂化论者也不得不假定为弯键。不论哪 一种说法,由于形成了弯键,首先表明环丙烷中C-C键的p电子成分高,键的 能量高。而且由于重叠程度较少,使电子云分布在连接两个碳原子的直线的外 侧,提供了被亲电试剂进攻的位置,从而具有一定的烯烃性质,也是容易理解 的了。 环丙烷为张力环,采取重叠式构象,所以容易破环。此外,环丙烷C一C 键为弯曲键,有点类似于烯烃的p键,可以发生类似于烯烃的加成反应。 因为三碳环具有一定的π键性质,在环丙烯分子中,以双键结合的两个 ·46
·46· 3.环的稳定性:环戊烷> 环丁烷 >环丙烷 4.Baeyer 张力学说中的错误 ① 假设不符合实际(假设环是平面的,实际环是非平面)。 ② 历史的局限。 二、 近代结构理论的概念 1.现代共价键的概念 成环 C 以 sp3 杂化。 2.弯曲键 根据量子力学计算,环丙烷分子中: 碳环的键角为 105.5°;HCH 键角为 114° 在环丙烷分子中碳原子究竟是以怎样的杂化方式成键的呢?有的认为碳 原子在饱和烃中都是成 sp3 杂化轨道的,在环丙烷中只是重叠较少,所以成弯 键。杂化的概念原是为了形成有利于成键的价电子轨道而设想出来的。环丙烷 碳虽有四个价键,但键角已发生了显著变化,似已不能再是 sp3 杂化的了。然 而,即使从根据键角的实际值求杂化轨道的观点看,无论 s 和 p 的哪种杂化轨 道,键角都在 90°以上。因此,不存在那种以环的键角 60°作为键的共轴的 s 和 p 杂化轨道。所以,在这种情况下,杂化论者也不得不假定为弯键。不论哪 一种说法,由于形成了弯键,首先表明环丙烷中 C-C 键的 p 电子成分高,键的 能量高。而且由于重叠程度较少,使电子云分布在连接两个碳原子的直线的外 侧,提供了被亲电试剂进攻的位置,从而具有一定的烯烃性质,也是容易理解 的了。 环丙烷为张力环,采取重叠式构象,所以容易破环。此外,环丙烷 C-C 键为弯曲键,有点类似于烯烃的 p键,可以发生类似于烯烃的加成反应。 因为三碳环具有一定的π键性质,在环丙烯分子中,以双键结合的两个 H2 C H2C CH2 C H2C CH2 H 114° H 105.5°

碳原子,犹如有了两个π键,它的C-H键相似了。根据计算,这两个碳原子的 0键中S电子占44%(乙炔50%)。 二、环丁烷和环戊烷的构象 1.环丁烷的构象 与环丙烷相似,环丁烷分子中存在着张力,但比环丙烷的小,因在环丁 烷分子中四个碳原子不在同一平面上,见右图: 根据结晶学和光谱学的证明,环丁烷是以 折叠壮构象存在的,这种非平面型结构可以减 少C-H的重叠,使扭转张力减小。环丁烷分子 中C-C-C键角为111.5°,角张力也比环丙烷 的小,所以环丁烷比环丙烷要稳定些。总张力能 环丁烷的构象 为108KJ/mo1。 ①C-C键也是弯曲的。键角115° ②构象:四个C原子不在同一平面。(蝴蝶式) 2.环戊烷的构象 环戊烷分子中,C-C-C夹角为108°,接近s3杂化轨道间夹角109.5°, 环张力甚微,是比较稳定的环。但若环为平面结构,则其C-H键都相互重叠, 会有较大的扭转张力,所以,环戊烷是以折叠式构象存在的,为非平面结 构,见右图,其中有四个碳原子在同一平面,另 外一个碳原子在这个平面之外,成信封式构象。 这种构象的张力很小,总张力能25KJ/mo1, 扭转张力在2.5KJ/mo1以下,因此,环戊烷的化 环戊烷的构象 学性质稳定。 .47
·47· 碳原子,犹如有了两个π键,它的 C-H 键相似了。根据计算,这两个碳原子的 σ键中 S 电子占 44%(乙炔 50%)。 二、 环丁烷和环戊烷的构象 1.环丁烷的构象 与环丙烷相似,环丁烷分子中存在着张力,但比环丙烷的小,因在环丁 烷分子中四个碳原子不在同一平面上,见右图: 根据结晶学和光谱学的证明,环丁烷是以 折叠壮构象存在的,这种非平面型结构可以减 少 C-H 的重叠,使扭转张力减小。环丁烷分子 中 C-C-C 键角为 111.5°,角张力也比环丙烷 的小,所以环丁烷比环丙烷要稳定些。总张力能 环丁烷的构象 为 108KJ/mol。 ① C-C 键也是弯曲的。键角 115°. ② 构象:四个 C 原子不在同一平面。(蝴蝶式) 平面式 蝴蝶式 2.环戊烷的构象 环戊烷分子中,C-C-C 夹角为 108°,接近 sp3 杂化轨道间夹角 109.5°, 环张力甚微,是比较稳定的环。但若环为平面结构,则其 C-H 键都相互重叠, 会有较大的扭转张力,所以,环戊烷是以折叠式构象存在的,为非平面结 构,见右图,其中有四个碳原子在同一平面,另 外一个碳原子在这个平面之外,成信封式构象。 这种构象的张力很小,总张力能 25KJ/mol, 扭转张力在 2.5KJ/mol 以下,因此,环戊烷的化 环戊烷的构象 学性质稳定。 H H H H H H H 0.05nm
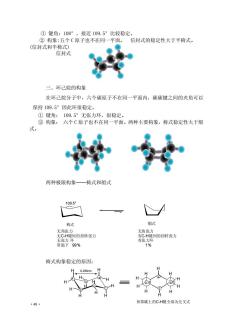
①键角:108°,接近109.5°比较稳定。 ②构象:五个C原子也不在同一平面。 信封式的稳定性大于半椅式。 (信封式和半椅式) 信封式 三、环己烷的构象 在环己烷分子中,六个碳原子不在同一平面内,碳碳键之间的夹角可以 保持109.5°因此环很稳定。 ①键角:109.5°无张力环,很稳定。 ②构象:六个C原子也不在同一平面。两种主要构象,椅式稳定性大于船 式。 两种极限构象一一椅式和船式 109.5° 格式 船式 椅式构象稳定的原因: 020nm 相邻碳上的CH健全部为交叉式
·48· ① 键角:108°,接近 109.5°比较稳定。 ② 构象:五个 C 原子也不在同一平面。 信封式的稳定性大于半椅式。 (信封式和半椅式) 信封式 三、环己烷的构象 在环己烷分子中,六个碳原子不在同一平面内,碳碳键之间的夹角可以 保持 109.5°因此环很稳定。 ① 键角: 109.5°无张力环,很稳定。 ② 构象: 六个 C 原子也不在同一平面。两种主要构象,椅式稳定性大于船 式。 两种极限构象——椅式和船式 椅式构象稳定的原因: H H H H H H H H H H H H H H H H H H H H H H 0.250nm 2 3 4 5 6 1 1 2 3 4 5 6 相邻碳上的C-H键全部为交叉式 椅式 船式 无角张力 无C-H键间的扭转张力 无张力 环 常温下 99% 无角张力 有C-H键间的扭转张力 有张力环 1% 109.5°

船式构象不稳定的原因: H 相邻碳上的CH全部为重叠式 2.平伏键(e键)与直立键(a键) 在椅式构象中C-H键分为两类。第一类六个C-H键与分子的对称轴平行, 叫做直立键或a键(其中三个向环平面上方伸展,另外三个相换环平面下方伸 展):第二类六个C-H键与直立键形成接近109.5°的夹角,平伏着相环外伸展, 叫做平伏键或e键。如下图 一直立园 一平伏健 在室温时,环己烷的椅式构象可通过 C-C键的转动(而不经过碳碳键的断裂),环已烷的直立键和平伏健 由一种椅式构象变为另一种椅式构象,在 互相转变中,原来的a键变成了e键,而 原来的e键变成了a键。 对称轴 一a键 对称轴 0 0y@ 。e健 一e键 当六个碳原子上连爵莞调韩象是同一构象·连有不同基团 时,则构象不同。 3.取代环己烷的构象 1)一元取代环己烷的构象 .49
·49· 船式构象不稳定的原因: 2.平伏键(e 键)与直立键(a 键) 在椅式构象中 C-H 键分为两类。第一类六个 C-H 键与分子的对称轴平行, 叫做直立键或 a 键(其中三个向环平面上方伸展,另外三个相换环平面下方伸 展);第二类六个 C-H 键与直立键形成接近 109.5°的夹角,平伏着相环外伸展, 叫做平伏键或 e 键。如下图: 在室温时,环己烷的椅式构象可通过 C-C 键的转动(而不经过碳碳键的断裂), 由一种椅式构象变为另一种椅式构象,在 互相转变中,原来的 a 键变成了 e 键,而 原来的 e 键变成了 a 键。 当六个碳原子上连的都是氢时,两种构象是同一构象。连有不同基团 时,则构象不同。 3.取代环己烷的构象 1)一元取代环己烷的构象 H H H H H H H H H H H H H H H H H H H H H H 3 2 4 5 6 1 1 2 3 4 5 6 0.183nm 相邻碳上的C-H全部为重叠式 H H H H H H H H H H H H 环己烷的直立键和平伏键 平伏键 直立键 对称轴 H H H H H H 对称轴 H H H H H H H H H H H H H H H H H H a e a 对称轴 e 键 键 键 键 两个椅式构象的互相转变
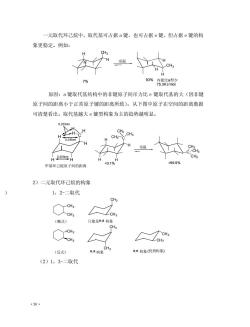
一元取代环己烷中,取代基可占据a键,也可占据e键,但占据e键的构 象更稳定。例如: CH3 室温 H H 7% 93%穷 原因:a键取代基结构中的非键原子间斥力比e键取代基的大(因非键 原子间的距离小于正常原子键的距离所致)。从下图中原子在空间的距离数据 可清楚看出。取代基越大e键型构象为主的趋势越明显。 4025m 甲基环己烷原子间的距离 2)二元取代环己烷的构象 1,2-二取代 CH CH (顺式) 只能是e,a构象 CH (反式) a,a构象 ee构象(优势构象) (2)1,3-二取代 ·50
·50· 一元取代环己烷中,取代基可占据 a 键,也可占据 e 键,但占据 e 键的构 象更稳定。例如: 原因:a 键取代基结构中的非键原子间斥力比 e 键取代基的大(因非键 原子间的距离小于正常原子键的距离所致)。从下图中原子在空间的距离数据 可清楚看出。取代基越大 e 键型构象为主的趋势越明显。 2)二元取代环己烷的构象 ) 1,2-二取代 1 (2)1,3-二取代 H H H CH3 H H CH3 H 室温 93% 内能比a型少 75.3KJ/mol 7% H H C H H H 0.255nm 0.233nm H H 0.255nm 甲基环己烷原子间的距离 H C H CH3 H H CH3 CH3 C CH3 CH3 室温 CH3 99.9% CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 (顺式) (反式) 只能是 构象 构象 (优势构象) e,a a,a e,e 构象 CH3 CH3
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十章 醇、酚、醚.pdf
- 《基础化学》课程授课教案(物理化学讲义)第一章 第零定律与物态方程.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十三章 羧酸衍生物.pdf
- 《基础化学》课程授课教案(物理化学讲义)第二章 热力学第一定律.pdf
- 《基础化学》课程授课教案(物理化学讲义)第五章 化学平衡.pdf
- 《基础化学》课程授课教案(物理化学讲义)第四章 溶液(Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第三章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第二部分 电解与极化作用(electrolysis and polarization).pdf
- 《基础化学》课程授课教案(物理化学讲义)第六章 相平衡(Phase equilibrium).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第三部分 第三部分 可逆电池(Reversible Cell).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第一部分 电解质溶液(Electrolytic Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第九章 化学动力学.pdf
- 《基础化学》课程授课教案(物理化学讲义)第十章 胶体.pdf
- 内蒙古科技大学:《基础化学》课程教学实验指导(有机化学、无机化学、分析化学、物理化学).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(试题).pdf
