《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素
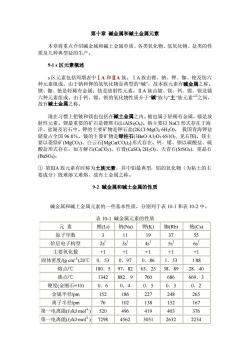
第十章碱金属和碱土金属元素 本章将重点介绍碱金属和碱土金属单质、各类氧化物、氢氧化物、盐类的性 质及几种典型盐的生产。 91s区元素概述 s区元素包括周期表中IA和ⅡA族。IA族由锂、钠、钾、铷、铯及纺六 种元素组成。由于钠和钾的氢氧化物是典型的碱”,故本族元素有碱金属之称。 锂、铷、铯是轻稀有金属:钫是放射性元素。ⅡA族由铍、镁、钙、锶、钡及铺 由于钙、锶、钡的氧化物性质介于“碱族与“士族元素之间, 故有碱土金属之 现在习惯上把皱和镁也包括在碱土金属之内。皱也属于轻稀有金属,镭是放 射性元素。锂最重要的矿石是锂辉石(LiAlSi2O6)。钠主要以NaCI形式存在于海 洋、盐湖及岩石中。钾的主要矿物是钾石盐(2 KCI-MgCh6H2O),我国青海钾盐 储量占全国96.8%。铍的主要矿物是绿柱石(3B0A12036S1O2, 见右图。样主: 要以菱镁矿(MgCO)、 I云石MgCa(COh]形式存在。 钡以碳酸盐、硫 酸盐形式存在,如方解石(CaCO)、石膏(CaSO42H2O)、天青石(SrS04以重品石 (BaSO4). ①第Ⅲ八族元素有时称为土族元素,其中铝最典型,铝的氧化物(为粘士的主 要成分)既难容又难熔,故有十金屈之称 9-2碱金属和碱土金属的性质 碱金属和碱土金属元素的一些基本性质,分别列于表10-1和表10-2中。 表10-1碱金属元素的性质 元素 锂(Li)钠Na)钾(K) 铷(Rb)铯(CS) 原子字数 3 11 19 37 55 价层电子构型 2 3s 4s' 5s' 6s 主要氧化数 +1 +1 +1 +1 +1 固体密度/(gcm),20℃ 0.530.970.86 1.53 1.88 熔点rC 180.597,8263.25 38.89 28.40 沸占℃ 1342 882.9 760 686 669.3 硬度(金刚石=10) 0.6 0.4 0.5 0.3 0.2 金属半径pm 152 186 227 248 265 离子半径pm 76 102 138 152 167 第一电离能(lmol) 520 496 419 403 376 第一电离能(Jmol) 7298 4562 3051 2632 2234
第十章 碱金属和碱土金属元素 本章将重点介绍碱金属和碱土金属单质、各类氧化物、氢氧化物、盐类的性 质及几种典型盐的生产。 9-1 s 区元素概述 s 区元素包括周期表中ⅠA 和ⅡA 族。ⅠA 族由锂、钠、钾、铷、铯及钫六 种元素组成。由于钠和钾的氢氧化物是典型的“碱”,故本族元素有碱金属之称。 锂、铷、铯是轻稀有金属;钫是放射性元素。ⅡA 族由铍、镁、钙、锶、钡及镭 六种元素组成。由于钙、锶、钡的氧化物性质介于“碱”族与“土”族元素” ①之间, 故有碱土金属之称。 现在习惯上把铍和镁也包括在碱土金属之内。铍也属于轻稀有金属,镭是放 射性元素。锂最重要的矿石是锂辉石(LiAlSi2O6)。钠主要以 NaCl 形式存在于海 洋、盐湖及岩石中。钾的主要矿物是钾石盐(2KCI·MgCl2·6H2O), 我国青海钾盐 储量占全国 96.8%。铍的主要矿物是绿柱石(3BeO·A12O3·6S1O2, 见右图)。镁主 要以菱镁矿(MgCO3)、白云石[MgCa(CO3)2]形式存在。钙、锶、钡以碳酸盐、硫 酸盐形式存在,如方解石(CaCO3)、石膏(CaSO4·2H2O)、天青石(SrSO4)、重晶石 (BaSO4)。 ① 第ⅢA 族元素有时称为土族元素,其中铝最典型,铝的氧化物(为粘土的主 要成分)既难溶又难熔,故有土金属之称。 9-2 碱金属和碱土金属的性质 碱金属和碱土金属元素的一些基本性质,分别列于表 10-1 和表 10-2 中。 表 10-1 碱金属元素的性质 元 素 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 原子序数 3 11 19 37 55 价层电子构型 2s1 3s1 4s1 5s1 6s1 主要氧化数 +1 +1 +1 +1 +1 固体密度/(g·cm-3 ),20℃ 0.53 0.97 0.86 1.53 1.88 熔点/℃ 180.5 97,82 63.25 38.89 28.40 沸点/℃ 1342 882.9 760 686 669.3 硬度(金刚石=10) 0.6 0.4 0.5 0.3 0.2 金属半径/pm 152 186 227 248 265 离子半径/pm 76 102 138 152 167 第一电离能(I1/kJ·mol-1 ) 520 496 419 403 376 第一电离能(I2/kJ·mol-1 ) 7298 4562 3051 2632 2234

电负性 1.0 0.9 0.8 0.8 0.7 E(M'/M)/V 3.040 2.713 -2.924 (-2.98)(-3.026) 表102碱土金属元素的性质 元素 铍(Be)镁Mg)钙(Ca)锶(Sr) 钡(Ba) 原子序数 4 12 20 38 56 价层电子构型 252 352 4s2 5s2 6S2 主要氧化数 +2 +2 +2 +2 +2 固体密度 /kgcm3).20℃ 1.85 1.74 1.54 2.6 3.51 熔点/℃ 1278648.8839 769 725 沸点/℃ 2970 11071484 1384 1640 硬度(金刚石=10) 4 2.0 1.5 1.8 金属半径pm 111 160 197 215 217 离子半径pn 45 72 100 118 136 第一电离能 I/(kJmol) g 738 590 549 503 第二电离能 /(kJmol-) 1757 1451 1145 1064 965 第三电离能 14849 I /(kJmol) 7733 4912 4138 电负性 1.5 12 10 10 09 E(M2/M)/V -1.99-2.356-2.84 -2.89-2.92 IA和ⅡA族元素的原子最外层分别只有1~2个s电子,在同一周期中这 些原子具有较大的原子半径和较少的核电荷,故IA、HA族金属晶体中的金属键 很不牢固,单质的熔、沸点较低,硬度较小。由于碱土金属比碱金属原子半径小, 核电荷多,因此碱土金属的熔点和沸点都比碱金属高,密度和硬度比碱金属大。 碱金属和Ca、Sr、Ba均可用刀切割 碱金属和碱土金属表面都具有银白色光泽,在同周期中碱金属是金属性最强 的元素,碱土金属逊于碱金属,在同族元素中随原子序数增加,元素的金属性依 次递增。碱金属尤其是Cs和Rb,失去电子的倾向很大,当受到光的照射时,金 属表面的电子易逸出,因此,常用来制造光电管。如铯光电管制成的自动报警装 置,可 :制成的天文仪器可根据由星光转变的电流大小测出 大空中 星体的亮度,推算出星体与地球的距离
电负性 1.0 0.9 0.8 0.8 0.7 E θ (M+ /M)/V -3.040 -2.713 -2.924 (-2.98) (-3.026) 表 10-2 碱土金属元素的性质 元 素 铍(Be) 镁(Mg) 钙(Ca) 锶(Sr) 钡(Ba) 原子序数 4 12 20 38 56 价层电子构型 2s2 3s2 4s2 5s2 6S2 主要氧化数 +2 +2 +2 +2 +2 固体密度 /(kg·cm-3 ),20℃ 1.85 1.74 1.54 2.6 3.51 熔点/℃ 1278 648.8 839 769 725 沸点/℃ 2970 1107 1484 1384 1640 硬度(金刚石=10) 4 2.0 1.5 1.8 - 金属半径/pm 111 160 197 215 217 离子半径/pm 45 72 100 118 136 第一电离能 I1/(kJ·mol-1 ) 899 738 590 549 503 第二电离能 I2/(kJ·mol-1 ) 1757 1451 1145 1064 965 第三电离能 I3/(kJ·mol-1 ) 14849 7733 4912 4138 - 电负性 1.5 1.2 1.0 1.0 0.9 E θ (M2+/M)/V -1.99 -2.356 -2.84 -2.89 -2.92 ⅠA 和ⅡA 族元素的原子最外层分别只有 1~2 个 s 电子,在同一周期中这 些原子具有较大的原子半径和较少的核电荷,故 IA、HA 族金属晶体中的金属键 很不牢固,单质的熔、沸点较低,硬度较小。由于碱土金属比碱金属原子半径小, 核电荷多,因此碱土金属的熔点和沸点都比碱金属高,密度和硬度比碱金属大。 Li 的密度为 0.53kg·m-3,是最轻的金属。碱金属和 Ca、Sr、Ba 均可用刀切割, 其中最软的是 Cs。 碱金属和碱土金属表面都具有银白色光泽,在同周期中碱金属是金属性最强 的元素,碱土金属逊于碱金属,在同族元素中随原子序数增加,元素的金属性依 次递增。碱金属尤其是 Cs 和 Rb,失去电子的倾向很大,当受到光的照射时,金 属表面的电子易逸出,因此,常用来制造光电管。如铯光电管制成的自动报警装 置,可报告远处火警;制成的天文仪器可根据由星光转变的电流大小测出太空中 星体的亮度,推算出星体与地球的距离
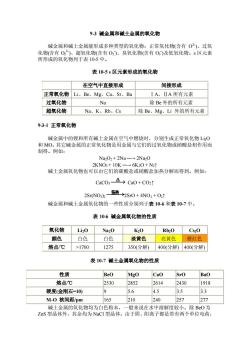
93碱金属和碱土金属的氧化物 碱金属和碱土金属能形成多种类型的氧化物:正常氧化物(含有O2)、过氧 货有装微行氧化物合有0及低氧化物。s区元 化物含有O: 表10-5s区元素形成的氧化物 在空气中直接形成 间接形成 正常氧化物Li、Be、Mg、Ca、Sr、Ba IA、ⅡA所有元素 过氧化物 Na 除Be外的所有元素 超氧化物 Na、K、Rb、Cs 除Be、Mg、Li外的所有元素 93-1正常氧化物 碱金属中的锂和所有碱土金属在空气中燃烧时,分别生成正常氧化物L0 和MO。其它碱金属的正常氧化物是用金屈与它们的过氧化物或硝酸盐相作用而 制得。例如: Na2O2+2Na-2Na2O 2KNO3+10K- →6K20+N2↑ 碱土金属氧化物也可以由它们的碳酸盐或硝酸盐加热分解而得到。例如: CaCO3- △→Ca0+C02t 2Sr(NO:)2- 热2Sr0+4NO2+02t 碱金属和碱土金属氧化物的一些性质分别列于表10-6和表10-7中。 表106碱金属氧化物的性质 氧化物 Na20 K20 Rb2O Cs20 颜色 白色 白色 淡黄色 亮黄色橙红色 熔点/℃ >1700 1275 350(分解)400(分解)400(分解) 表10-7碱土金属氧化物的性质 性质 BeO Mgo Cao Sro BaO 熔点/℃ 2530 2852 2614 2430 1918 硬度(金刚石-10) 9 56 4.5 3.5 33 M-0核间距pm 165 210 240 257 277 成十会屈的句化物的为白铅末. 一船来在水中溶解度小。除O头 ZS型晶体外,其余均为NaC型晶体。由于阴、阳离子都是带有两个单位电荷
9-3 碱金属和碱土金属的氧化物 碱金属和碱土金属能形成多种类型的氧化物:正常氧化物(含有 O 2- )、过氧 化物(含有 O2 2- )、超氧化物(含有 O2 - )、臭氧化物(含有 O3 - )及低氧化物。s 区元素 所形成的氧化物列于表 10-5 中。 表 10-5 s 区元素形成的氧化物 - 在空气中直接形成 间接形成 正常氧化物 Li、Be、Mg、Ca、Sr、Ba ⅠA、ⅡA 所有元素 过氧化物 Na 除 Be 外的所有元素 超氧化物 Na、K、Rb、Cs 除 Be、Mg、Li 外的所有元素 9-3-1 正常氧化物 碱金属中的锂和所有碱土金属在空气中燃烧时,分别生成正常氧化物 Li2O 和 MO。其它碱金属的正常氧化物是用金属与它们的过氧化物或硝酸盐相作用而 制得。例如: Na2O2 + 2Na ─→ 2Na2O 2KNO3 + 10K ─→ 6K2O + N2↑ 碱土金属氧化物也可以由它们的碳酸盐或硝酸盐加热分解而得到。例如: CaCO3 CaO + CO2↑ 2Sr(NO3)2 2SrO + 4NO2 + O2↑ 碱金属和碱土金属氧化物的一些性质分别列于表 10-6 和表 10-7 中。 表 10-6 碱金属氧化物的性质 氧化物 Li2O Na2O K2O Rb2O Cs2O 颜色 白色 白色 淡黄色 亮黄色 橙红色 熔点/℃ >1700 1275 350(分解) 400(分解) 400(分解) 表 10-7 碱土金属氧化物的性质 性质 BeO MgO CaO SrO BaO 熔点/℃ 2530 2852 2614 2430 1918 硬度(金刚石=10) 9 5.6 4.5 3.5 3.3 M-O 核间距/pm 165 210 240 257 277 碱土金属的氧化物均为白色粉末,一般来说在水中溶解度较小。除 BeO 为 ZnS 型晶体外,其余均为 NaCl 型晶体。由于阴、阳离子都是带有两个单位电荷

而且MO核间距又较小,MO具有较大晶格能,因此它们的硬度和熔点都很高。 根据这种特性,BeO和MgO常用来制造耐火材料和金属陶瓷。特别是BeO, 还具有反射放射性射线的能力 常用作原子反应堆外壁砖块材 氧化镁按制取工艺及产品的致密程度不同,有重质和轻质之分: MgO+HO一MgOH2A→MgO+HO (天然苦土粉) (重质 MgCl2+5Na2CO3+H2O -4MgCO3Mg(OH)2+10NaCl+CO2 一5Mg0+4CO2t+H20 轻质) 重质氧化镁水泥是一种很好的建筑材料,和木屑、刨花一起,可制成质轻 隔音、绝热、 耐火的纤维板 ,轻质氧化镁水泥比重质贵三信 是制坩埚的 和油漆、纸张的填料。CO是重要的建筑材料,在治炼厂中用作助溶剂,以除去 硫、磷、硅等杂质,在化工中用作制取电石(CC2)的原料,还可用作生产钙的化 学试剂、用于污水处理、造纸等,其产量仅次于硫酸。 93-2过氧化物和超氧化物 过氧化物是含有过氧基(-0-0-)的化合物,可看作是02的衍生物。除皱外, 所有碱金属和碱土金属都能形成离子型过氧化物。 除了锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。其中钠、钾、铷、 铯在过量的氧气中燃烧可直接生成超氧化物。例如: 2 是化工中最常用的碱金属过氧化物。纯的NaO2为白色粉末 工业品 一般为浅黄色。工业上制备NO2是用熔钠与己除出二氧化碳的干燥空气反应: 2Na+02-Na202 纯净的NaO28H20是用饱和NaOH(纯级)溶液和42%HO2混合制得: 2NaOH+HOC Na:0:+2H2O NO2在碱性介质中是强氧化剂,常用于作熔矿剂,以使既不溶于水又不溶 于酸的矿石被氧化分解为可溶于水的化合物。例如: 2Fe(Cro+7Na20-4NaCrO+Fe2O3+3Na2O NaO2也用于纺织、纸浆的漂白。NaO2在熔融时几乎不分解,但遇到棉花、木 炭或铝粉等还原性物质时,就会发生爆炸,故使用NaO2时要特别小心 下,过氧化物、超氧化物与水或稀酸反应生成过氧化氢,过氧化氢又分 解而放出氧气: Na20+2H20-2NaOH+HO Na2O2 +H2SO-NazSOa+H2O2 2K02+2H0 →2KOH+H02+O2 2KO2+H2S04-→KS04+H02+O2↑ 2H202 一→H0+02↑ 过氧化物和超氧化物与二氧化碳反应放出氧气:
而且 M-O 核间距又较小,MO 具有较大晶格能,因此它们的硬度和熔点都很高。 根据这种特性,BeO 和 MgO 常用来制造耐火材料和金属陶瓷。特别是 BeO, 还具有反射放射性射线的能力,常用作原子反应堆外壁砖块材料。 氧化镁按制取工艺及产品的致密程度不同,有重质和轻质之分: MgO + H2O ─→ Mg(OH)2 MgO + H2O (天然苦土粉) (重质) MgCl 2 + 5Na 2CO3 + H2O ─→ 4MgCO3·Mg(OH)2 + 10NaCl + CO2↑ │△ └─→ 5MgO + 4CO2 ↑+ H2O (轻质) 重质氧化镁水泥是一种很好的建筑材料,和木屑、刨花一起,可制成质轻、 隔音、绝热、耐火的纤维板。轻质氧化镁水泥比重质贵三倍 ,是制坩埚的原料 和油漆、纸张的填料。CaO 是重要的建筑材料,在冶炼厂中用作助溶剂,以除去 硫、磷、硅等杂质,在化工中用作制取电石(CaC2)的原料, 还可用作生产钙的化 学试剂、用于污水处理、造纸等,其产量仅次于硫酸。 9-3-2 过氧化物和超氧化物 过氧化物是含有过氧基(-O-O-)的化合物,可看作是 H2O2的衍生物。除铍外, 所有碱金属和碱土金属都能形成离子型过氧化物。 除了锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。其中钠、钾、铷、 铯在过量的氧气中燃烧可直接生成超氧化物。例如: K + O2 ─→ KO2 Na2O2是化工中最常用的碱金属过氧化物。纯的 Na2O2为白色粉末,工业品 一般为浅黄色。工业上制备 Na2O2是用熔钠与已除出二氧化碳的干燥空气反应: 2Na + O2 ─→ Na2O2 纯净的 Na2O2·8H2O 是用饱和 NaOH(纯级)溶液和 42%H2O2混合制得: 2NaOH + H2O2 Na2O2 + 2H2O Na2O2在碱性介质中是强氧化剂,常用于作熔矿剂,以使既不溶于水又不溶 于酸的矿石被氧化分解为可溶于水的化合物。例如: 2Fe(CrO2)2 + 7Na2O2 ─→ 4Na2CrO4 + Fe2O3 + 3Na2O Na2O2也用于纺织、纸浆的漂白。Na2O2 在熔融时几乎不分解,但遇到棉花、木 炭或铝粉等还原性物质时,就会发生爆炸,故使用 Na2O2时要特别小心。 室温下,过氧化物、超氧化物与水或稀酸反应生成过氧化氢,过氧化氢又分 解而放出氧气: Na2O2 + 2H2O ─→ 2NaOH + H2O2 Na2O2 + H2SO4 ─→ Na2SO4 + H2O2 2KO2 + 2H2O ─→ 2KOH + H2O2 + O2 ↑ 2KO2 + H2SO4 ─→ K2SO4 + H2O2 + O2 ↑ 2H2O2 ─→ H2O + O2 ↑ 过氧化物和超氧化物与二氧化碳反应放出氧气:

Na02+2C0-一NaC0+0t K02+2C02 2N,C03+302 因此,过氧化物和超氧化物常用作防毒面具、高空飞行、潜水的供氧剂。 93-3臭氧化物和*低氧化物 在低温下通过O,与粉末状无水碱金属(除L外)氢氧化物反应,并用液氨提 取,即可得到红色的MO3。固体: 3MOH(s)+203(g)-MO3(s)+MOH-H2O(s)+1/202(g) 室温下,臭氧化物缓慢分解为MO2和O2: M03-一2M02+1/202(g) 臭氧化物与水反应,则生成MOH和O2: 4M03+2Hh0+4MOH+5O2↑ Rb和Cs除可形成以上氧化物外,还可形成低氧化物,如低温时,Rb发生 不完全氧化可得到Rb6O,它在-7.3℃以上时分解为RbO2: 2Rb.02-15CRb,02+3Rb Cs可形成一系列低氧化物,如Cs0(青铜色)CsO(红紫色)Cs1O(紫色 晶体人Cs3+xO(为非化学计量物质)等。 9-4氢氧化物 碱金属和碱土金属的氧化物除BO、MgO外)与水作用,即可得到相应的 氢氧化物,并伴随着释放出大量热: M20 H2O-2MOH M20+H20-→2M(OH)2 碱金属和碱土金属的氢氧化物均为白色固体,易潮解,在空气中吸收CO2 生成碳酸盐。由于碱金属氢氧化物对纤维、皮肤有强烈的腐蚀作用,故称为苛性 941碱金属和碱土金属氢氧化物的碱性 碱金属和碱土金属氢氧化物除B(OH)2外]均呈碱性,同族元素氢氧化物的 碱性均随金属元素原子序数的增加而增强: LiOH NaOH KOH RbOH CSOH 中强碱强碱 强碱 强碱 强碱 Be(OH)Mg(OH CaOH Sr(OH Ba(OH 两性 中强减 强城 强减 强碱 其中B(OHh是两性的氢氧化物,它既溶于酸也溶于碱:
Na2O2 + 2CO2 ─→ Na2CO3 + O2 ↑ KO2 + 2CO2 ─→ 2N2CO3 + 3O2 ↑ 因此,过氧化物和超氧化物常用作防毒面具、高空飞行、潜水的供氧剂。 9-3-3 臭氧化物和*低氧化物 在低温下通过 O3与粉末状无水碱金属(除 Li 外)氢氧化物反应,并用液氨提 取,即可得到红色的 MO3。固体: 3MOH(s) + 2O3(g) ─→ MO3(s) + MOH·H2O(s) + 1/2O2(g) 室温下,臭氧化物缓慢分解为 MO2和 O2: MO3 ─→ 2MO2 + 1/2O2(g) 臭氧化物与水反应,则生成 MOH 和 O2: 4MO3 + 2H2O ─→ 4MOH + 5O2↑ Rb 和 Cs 除可形成以上氧化物外,还可形成低氧化物,如低温时,Rb 发生 不完全氧化可得到 Rb6O,它在-7.3℃以上时分解为 Rb9O2: 2Rb6O Rb9O2 + 3Rb Cs 可形成一系列低氧化物,如 Cs7O(青铜色)、Cs4O(红紫色)、Cs11O3(紫色 晶体)、Cs3+xO(为非化学计量物质)等。 9-4 氢氧化物 碱金属和碱土金属的氧化物(除 BeO、MgO 外)与水作用,即可得到相应的 氢氧化物,并伴随着释放出大量热: M2O + H2O ─→ 2MOH M2O + H2O ─→ 2M(OH)2 碱金属和碱土金属的氢氧化物均为白色固体,易潮解,在空气中吸收 CO2 生成碳酸盐。由于碱金属氢氧化物对纤维、皮肤有强烈的腐蚀作用,故称为苛性 碱。 9-4-1 碱金属和碱土金属氢氧化物的碱性 碱金属和碱土金属氢氧化物[除 Be(OH)2外]均呈碱性,同族元素氢氧化物的 碱性均随金属元素原子序数的增加而增强: LiOH NaOH KOH RbOH CsOH 中强碱 强碱 强碱 强碱 强碱 Be(OH)2 Mg(OH)2 CaOH)2 Sr(OH)2 Ba(OH)2 两性 中强碱 强碱 强碱 强碱 其中 Be(OH)2是两性的氢氧化物,它既溶于酸也溶于碱:

Be(OH)2+2H-Be2*+2H2O Be(OH)2+2OH-[Be(OH)4]2 氢氧化物酸碱性递变规律可用B0L规则说明 现以第三周期元素氧化物的水合物为例,说明它们的酸碱性递变与√@值的 关系(见表10-8)。 同一族元素,例如ⅡA族元素的氢氧化物M(OHD2,从表10-9所列的Φ值 可见,Be(OH2为两性氢氧化物,其余都是碱性氢氧化物,而且碱性依Be到Ba 的顺序逐渐增强 表10-8第三周期元素氧化物水合物的酸碱性 元素 Na Mg Si s CI 氧化物的水合物NaOH Mg(OH)2 Al(OH3HSiO3HP04HSO4HCIO4 R半径/nm 0.102 0072 0.05350.0400.0380.0290.027 ō值 3.13 5.27 7.49 10 11.514.4 16.1 酸碱性 强碱中强碱两性弱酸中强酸强酸最强酸 表10-9碱土金属元素氢氧化物的酸碱性 元素 Be Mg Ca Sr Ba 氢氧化物 Be(OH)2 Mg(OH Ca(OH) Sr(OH Ba(OH)2 R时半径/nm 0.045 0.072 0.100 0.118 0.136 值 6.67 5.27 4.47 4.12 3.83 酸碱性 两性 中强碱 强碱 强碱 强碱 减土金属元索素氢氧化物大都是域性氢氧化物,城性依B到Ba的顺子逐新 增强。 离子势判断氧化物水合物的酸碱性只是一个经验规律。计算表明,它对某些 物质是不适用的,如ZOH2的Z离子半径为0.074nm,石5.2,按酸碱性 的标度Zn(OH2应为碱性,而实际上Zn(OH)2为两性。 94-2碱金属和碱土金属氢氧化物的溶解性 碱金属的氢氧化物都易溶于水,仅LOH溶解度较小。碱土金属氢氧化物在 水中的溶解度比碱金属的氢氧化物小得多,并且同族元素的氢氧化物的溶解度从 上往下逐渐增大,这是因为随着阳 离子半径的增大 阳离子和阴离子之间的吸 引力逐渐减小,易被水分子拆开的缘故。同理,在同一周期内,从M(四到M(D 随着离子半径的减小和离子电荷的增多,氢氧化物的溶解度减小
Be(OH)2 + 2H+ ─→ Be 2+ + 2H2O Be(OH)2 + 2OH- ─→ [Be(OH)4] 2- 氢氧化物酸碱性递变规律可用 R-O-H 规则说明 现以第三周期元素氧化物的水合物为例,说明它们的酸碱性递变与 值的 关系(见表 10-8)。 同一族元素,例如ⅡA 族元素的氢氧化物 M(OH)2,从表 10-9 所列的 Φ 值 可见,Be(OH)2为两性氢氧化物,其余都是碱性氢氧化物,而且碱性依 Be 到 Ba 的顺序逐渐增强。 表 10-8 第三周期元素氧化物水合物的酸碱性 元素 Na Mg Al Si ?P S Cl 氧化物的水合物 NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3P04 H2SO4 HClO4 R n+半径/nm 0.102 0.072 0.0535 0.040 0.038 0.029 0.027 值 3.13 5.27 7.49 10 11.5 14.4 16.1 酸碱性 强碱 中强碱 两性 弱酸 中强酸 强酸 最强酸 表 10-9 碱土金属元素氢氧化物的酸碱性 元素 Be Mg Ca Sr Ba 氢氧化物 Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 R n+半径/nm 0.045 0.072 0.100 0.118 0.136 值 6.67 5.27 4.47 4.12 3.83 酸碱性 两性 中强碱 强碱 强碱 强碱 碱土金属元素氢氧化物大都是碱性氢氧化物,碱性依 Be 到 Ba 的顺序逐渐 增强。 离子势判断氧化物水合物的酸碱性只是一个经验规律。计算表明,它对某些 物质是不适用的,如 Zn(OH)2的 Zn2+离子半径为 0.074nm, =5.2,按酸碱性 的标度 Zn(OH)2应为碱性,而实际上 Zn(OH)2为两性。 9-4-2 碱金属和碱土金属氢氧化物的溶解性 碱金属的氢氧化物都易溶于水,仅 LiOH 溶解度较小。碱土金属氢氧化物在 水中的溶解度比碱金属的氢氧化物小得多,并且同族元素的氢氧化物的溶解度从 上往下逐渐增大,这是因为随着阳离子半径的增大, 阳离子和阴离子之间的吸 引力逐渐减小,易被水分子拆开的缘故。同理,在同一周期内,从 M(I) 到 M(II) 随着离子半径的减小和离子电荷的增多,氢氧化物的溶解度减小

碱土金属氢氧化物中,较重要的是氢氧化钙C(OH(即熟石灰)。它的溶解 度不大,且随温度升高而减小。如果配成石灰水,浓度小而碱性弱,不便使用 若配成石灰乳,在石灰乳中由于存在着如下平衡: CaOH2(S立Ca2+20H 使用时,随着OH的消耗,平衡就向右移动,石灰乳中的固体小粒能继续溶解, 供给OH。当我们需要碱时,如果不需要高浓度OH,而且C2的存在并不妨碍 所进行的反应时,则可以使用价廉易得的Ca(OH2。 95盐类 95-1盐类的性质 碱金属、碱土金属最常见的盐有卤化物、硫酸盐、硝酸盐、碳酸盐和磷酸盐。 在此着重介绍它们的共同性和锂盐、铍盐的特殊性。 1.晶体类型 饰大多数碱金属、减十金属盐类的品体屈干离子品体,它们具有较高的路占 和沸点。常温下是固体。熔化时能导电。只有B+半径小,电荷较多,极化力较 强, 当它与易变形的阴离子如CT,B,I结合时, 其化合物已 过渡为共价化合物 例如BeCh有较低的熔点,易于升华,能溶于有机溶剂中。这些性质都表明BeCI。 是一个共价化合物。 2. 碱金属离子M)和碱土金属离子(M*)都是无色的。只要阴离子是无色的 它们的化合物 无色或 厂色的少数氧化物树外):若阴离子是有色的,则它们的化合物常显阴离子的 色,如CrO,2是黄色的,BaCrO4和K2CrO4也为黄色:MnO:是紫红色的,KMnO4 中为梦T伍 3.热稳定性 。卤化物在高温时挥发而不分解 为L0和C0,外,其余者不分解:雅有硝酸盐的热稳定性较差,加热到一定 温度即可分解: HNO,Li0+4NO:1+02t 2NaNO: 3UC→2NaNO2+O2t 碱土金属的碳酸盐在常温下是稳定的(BCO)除外,只有在强热的情况下 才能分解为相应的MO和CO2 4.溶解度 碱金属的盐类一般都易溶于水。仅有少数碱金属盐微溶于水,一类是若干锂 盐如LiF、Li2CO,、LiPO,等:另一类是K、Rb、Cs(以及NH同某些较大阴 离子所成的盐,例如高氯酸钾(KCIO4)、六氯合铂酸钾
碱土金属氢氧化物中,较重要的是氢氧化钙 Ca(OH)2(即熟石灰)。它的溶解 度不大,且随温度升高而减小。如果配成石灰水,浓度小而碱性弱,不便使用, 若配成石灰乳,在石灰乳中由于存在着如下平衡: Ca(OH)2(s) Ca2+ + 2OH- 使用时,随着 OH-的消耗,平衡就向右移动,石灰乳中的固体小粒能继续溶解, 供给 OH-。当我们需要碱时,如果不需要高浓度 OH-,而且 Ca2+的存在并不妨碍 所进行的反应时,则可以使用价廉易得的 Ca(OH)2。 9-5 盐类 9-5-1 盐类的性质 碱金属、碱土金属最常见的盐有卤化物、硫酸盐、硝酸盐、碳酸盐和磷酸盐。 在此着重介绍它们的共同性和锂盐、铍盐的特殊性。 1. 晶体类型 绝大多数碱金属、碱土金属盐类的晶体属于离子晶体,它们具有较高的熔点 和沸点。常温下是固体。熔化时能导电。只有 Be2+半径小,电荷较多,极化力较 强,当它与易变形的阴离子如 Cl- ,Br- ,I-结合时,其化合物已过渡为共价化合物。 例如 BeCl2有较低的熔点,易于升华,能溶于有机溶剂中。这些性质都表明 BeCl2 是一个共价化合物。 2. 颜色 碱金属离子(M+ )和碱土金属离子(M2+)都是无色的。只要阴离子是无色的, 例如 X -(卤素离子)、O 2-、NO3 -、ClO3 -、CO3 2-等,它们的化合物都是无色或白 色的(少数氧化物例外);若阴离子是有色的,则它们的化合物常显阴离子的颜 色,如 CrO4 2-是黄色的,BaCrO4和 K2CrO4也为黄色;MnO4 -是紫红色的,KMnO4 也为紫红色。 3. 热稳定性 一般来说,碱金属盐具有较高的热稳定性。卤化物在高温时挥发而不分解; 硫酸盐在高温时既不挥发又难分解;碳酸盐除 Li2CO3在 1000℃以上部分地分解 为 Li2O 和 CO 2 外,其余皆不分解;唯有硝酸盐的热稳定性较差,加热到一定 温度即可分解: HNO3 2Li2O + 4NO2↑+ O2↑ 2NaNO3 2NaNO2 + O2↑ 2KNO3 2KaNO2 + O2↑ 碱土金属的碳酸盐在常温下是稳定的(BeCO3)除外,只有在强热的情况下, 才能分解为相应的 MO 和 CO2。 4. 溶解度 碱金属的盐类一般都易溶于水。仅有少数碱金属盐微溶于水, 一类是若干锂 盐如 LiF、Li2CO3、Li3PO4等;另一类是 K +、Rb+、Cs+ (以及 NH4 + )同某些较大阴 离子所成的盐,例如高氯酸钾(KClO4)、六氯合铂酸钾

(KPtCl6、四苯硼酸钾KB(CHs)4]、六氯合锡酸铷(Rb2SnCL6)等等。 碱十金屈中,被盐多数是易容的.递盐有部分易容.而证、锶、机的盐训多 为难融。 硫酸盐和铬酸盐的溶解度递减,氟化物的溶解度递增 5.K、Na、Mg、Ca2+、Ba+的鉴定 K、Na、Mg2+、Ca2+、Ba2的鉴定反应见表10-10 表10-10K、Na、Mg2、Ca2+、Ba2+的鉴定 离子鉴定试剂 鉴定反应 K KH2SbO4 Na'+H2SbO4- 中性梦性九NaH-SbO4(伯色) Na" Naa[Co(NO2)6]2K'+Na*+[Co(NO2)6] 中生世K,Na [Co(NOI(亮黄) Mg 镁试剂 Mg+镁试剂柱天蓝色1 Ca2+(NHa)2C204 Ca2*+C2O 一CaC204(白色) Ba2+K2CrO Ba2*+Cro 一BaCrO4(黄色) 95-2某些盐类的生产和应用 1.碳酸钠Na,CO】 、洗涤剂的生 水处理等 碳酸钠常用索尔维(E.Solvay)法来生产。该法是用饱和食盐水吸收氨气和 氧化碳制的溶解度较小的NaHCO,再将NaHCO煅烧即生成NaCO3,其反应 为: NaCI+NHs+CO2+HONaHCO;+NH.CI NaHCO. 200Na:CO3+CO21+H2O 析出后,母液中的用消石灰来回收氨以循环使用: 2NH4Cl+Ca(OH-→NH+CaCl2↑+2HO 所需的C02和石灰由石灰石煅烧来制取: CaCO: 篮→Ca0+C0f 索尔维法具有技术成熟、原料来源丰富且价廉等优点,但食盐利用率低,氨 损失大,CCh废渣造成环境污染。我国杰出的工业化学家侯德榜对氨碱法作了 重大改革,将制碱与合成氨创造性的联为一体,于1943年发明了“候氏联合制减 法”,又称氨碱法。该法先采用半煤气转化得到的和来合成氨,同时有CO2放出 再采用合成氨系统提供的NH和CO2来制碱,副产品NHC则作为化肥。此法 使NCI的利用率高达96%以上,降低了成本,实现了连续化生产,对世界制碱 工业作出了重大贡献。目前我国生产纯碱的基地主要在天津、大连、青岛、湖北 和四川自贡。 2.碳酸氢钠NaHC0g)
(K2PtCl6)、四苯硼酸钾[KB(C6H5)4]、六氯合锡酸铷(Rb2SnCl6)等等。 碱土金属中,铍盐多数是易溶的,镁盐有部分易溶,而钙、锶、钡的盐则多 为难融。其中依的顺序,硫酸盐和铬酸盐的溶解度递减,氟化物的溶解度递增。 铍盐和可溶性钡盐均有毒。 5. K+ 、Na+、 Mg2+、 Ca2+ 、Ba2+的鉴定 K + 、Na+、 Mg2+、 Ca2+ 、Ba2+的鉴定反应见表 10-10 表 10-10 K + 、Na+、 Mg2+、 Ca2+ 、Ba2+的鉴定 离子 鉴定试剂 鉴定反应 K + KH2SbO4 Na+ + H2SbO4 - NaH2SbO4↓(白色) Na+ Na3[Co(NO2)6] 2K+ + Na+ + [Co(NO2)6] 3- K2Na [Co(NO2)6]↓(亮黄) Mg2+ 镁试剂 Mg2+ + 镁试剂 天蓝色↓ Ca2+ (NH4)2C2O4 Ca2+ + C2O4 2-───→ CaC2O4↓(白色) Ba2+ K2CrO4 Ba2+ + CrO4 2-───→ BaCrO4↓(黄色) 9-5-2 某些盐类的生产和应用 1. 碳酸钠(Na2CO3) 碳酸钠又称为纯碱、苏打或碱面,它是基本化工产品之一,除了用作化工原 料外,还用于玻璃、造纸、肥皂、洗涤剂的生产及水处理等。 碳酸钠常用索尔维(E.Solvay)法来生产。该法是用饱和食盐水吸收氨气和二 氧化碳制的溶解度较小的 NaHCO3,再将 NaHCO3煅烧即生成 Na2CO3,其反应 为: NaCl + NH3 + CO2 + H2O NaHCO3 + NH4Cl NaHCO3 Na2CO3+ CO2↑+ H2O 析出后,母液中的用消石灰来回收氨以循环使用: 2NH4Cl + Ca(OH)2 ─→ NH3 + CaCl2 ↑+ 2H2O 所需的 CO2 和石灰由石灰石煅烧来制取: CaCO3 CaO + CO2↑ 索尔维法具有技术成熟、原料来源丰富且价廉等优点,但食盐利用率低,氨 损失大,CaCl2废渣造成环境污染。我国杰出的工业化学家侯德榜对氨碱法作了 重大改革,将制碱与合成氨创造性的联为一体,于 1943 年发明了“候氏联合制减 法”,又称氨碱法。该法先采用半煤气转化得到的和来合成氨,同时有 CO2放出; 再采用合成氨系统提供的 NH3和 CO2 来制碱,副产品 NH4Cl 则作为化肥。此法 使 NaCl 的利用率高达 96%以上,降低了成本,实现了连续化生产,对世界制碱 工业作出了重大贡献。目前我国生产纯碱的基地主要在天津、大连、青岛、湖北 和四川自贡。 2. 碳酸氢钠(NaHCO3)

碳酸氢钠又称为小苏打、重碳酸氢钠或培碱。常用于食品、医疗等工业。制 取纯度较高的,可在溶液中通入使其析出: Na2CO3 CO2+H2O-2NaHCO3 3.氯化钠NaCI) NaC1是日常生活和工业生产中不可缺少的物质,除供食用外,是制造几乎 所有其它钠、氯化合物的常用原料。 我国有漫长的海岸线和丰富的内陆盐湖资源,四川自贡地区含有大量食盐的 地下肉水,以及储量比自贡 大10倍的江苏淮阴地区的大盐矿,为我国人民生活 和工业用盐提供了丰富的原 NaCI的提取方法则根据盐的用途不同而异,可直接以盐水形式供化学工业 应用,也可由盐水晒制而得, 这样直接得到的食盐,含有硫酸钙、硫酸镁等杂质(称为粗盐),把粗盐溶于水, 加入适量BaC(或氢氧化 钡)、NaCO,和NaOH,使其杂质沉淀析出,经过滤、蒸发、浓缩,即可得到 精盐。其沉淀反应为: Ba2+SO42BaSO4l Ca2++C022→CaCO:I Mg2+2OH-→Mg(OH2l 4.硫酸钙(CaS04) 二水疏酸钙(CSO4-2HO)称为石膏,又称生石青,为白色粉末,微溶于水。 半水硫酸钙(CS041/2H20)又称熟石青,也为白色粉末,有吸潮性,熟石 膏粉末与水混合,可逐渐硬化并膨胀,故可用来制造模型、塑像、粉笔和石膏绷 带等。 工业上用氯化钙与硫酸铵反应,得到二水硫酸钙 CaCk+(NH4)2SO+2H2O CaSO4 2H2O+2NHCI 二水硫酸钙经煅烧、脱水,可得到半水硫酸钙。 *10-6配合物 碱金属配合物如RbL、KIBr 等为人们所熟悉,但因其离子电荷少,半径 大,形成配 它们可与配位能力较强的螯合剂作用形成螯合物和大 环配合物,如与水杨醛反应,生成为配位数为4或6的配合物(图10-1、图10-2)。 Na可与苯并-15-冠醚-5(为大环多醚)形成冠醚配合物(如图10-3、图10-4)。 碱土金属半径较大的离子如Ca2、Sr2+、Ba2可与多齿配位体(如EDTA)形成 整合物,也能与冠醚配体形成冠醚配合物
碳酸氢钠又称为小苏打、重碳酸氢钠或焙碱。常用于食品、医疗等工业。制 取纯度较高的,可在溶液中通入使其析出: Na2CO3 + CO2 + H2O ─→ 2NaHCO3 3. 氯化钠(NaCl) NaCl 是日常生活和工业生产中不可缺少的物质,除供食用外,是制造几乎 所有其它钠、氯化合物的常用原料。 我国有漫长的海岸线和丰富的内陆盐湖资源,四川自贡地区含有大量食盐的 地下卤水,以及储量比自贡大 10 倍的江苏淮阴地区的大盐矿,为我国人民生活 和工业用盐提供了丰富的原料。 NaCl 的提取方法则根据盐的用途不同而异,可直接以盐水形式供化学工业 应用,也可由盐水晒制而得, 这样直接得到的食盐,含有硫酸钙、硫酸镁等杂质(称为粗盐),把粗盐溶于水, 加入适量 BaCl2(或氢氧化 钡)、Na2CO3和 NaOH,使其杂质沉淀析出,经过滤、蒸发、浓缩,即可得到 精盐。其沉淀反应为: Ba2+ + SO4 2- ─→ BaSO4↓ Ca2+ + CO3 2- ─→ CaCO3↓ Mg2+ + 2OH- ─→ Mg(OH)2↓ Ba2+ + CO3 2- ─→ BaCO3↓ 4. 硫酸钙(CaSO4) 二水硫酸钙(CaSO4·2H2O) 称为石膏,又称生石膏,为白色粉末,微溶于水。 半水硫酸钙(CaSO4·1/2H2O)又称熟石膏,也为白色粉末,有吸潮性,熟石 膏粉末与水混合,可逐渐硬化并膨胀,故可用来制造模型、塑像、粉笔和石膏绷 带等。 工业上用氯化钙与硫酸铵反应,得到二水硫酸钙: CaCl2 + (NH4)2SO4 + 2H2O ─→ CaSO4·2H2O + 2NH4Cl 二水硫酸钙经煅烧、脱水,可得到半水硫酸钙。 *10-6 配合物 碱金属配合物如 RbI3、KIBr2、等为人们所熟悉,但因其离子电荷少,半径 大,形成配合物的倾向小,它们可与配位能力较强的螯合剂作用形成螯合物和大 环配合物,如与水杨醛反应,生成为配位数为 4 或 6 的配合物(图 10-1、图 10-2)。 Na+可与苯并-15-冠醚-5(为大环多醚)形成冠醚配合物(如图 10-3、图 10-4)。 碱土金属半径较大的离子如 Ca2+、Sr2+、Ba2+可与多齿配位体(如 EDTA)形成 螯合物,也能与冠醚配体形成冠醚配合物
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第三章 酸碱反应和沉淀反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第二章 化学反应的方向、速率和限度.pdf
- 《基础化学》课程授课教案(无机化学讲义)第一章 化学反应中的质量关系和能量关系.pdf
- 内蒙古科技大学:《基础化学》课程教学大纲 Basic Chemistry(负责人:李国祥).pdf
- 《物理化学》课程教学资源(名词术语)物理化学专业术语中英文对照表.pdf
- 《物理化学》课程教学资源(习题解答)第1章 气体.doc
- 《物理化学》课程教学资源(习题解答)第2章 热力学第一定律.doc
- 《物理化学》课程教学资源(习题解答)第3章 热力学第二定律.doc
- 《物理化学》课程教学资源(习题解答)第4章 多组分系统热力学及其在溶液中的应用.doc
- 《物理化学》课程教学资源(习题解答)第5章 相平衡.doc
- 《物理化学》课程教学资源(习题解答)第6章 化学平衡.doc
- 《物理化学》课程各章习题(含参考答案)第八章.pdf
- 《物理化学》课程各章习题(含参考答案)第九章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程各章习题(含参考答案)第十章.pdf
- 《物理化学》课程教学资源(习题解答)第11章 化学动力学基础(一).doc
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
