《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素

第十三章钢系和锕系元素 本章要求了解镧系和铜系元素的通性,我国稀土元素的概况及核反应的类型 区元素包括周期系中的镧系元素(原子序数57~71共15种元素)和钢 系元素(原子序数89~103共15种元素)。铜系元素中只有钷是人工合成的,具 有放射性。钢系元素均有放射性,铀后元素为人工合成元素,称超铺元素。钢系 元素中的钍(Th)和轴(U在地壳内储量较多,而锕(Ac、镁(Pa)、镎Np)、钚Pu) 超微 周期系第B组中的钪、钇和镧以及其它镧系元素(共17种元素 性质都非常相似,并 由止生 在 称为稀土元素 ,常用 re Earth 表示。【区元素的价层电子构型为m-2-m-1d,其特征是随着核电荷的 增加,电子依次填入外数第三层-2)f轨道,因而又统称内过渡元素。 13-1铜系和钢系元素概述 13-11价层电子结构与氧化数 元素的 子层结构除 了La为5d'6s2、Ce为4r5d'6s2、Gd为4f5d'63 Lu为4f“5d62外,其余均为4f6s2x=3一7、9一14构型 镧系元素的电子层结构最外层和次外层基本相同,只是4f轨道上的电子数 不同,但能级相近,因而它们的性质非常相似。 解系元素在形成化合物时最外层的电子、次外层的d电子均可参与成雄 另外,外数第三层中部分4f电子也可参与成键。由表41可知,铜系元素原了 的第 三电离能的总和是较低的,因而主要表现ⅢB族元素特征的氧化数 即一般皆能形成氧化数为+3的化合物。除此之外,某些镧系元素还能形成氧化 数的化合物。镧系元素的氧化数变化情况如图141所示。图中以黑圆点的大小 表示具有这种氧化数的化合物的稳定性大者稳定性大,小者稳定性次之。 La、Gd、Lu具有5d6s2电子层结构,失去三个电子后,各电子层都成为稳 定结构4全空或半充满或全充满) 分以它们只能生成氧化数为+3的稳定化 物。在化学变化中,铜系元素的原子都有达到La斗 稳定结构的趋向 也就是说,比这些稳定结构的电子数稍多的电子容易失去。总之,从L到Gd, 从Gd到Lu,氧化的变化是先升向+4,然后降到+2,再回到+3,这样钢系元素 氧化数的变化形成了两个周期。 近十多年,对稀土元素化合物的研究发现,除上面讨论的氧化变化情况外 Nd也可形成氧化数为+4的化合物。La、Cc、Nd、Pm、Dy、Er、Lu也可形成氧 化数为+2的化合物。 锕系元素的原子光谱很复杂,确定钢系元素基态原子的电子层结构也是很困 难的。表14-2所列出的价层电子构型,是根据目前实验结果,被认为是最可能 的价层电子分布。 13-1-2原子半径、离子半径和铜系收缩 由表141 142可见,镧系元素、钢系元素的和离子半径总的趋势是随着 原子序数的增加而逐渐减小,这种现象称为鞠系收缩、锕系收缩。下面以镧系元 素为例说明。 镧系元素(Lanthanides,简写为Ln)和锕系元素(Actinides,简写为An)的基本 性质列表于141和14-2
第十三章 镧系和锕系元素 本章要求了解镧系和锕系元素的通性,我国稀土元素的概况及核反应的类型。 f 区元素包括周期系中的镧系元素(原子序数 57~71 共 15 种元素)和锕 系元素(原子序数 89~103 共 15 种元素)。镧系元素中只有钷是人工合成的,具 有放射性。锕系元素均有放射性,铀后元素为人工合成元素,称超铀元素。锕系 元素中的钍(Th)和铀(U)在地壳内储量较多,而锕(Ac)、镤(Pa)、镎(Np)、钚(Pu) 则极微。 周期系第ⅢB 组中的钪、钇和镧以及其它镧系元素(共 17 种元素) 性质都非常相似,并在矿物中共生在一起,总称为稀土元素,常用 RE(Rare Earth) 表示。f 区元素的价层电子构型为(n-2)f0~14(n-1)d0~2 ns 2 , 其特征是随着核电荷的 增加,电子依次填入外数第三层(n-2)f 轨道,因而又统称内过渡元素。 13-1 镧系和锕系元素概述 13-1-1 价层电子结构与氧化数 镧系元素的电子层结构除了 La 为 5d1 6s2、Ce 为 4f15d 1 6s2、Gd 为 4f7 5d1 6s2、 Lu 为 4f145d1 6s2 外,其余均为 4fx 6s2 (x=3~7、9~14)构型。 镧系元素的电子层结构最外层和次外层基本相同,只是 4f 轨道上的电子数 不同,但能级相近,因而它们的性质非常相似。 镧系元素在形成化合物时最外层的 f 电子、次外层的 d 电子均可参与成键。 另外,外数第三层中部分 4f 电子也可参与成键。由表 l4-1 可知,镧系元素原子 的第一、二、三电离能的总和是较低的,因而主要表现ⅢB 族元素特征的氧化数, 即一般皆能形成氧化数为+3 的化合物。除此之外,某些镧系元素还能形成氧化 数的化合物。 镧系元素的氧化数变化情况如图 14-1 所示。图中以黑圆点的大小 表示具有这种氧化数的化合物的稳定性大者稳定性大,小者稳定性次之。 La、Gd、Lu 具有 5d1 6s2电子层结构,失去三个电子后,各电子层都成为稳 定结构(4f 全空或半充满或全充满),所以它们只能生成氧化数为+3 的稳定化合 物。在化学变化中,镧系元素的原子都有达到 La3+,Gd3+和 Lu3+稳定结构的趋向, 也就是说,比这些稳定结构的电子数稍多的电子容易失去。总之,从 La 到 Gd, 从 Gd 到 Lu,氧化 的变化是先升向+4,然后降到+2,再回到+3,这样镧系元素 氧化数的变化形成了两个周期。 近十多年,对稀土元素化合物的研究发现,除上面讨论的氧化变化情况外, Nd 也可形成氧化数为+4 的化合物。La、Ce、Nd、Pm、Dy、Er、Lu 也可形成氧 化数为+2 的化合物。 锕系元素的原子光谱很复杂,确定锕系元素基态原子的电子层结构也是很困 难的。表 14-2 所列出的价层电子构型,是根据目前实验结果,被认为是最可能 的价层电子分布。 13-1-2 原子半径、离子半径和镧系收缩 由表 14-1、14-2 可见,镧系元素、锕系元素的和离子半径总的趋势是随着 原子序数的增加而逐渐减小,这种现象称为镧系收缩、锕系收缩。下面以镧系元 素为例说明。 镧系元素(Lanthanides, 简写为 Ln)和锕系元素(Actinides, 简写为 An)的基本 性质列表于 14-1 和 14-2
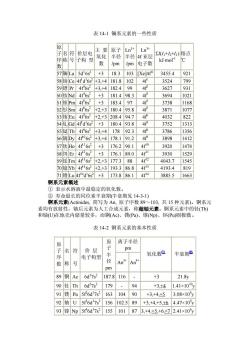
表14-1镧系元素的一些性质 子名符价层电 住要原子Ln+Ln 半径半径4f亚月 Σ+h+山)熔点 序称号子构型 氧化 pm电子数 kI-mol' 数 /pm 57镧La5d'6s2+318.3103[Xe]4f 3455.4 921 58铈Ce4fd'6s2+3,+4181.8102 3524 799 59错Pr4f62 +3,+4182.499 3627 931 50钕Nd4f6s +3 181.498.3 4 3694 102 51钷Pm4f6s +31834 07 4 3738 1168 52钐Sm4f6s +2,+3180.495.8 3871 1077 53铕Eu4f6s +2.+3208.494.7 4f 4032 822 54LGd 4f d'6s2 +3 180.493.8 4f 3752 1313 65铽Tb4f6s +3,+4178 92.3 4 3786 1356 56镝Dy406s2+3.+4178.191.2 3898 1412 57钦Ho46s2 +3176290.1 40 3920 1474 8组Er4f26s 176.189.0 4f1 3930 1529 69铥Tm46s +2,+3177.388 4r2 4043.7 1545 70镱Yb4f46s2+2,+3193.386.8 43 41934819 71僧u4d'6s +3 173.886.14r4 3885.51663 锕系元素概述 ①表示水溶液中最稳定的氧化数。 ②寿命最长的同位素半衰期半赛期见143-1) 锕系元素(Actinides,简写为An,原子序数89~103,共5种元素)。钢系元 素均有放射 性、轴后 素为人工合 成元素 你超 元素 锕系元素中的钍(Th 和铀(U)在地壳内储量较多,而钢(Ac、镤(Pa)、镎Np)、钚Pu)侧极微 表14-2钢系元素的基本性质 原 离子半径 名符 价层 pm 电子构型 氧化数@ 半衰期 数称 径 pm 89钢Ac6d7s2187.8116 、 3 21.8y 90tTh6d27s2179 。 94 +3.+4 1.41×1010y 91镤Pa5f6d'7s216310490 +3.+4+53.08×10v 92铀U5f6d'7s2156102.589 +3.+4.+5,+6 4.47×10y 93镎Np5f6d7s2155101873,+4,+5,+6,+72.41×10y
表 14-1 镧系元素的一些性质 原 子 序 数 名 称 符 号 价层电 子构 型 主 要 氧化 数 原子 半径 /pm Ln3+ 半径 /pm Ln3+ 4f 亚层 电子数 ΣI(I1+I2+I3) kJ·mol-1 熔点 ℃ 57镧 La 5d1 6s2 +3 18.3 103 [Xe]4f0 3455.4 921 58铈 Ce 4f1 d 1 6s2 +3,+4 181.8 102 4f1 3524 799 59镨 Pr 4f3 6s2 +3,+4 182.4 99 4f2 3627 931 60钕Nd 4f4 6s2 +3 181.4 98.3 4f3 3694 1021 61钷Pm 4f5 6s2 +3 183.4 97 4f4 3738 1168 62钐Sm 4f6 6s2 +2,+3 180.4 95.8 4f5 3871 1077 63铕 Eu 4f7 6s2 +2,+3 208.4 94.7 4f6 4032 822 64钆Gd 4f7 d 1 6s2 +3 180.4 93.8 4f7 3752 1313 65铽 Tb 4f9 6s2 +3,+4 178 92.3 4f8 3786 1356 66镝Dy 4f106s2 +3,+4 178.1 91.2 4f9 3898 1412 67钬Ho 4f116s2 +3 176.2 90.1 4f10 3920 1474 68饵 Er 4f126s2 +3 176.1 89.0 4f11 3930 1529 69铥Tm 4f136s2 +2,+3 177.3 88 4f12 4043.7 1545 70镱Yb 4f146s2 +2,+3 193.3 86.8 4f13 4193.4 819 71镥 Lu 4f14d 1 6s2 +3 173.8 86.1 4f14 3885.5 1663 锕系元素概述 ① 表示水溶液中最稳定的氧化数。 ② 寿命最长的同位素半衰期(半衰期见 14-3-1) 锕系元素(Actinides, 简写为 An, 原子序数 89~103, 共 15 种元素)。锕系元 素均有放射性,铀后元素为人工合成元素,称超铀元素。锕系元素中的钍(Th) 和铀(U)在地壳内储量较多,而锕(Ac)、镤(Pa)、镎(Np)、钚(Pu)则极微。 表 14-2 锕系元素的基本性质 离子半径 pm 原 子 序 数 名 称 符 号 价 层 电子构型 原 子 半 径 pm An3+ An4+ 氧化数① 半衰期② 89 锕 Ac 6d1 7s2 187.8 116 - +3 21.8y 90 钍 Th 6d2 7s2 179 - 94 +3,+4 1.41×1010 y 91 镤 Pa 5f2 6d1 7s2 163 104 90 +3,+4,+5 3.08×104 y 92 铀 U 5f3 6d1 7s2 156 102.5 89 +3,+4,+5,+6 4.47×109 y 93 镎 Np 5f4 6d1 7s2 155 101 87 3,+4,+5,+6,+7 2.41×106 y

94怀Pu 159100 8.1×103y +3.+4.+5.+6 95镅Am 173 +2 97.5 89 7.38×10 +3.+4.+5.+6 96锔Cm5f6d'7s217497 85 +3,+4 1.6×10y 97锫Bk57s2170.498 87 +3+4 1.38×10y 98铜Cf507s218695 82.1 +3+4 350y 99懷Es57s2186 98 +3,+4 277d 100镄Fm527s2(194) +2,+3 100d 101钔Md57s2(194) +2,3 55d 102偌No5f+7s2(194) +2,+3 1h 103铹Lr5f6d7s2(171) 3 3min 表示水溶液中最稳定的氧化数。 ②寿命最长的国位索半衰期(半衰期见14-3-1) ,原子半径 在镧系元素的原子中,电子逐个填充4f亚层,由于f电子对原子核的屏蔽 效应较大,所以随着原子序数的增加,有效核电荷缓慢增大,结果使原子半径缓 但 图14 有到 在总的收缩趋势中 Eu和y 原子 半径比较 原因是Eu和Yb分别具有半充满(4)和全充满(4f4)电子层结构,这一相对稳定 结构对核电荷的屏蔽增强,它们的原子半径便明显增大。 镧系元素的原子半径在Eu和Yb处出现骤升的峰值(图14-2),与其相对应的 味系元素的熔点随着原子序数的增加逐渐升高的过程中,在和处出现一 徒降的谷值[图14-3(a川: Eu(4f7 Yb(4p 三电离能总和,随着原子序数的增加而增大的过程中,在E,Yb处出现骤升的 峰值(图143b),就像出现两个山峰或山谷一样,这种现象叫做镧系元素性质递 变的“双峰效应”。 2.离子半径 Ln*半径在86~103pm之间,与其它氧化值相同的金属离子相比是比较大的 (A为53.5pm,C+为61.5pm,Fe3+为64.5pm:Co 为63pm), 与原子半径由 La到Lu在Eu、Yb处会出现峰的变化有所不同,Ln*半径的变化是十分有规律 的,如图144所示。Ln+已无6s和5d电子,最外层皆为5s25p结构,La到 Lu有效核电荷依次增加比在原子中显著:从La+到Lu+总共收缩1Tpm。Ln+所 带电荷相同,而且L的构型及半径相差不大,致使Ln+性质极为相似:其离 子化合物的溶 解度、氢氧化物的酸碱性、配合物的稳定常数,离子品体的品格能 等彼此都很接近,造成L间分离上的困难。 3.钢系收缩的后果 铜系收缩、钢系收缩是元素化学中的一个重要现象。受镧系收缩的影响, 方面铕以后的镧系元素的离子半径接近钇,构成性质极为相似的一组元素,称为 钇组元素,它们在自然界中共生,性质十分相似,难于分离:另一方面,第三过
94 钚 Pu 5f6 7s2 159 100 86 +3,+4,+5,+6 8.1×107 y 95 镅 Am 5f7 7s2 173 97.5 89 +2, +3,+4,+5,+6 7.38×103 y 96 锔 Cm 5f7 6d1 7s2 174 97 85 +3,+4 1.6×107 y 97 锫 Bk 5f9 7s2 170.4 98 87 +3,+4 1.38×103 y 98 锎 Cf 5f107s2 186 95 82.1 +3,+4 350y 99 锿 Es 5f117s2 186 98 - +3,+4 277d 100 镄 Fm 5f127s2 (194) - - +2,+3 100d 101 钔 Md 5f137s2 (194) - - +2,+3 55d 102 锘 No 5f147s2 (194) - - +2,+3 1h 103 铹 Lr 5f146d1 7s2 (171) - - +3 3min 表示水溶液中最稳定的氧化数。 ② 寿命最长的同位素半衰期(半衰期见 14-3-1) . 原子半径 在镧系元素的原子中,电子逐个填充 4f 亚层,由于 f 电子对原子核的屏蔽 效应较大,所以随着原子序数的增加,有效核电荷缓慢增大,结果使原子半径缓 慢缩小。但从图 14-2 可以看到,在总的收缩趋势中,Eu 和 Yb 原子半径比较大。 原因是 Eu 和 Yb 分别具有半充满(4f7 )和全充满(4f14)电子层结构,这一相对稳定 结构对核电荷的屏蔽增强,它们的原子半径便明显增大。 镧系元素的原子半径在 Eu 和 Yb 处出现骤升的峰值(图 14-2),与其相对应的 是镧系元素的熔点随着原子序数的增加逐渐升高的过程中,在 Eu 和 Yb 处出现 陡降的谷值[图 14-3(a)];Eu(4f7 )和 Yb(4f14)为稳定构型,镧系元素原子第一、二、 三电离能总和,随着原子序数的增加而增大的过程中,在 Eu,Yb 处出现骤升的 峰值(图 14-3(b)),就像出现两个山峰或山谷一样,这种现象叫做镧系元素性质递 变的“双峰效应”。 2. 离子半径 Ln3+半径在 86~103pm 之间,与其它氧化值相同的金属离子相比是比较大的 (Al3+为 53.5pm,Cr3+为 61.5 pm,Fe3+为 64.5 pm;Co 3+为 63pm),与原子半径由 La 到 Lu 在 Eu、Yb 处会出现峰的变化有所不同,Ln3+半径的变化是十分有规律 的,如图 14— 4 所示。Ln3+已无 6s 和 5d 电子,最外层皆为 5s2 5p6结构,La 到 Lu 有效核电荷依次增加比在原子中显著;从 La3+到 Lu3+总共收缩 17pm。Ln3+所 带电荷相同,而且 Ln3+的构型及半径相差不大,致使 Ln3+ 性质极为相似:其离 子化合物的溶解度、氢氧化物的酸碱性、配合物的稳定常数,离子晶体的晶格能 等彼此都很接近,造成 Ln3+间分离上的困难。 3. 镧系收缩的后果 镧系收缩、锕系收缩是元素化学中的一个重要现象。受镧系收缩的影响,一 方面铕以后的镧系元素的离子半径接近钇,构成性质极为相似的一组元素,称为 钇组元素,它们在自然界中共生,性质十分相似,难于分离;另一方面,第三过

渡系与第二过渡系的同族元素在原子半径(或离子半径)上相近,其中尤以ⅣB族 中的Zr和HK、VB族中的Nb和Ta、IB族中的Mo和W更为相近,以致Zr 和Hf、Nb和Ta、Mo和W的性质非常相似,分离十分困难。 13-1-3金属活泼性 镧系金属都是活泼金属,活泼性仅次于碱金属和碱土金属,它们都是强还原 剂。在不太高的温度下即可与氧、硫、氯、氨等反应,所以在治金工业中常用 脱氧剂,在无线电真空技术中用作吸气剂。镧系金属与水作用可放出 氢,与酸反应更激烈。 因此,镧系金属要保存在煤油里。此外,铈在氧化时可观察到发火现象(先 形成CeO3,继续氧化为CO),故金属铈或富铈合金常用作打火石。 铜系金属均为活泼金属和强还原剂,它们易与氧、卤素、酸等反应,因而只 能用电解其熔融盐或高温下用活泼金属(如C)还原其卤化物的方法,来制取钢系 金属。钢系元素的离子大都有颜色 13-2稀土元素 13-2-1稀土元素的资源 我国是富有稀土的国家,估计储量达1亿吨之多,占全球稀土矿总储量的四 分之 我国稀土资源有如下5大特点: 1,储量大现已探明工业储量超过世界各因工业储量的总和。仅内蒙古自治 区的白云鄂博矿因希土氧化物储量就达3600万吨,为世界最大稀土矿。 2.分布广稀土刊矿物遍及我国十几个省、自治区,但内蒙古自治区的白云鄂 博稀土矿占全国储量之首,其次是四川冕宁稀土矿、山东微山矿、江西等省的离 子型矿。 3.类型多有规模较大的花岗岩矿床,离子吸附型矿床,热液交代型铌稀土 一铁矿床 4.矿种全我国矿物品种齐全,具有重要工业意义的矿物均有发现:轻、重 稀土为主的矿物均有。轻稀土矿物有独居石、氟碳铈矿等:重稀土矿物有磷钇矿、 离子吸附型的重稀土矿广等。 5。品位高我国稀土矿物品位高,例如独居石稀氧化物品位为60%:磷钇矿 中含量约达 60 有饰 ,还含有Nb、Ta、Ti、Th、U等稀有元 素,因此矿床具有较高的综合利用价值 稀土矿的成分见表144。 ①表中数值均为稀土氧化物总含量中各成分所占百分比 表14-4我因稀土矿及世界上有代表性的稀土矿成分①
渡系与第二过渡系的同族元素在原子半径(或离子半径)上相近,其中尤以ⅣB 族 中的 Zr 和 Hf、VB 族中的 Nb 和 Ta、ⅥB 族中的 Mo 和 W 更为相近,以致 Zr 和 Hf、Nb 和 Ta、Mo 和 W 的性质非常相似,分离十分困难。 13-1-3 金属活泼性 镧系金属都是活泼金属,活泼性仅次于碱金属和碱土金属,它们都是强还原 剂。 在不太高的温度下即可与氧、硫、氯、氮等反应,所以在冶金工业中常用 作脱硫、脱氧剂,在无线电真空技术中用作吸气剂。 镧系金属与水作用可放出 氢,与酸反应更激烈。 因此,镧系金属要保存在煤油里。此外,铈在氧化时可观察到发火现象(先 形成 Ce2O3,继续氧化为 CeO2),故金属铈或富铈合金常用作打火石。 锕系金属均为活泼金属和强还原剂,它们易与氧、卤素、酸等反应,因而只 能用电解其熔融盐或高温下用活泼金属(如 Ca)还原其卤化物的方法,来制取锕系 金属。锕系元素的离子大都有颜色。 13-2 稀土元素 13-2-1 稀土元素的资源 我国是富有稀土的国家,估计储量达 1 亿吨之多,占全球稀土矿总储量的四 分之三。 我国稀土资源有如下 5 大特点: 1.储量大 现已探明工业储量超过世界各国工业储量的总和。仅内蒙古自治 区的白云鄂博矿因希土氧化物储量就达 3600 万吨,为世界最大稀土矿。 2.分布广 稀土矿物遍及我国十几个省、自治区,但内蒙古自治区的白云鄂 博稀土矿占全国储量之首,其次是四川冕宁稀土矿、山东微山矿、江西等省的离 子型矿。 3.类型多 有规模较大的花岗岩矿床,离子吸附型矿床,热液交代型铌稀土 — 铁矿床等。 4.矿种全 我国矿物品种齐全,具有重要工业意义的矿物均有发现;轻、重 稀土为主的矿物均有。轻稀土矿物有独居石、氟碳铈矿等;重稀土矿物有磷钇矿、 离子吸附型的重稀土矿等。 5. 品位高 我国稀土矿物品位高,例如独居石稀氧化物品位为 60%;磷钇矿 中钇含量约达 60%,除了有稀土元素外,还含有 Nb、Ta、Ti、Th、U 等稀有元 素,因此矿床具有较高的综合利用价值。 稀土矿的成分见表 14-4。 ① 表中数值均为稀土氧化物总含量中各成分所占百分比 表 14-4 我国稀土矿及世界上有代表性的稀土矿成分①
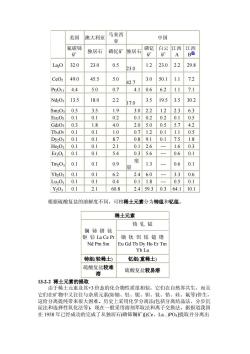
美因澳大利亚 马来西 中因 氟碳铈 独居石 磷钇 经格石磷白云图 石” A 32.0 23.0 0.5 23.0 1.2 23.0 2.2 29.8 Ceo 49.0 45.5 5.0 3.0 50.1 1.1 427 12 4.4 5.0 07 4.10.66.2117.1 13.5 18.0 2.2 17.0 3.5 19.53.5 30.2 Sm030.5 3.5 19 3.02.21.22.36.3 Eu2Os 0.1 01 02 0102020105 Gd030.3 1.8 4.0 2.05.0 0.55.74.2 TbaO? 0.1 0.1 1.0 0.7120.11.105 0.1 01 87 0.89.1 017518 Ho030.1 0.1 2.1 0.12.6 1.60.3 Er030.1 01 54 0.35.6 0.60.1 Tm203 0.1 0.1 0.9 1.3 0.6 0.1 YhO:01 0.1 62 2.46.0 -3.306 Lu2030.1 01 04 0118 0501 Y2030.12.160.8 2.459.30.364.110.1 根据硫酸复盐的溶解度不同,可将稀士元素分为铈组和钇组。 稀土元素 铕轧铽 镧铈镨钕 钷钐La ce pr 镝钬饵铥镱镥 Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 铈组(轻稀土) 钇组(重稀土) 硫酸复盐较难 硫酸复盐较易溶 溶 132-2稀土元素的提取 由于稀土元索及其+3价态的化合物性质很相似,它们在自然界共生,而且 它们在矿物中又往往与杂质元素(如轴、钍、铌、钽、钛、锆、硅、氟等)伴生, 这给分离提纯带来很大困难。历史上采用化学分离法(包括分离结晶法、分步沉 淀法和选择性氧化法等),现在 一般采用溶剂萃取法和离子交换法。据报道我国 在1958年已经成功的完成了从独居石(磷铈镧和矿)(Ce、La.)PO提取并分离出
美国 澳大利亚 马来西 亚 中国 - 氟碳铈 矿 独居石 磷钇矿 独居石 磷钇 矿 白云 矿 江西 A 江西 B ② La2O 32.0 23.0 0.5 23.0 1.2 23.0 2.2 29.8 CeO2 49.0 45.5 5.0 42.7 3.0 50.1 1.1 7.2 Pr2O11 4.4 5.0 0.7 4.1 0.6 6.2 1.1 7.1 Nd2O3 13.5 18.0 2.2 17.0 3.5 19.5 3.5 30.2 Sm2O3 0.5 3.5 1.9 3.0 2.2 1.2 2.3 6.3 Eu2O3 0.1 0.1 0.2 0.1 0.2 0.2 0.1 0.5 Gd2O3 0.3 1.8 4.0 2.0 5.0 0.5 5.7 4.2 Tb4O7 0.1 0.1 1.0 0.7 1.2 0.1 1.1 0.5 Dy2O3 0.1 0.1 8.7 0.8 9.1 0.1 7.5 1.8 Ho2O3 0.1 0.1 2.1 0.1 2.6 — 1.6 0.3 Er2O3 0.1 0.1 5.4 0.3 5.6 — 0.6 0.1 Tm2O3 0.1 0.1 0.9 痕 量 1.3 — 0.6 0.1 Yb2O3 0.1 0.1 6.2 2.4 6.0 — 3.3 0.6 Lu2O3 0.1 0.1 0.4 0.1 1.8 — 0.5 0.1 Y2O3 0.1 2.1 60.8 2.4 59.3 0.3 64.1 10.1 根据硫酸复盐的溶解度不同,可将稀土元素分为铈组和钇组。 稀土元素 镧 铈 镨 钕 钷 钐 La Ce Pr Nd Pm Sm 铕 钆 铽 镝 钬 饵 铥 镱 镥 Eu Gd Tb Dy Ho Er Tm Yb Lu 铈组(轻稀土) 钇组(重稀土) 硫酸复盐较难 溶 硫酸复盐较易溶 13-2-2 稀土元素的提取 由于稀土元素及其+3 价态的化合物性质很相似,它们在自然界共生,而且 它们在矿物中又往往与杂质元素(如铀、钍、铌、钽、钛、锆、硅、氟等)伴生, 这给分离提纯带来很大困难。历史上采用化学分离法(包括分离结晶法、分步沉 淀法和选择性氧化法等),现在一般采用溶剂萃取法和离子交换法。据报道我国 在 1958 年已经成功的完成了从独居石(磷铈镧矿)[(Ce、La.)PO4]提取并分离出

15种稀土元素的工作 1.溶剂萃取法 借助 于有机溶剂的作用,使溶解在水溶液(水相)中的溶质,部分或几乎全部 转移到有机溶剂(有机相)中去的过程称为溶剂萃取,所用的有机试剂称为萃取 剂。显然,萃取剂应为与水不互溶的液态有机化合物。 萃取分离法是利用是利用被分离的元素在两个互不相溶的液相中分配的分 配系数的不同进行分离的。萃取体系的分类可按照萃取剂的种类分为磷型(或P 、胺型 或N型合型(或C型等 常用的萃取剂有: 酸三丁酯(TBP) 磷酸二烷基酯(P小、2-乙基己基膦酸单2-乙基已(P0小氯化三烷基甲铵N6 环烷酸等。P5萃取剂的性能优异,已成功的用于混合澄清槽分离出各种单一纯 稀土.例如工业上已采用REC13-HC1-Pom煤油体系和RENO)3-HNO3-Psom煤油体 系萃取分离15种稀土元素。 由于稀土元素相邻+3价离子的分离系数(①)值差别很 必须使含料水相与 有机相多次接触(多级萃取),才能得到纯品。在实际生 中, 把若干萃取器串联 起来操作(这种工艺叫做串级萃取),从而大大提高分离效率。 1987年,徐光宪提出了优化萃取工艺设计的基本公式、原则和设计步骤, 发展了Alders.L(荷兰学者)的液-液萃取理论,并在稀土分离工艺中得到了应用。 徐光宪还与倪嘉瓒合作主持、完成了“七五”重大项目“稀土化学基础及应用研 究, 达到国际领先水平。 2.离子交换法 离子交换法(即离子交换色层分离法)是分离提纯稀土元素快速和有效的常 用方法之一。通过一次离子交换柱分离就可获得纯度高达80%的稀土元素。这 运的后理是利田冬种稀土元素配合物性质的差别,在离子交换树脂 与树脂活性基团的阳离子洗择性地进行 琉省后用 钟配 剂淋洗, 把 吸附在树脂上稀 离子分步淋洗下 经过在离子交换柱上进行的多次吸附 和解吸”(淋洗)过程,性质十分相似的元素得以分开。 现以铵式磺酸型树脂分离P+和Nd3+为例来说明:先是P3+和Nd都与NH 交换而留在树脂上,反应式为: 3RNH+P+-RPr+3NH.+ BRNH +Nd R3 Nd 3NH 然后在pH=2.6条件下,用5%的檬酸铵NH4)(Ci0)与柠檬酸(HC)混合液湖 洗交换柱,Nb+与NH4)5(Cit)生成的配合物比Pr+与CNH)(Cit)生成的配合物更 为稳定: RiNd+(NH(Cit)+H-Cit-HINd(Cit]+3RNH 因此Nd先随淋洗 液流下 。随着淋洗剂的不断流入 吸附”和解吸”,结 果Nd先从柱中 留在后面,从而达到P +完全分离的目的 由于离子交换法有不连续性、处理量少、成本高等缺点,因此,60年代后 逐步被溶剂萃取法所取代。不过现在某些工厂生产高纯单一稀土产品时仍然采用 离子交换法或将其与溶剂萃取法配合使用。 单一镧系金属和混 含镧系金属均可用电解术溶融系元素卤化物的方法制 得。但是,目前生产单一稀土元素成本高,有待进一步研究出快速、简易、价啸 的好方法。 13-2-3稀土元素的应用
15 种稀土元素的工作。 1. 溶剂萃取法 借助于有机溶剂的作用,使溶解在水溶液(水相)中的溶质,部分或几乎全部 转移到有机溶剂(有机相)中去的过程称为溶剂萃取,所用的有机试剂称为萃取 剂。显然,萃取剂应为与水不互溶的液态有机化合物。 萃取分离法是利用是利用被分离的元素在两个互不相溶的液相中分配的分 配系数的不同进行分离的。萃取体系的分类可按照萃取剂的种类分为磷型(或 P 型)、胺型(或 N 型)、螯合型(或 C 型)等。常用的萃取剂有:磷酸三丁酯(TBP)、 磷酸二烷基酯(P204)、2-乙基己基膦酸单 2-乙基己酯(P507)、氯化三烷基甲铵(N263)、 环烷酸等。P507萃取剂的性能优异,已成功的用于混合澄清槽分离出各种单一纯 稀土。例如工业上已采用 RECl3-HCl-P507 煤油体系和 RE(NO3)3-HNO3-P507煤油体 系萃取分离 15 种稀土元素。 由于稀土元素相邻+3 价离子的分离系数(D)值差别很小,必须使含料水相与 有机相多次接触(多级萃取),才能得到纯品。在实际生产中,把若干萃取器串联 起来操作(这种工艺叫做串级萃取),从而大大提高分离效率。 1987 年,徐光宪提出了优化萃取工艺设计的基本公式、原则和设计步骤, 发展了 Alders.L(荷兰学者)的液-液萃取理论,并在稀土分离工艺中得到了应用。 徐光宪还与倪嘉瓒合作主持、完成了“七五”重大项目“稀土化学基础及应用研 究”,达到国际领先水平。 2. 离子交换法 离子交换法(即离子交换色层分离法)是分离提纯稀土元素快速和有效的常 用方法之一。通过一次离子交换柱分离就可获得纯度高达 80%的稀土元素。这 个方法的原理是利用各种稀土元素配合物性质的差别,在离子交换树脂上,稀土 离子先与树脂活性基团的阳离子选择性地进行交换,随后用一种配合剂淋洗,把 吸附在树脂上稀土离子分步淋洗下来,经过在离子交换柱上进行的多次“吸附” 和“解吸”(淋洗)过程,性质十分相似的元素得以分开。 现以铵式磺酸型树脂分离Pr3+和Nd3+为例来说明:先是Pr3+和Nd3+都与NH4 + 交换而留在树脂上,反应式为: 3RNH4 + Pr3+ ─→ R3Pr + 3NH4 + 3RNH4 + Nd3+ ─→ R3Nd + 3NH4 + 然后在 pH=2.6 条件下,用 5%的檬酸铵(NH4)3(Cit)与柠檬酸(H3Cit)混合液淋 洗交换柱,Nb3+与(NH4)3(Cit)生成的配合物比 Pr3+与(NH4)3(Cit)生成的配合物更 为稳定: R3Nd + (NH4)3(Cit) + H3Cit ─→ H3[Nd(Cit)2] + 3RNH4 因此 Nd3+先随淋洗液流下。随着淋洗剂的不断流入,反复的“吸附”和“解吸”,结 果 Nd3+先从柱中流出,Pr3+留在后面,从而达到 Pr3+与 Nd3+完全分离的目的。 由于离子交换法有不连续性、处理量少、成本高等缺点,因此,60 年代后 逐步被溶剂萃取法所取代。不过现在某些工厂生产高纯单一稀土产品时仍然采用 离子交换法或将其与溶剂萃取法配合使用。 单一镧系金属和混合镧系金属均可用电解术溶融镧系元素卤化物的方法制 得。但是,目前生产单一稀土元素成本高,有待进一步研究出快速、简易、价廉 的好方法。 13-2-3 稀土元素的应用
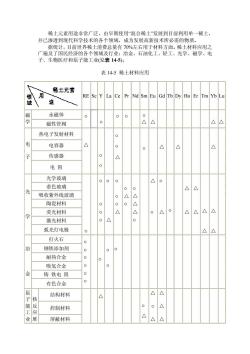
稀土元素用途非常广泛,由早期使用混合稀士”发展到目前利用单一稀土, 并已渗透到现代科学技术的各个领域,成为发展高新技术所必需的物质。 据统计 目前世界稀土消费总量有0%左右用于材料方面。稀土材料应用之 广遍及了国民经济的各个领域及行业:治金、石油化工、轻工、光学、磁学、电 子、生物医疗和原子能工业(见表145)。 表14-5稀土材料应用 稀土元素 领 用 RE ScYLa Ce PrNd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 选 磁 永磁体 学 磁性管阀 △△ △△ 热电子发射材料 电容器 4 传感器 o 电阻 0 光学玻璃 oo △0 着色玻璃 △△ 吸收紫外线玻璃 △△ 陶瓷材料 荧光材料 △ △ △△△ 激光材料 o△ 弧光灯电极 0 △△ 打火石 钢铁添加剂 0 0 耐热合金 吸氢合金 铸铁电阻 有色合金 结构材料 △ △△ 能反 工应 控制材料 业堆 屏蔽材料 △△
稀土元素用途非常广泛,由早期使用“混合稀土”发展到目前利用单一稀土, 并已渗透到现代科学技术的各个领域,成为发展高新技术所必需的物质。 据统计,目前世界稀土消费总量有 70%左右用于材料方面。稀土材料应用之 广遍及了国民经济的各个领域及行业:冶金、石油化工、轻工、光学、磁学、电 子、生物医疗和原子能工业(见表 14-5)。 表 14-5 稀土材料应用 RE Sc Y La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 磁 永磁体 学 磁性管阀 ○ - ○ - ○ ○ - ○ △ △ - - - - - - △ △ 热电子发射材料 电容器 传感器 电 子 电 阻 △ - ○ ○ - ○ ○ △ - - ○ - △ - △ - - - △ - 光学玻璃 着色玻璃 吸收紫外线玻璃 陶瓷材料 荧光材料 激光材料 光 学 弧光灯电极 ○ - ○ ○ ○ ○ ○ △ ○ ○ ○ △ ○ △ ○ ○ △ △ △ ○ - △ ○ ○ △ ○ - △ △ △ △ △ △ △ △ - 打火石 钢铁添加剂 耐热合金 吸氢合金 铸 铁电 阻 冶 金 有色合金 ○ ○ ○ ○ ○ ○ - ○ ○ ○ ○ - - - - - - - - - - - - 结构材料 控制材料 原 子 能 工 业 核 反 应 堆 屏蔽材料 - - △ - - - - ○ △ △ ○ △ △ △ △ - - - - - - -
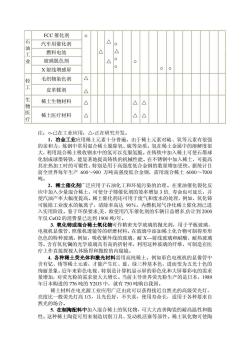
FCC催化剂 石 汽车用催化剂 油 燃料电池 △ 玻璃脱色剂 X射线增感屏 00 毛织物染色剂 皮革好剂 △ 稀土生物材料 △△ 物医疗 稀土医疗材料 △ △△ 注:。-己在工业应用:△-正在研究开发。 冶金工业应用稀土元素十分普遍 的亲和力,炼钢 中常用混合稀土脱除氧 硫等杂质。氢在稀士金月 大,利用混合稀土吸收钢水中的氢可以克服氢脆。在铸铁中加入稀土可使石墨球 化制成球墨铸铁,能显著地提高铸铁的机械性能。在不锈钢中加入稀土,可提高 其在热加工时的可锻性。特别是用于高强度低合金钢的数量增加更快。据统计目 前全世界每年生产600~900万吨高强度低合金钢,需用混合稀土6000~7000 2.稀士催化剂广泛应用于石油化工和环境污染的治理。在重油催化裂化反 应中加入少量混合稀土,可使分子筛催化剂的效率增加3倍,寿命也可延长,并 使汽油产率大幅度提高。稀土催化剂还可用于废气和废水的处理,例如,氧化铈 可脱除工业废水的福离子,情除率高达90%。内然机尾气净化稀十催化剂已讲 入实用阶段。鉴于环保要求,美、欧使用汽车催化剂的车辆日益增多,估计到200 年仅Cc02的消费量已达到1900吨/年。 3.氧化铈或混合稀土氧化物可作精密光学玻璃的抛光剂,用于平板玻璃 电视机显像管、照像机透镜等的研磨材料。在玻璃中添加稀土化合物可制得形形 名佰的特种玻璃。例如,吸收紫外线的玻商、时X一射线玻璃和耐酸、耐执玻形 等。含有氧化镧的光学玻璃具有高的折射率,利用这种玻璃的纤维,可制造在医 疗上作直接探视人体肠胃和腹腔的 内窥镜 4.各种稀土荧光体和激光材料需用高纯稀土。例如彩色电视机的显像管中 含有钇、铕等稀土元素,才能产生红、蓝、绿三种基本色,进而变为五光十色的 绚丽景象。近年来彩色电视、特别是计算机显示屏的彩色化和大屏幕彩电的需求 量增加,对荧光粉的需求量大大增长。当前主导世界荧光粉生产的是日本,1989 年日本购进的776吨的Y203中, 就有750吨购自我国, 稀土材料在电光源工业应用广泛由此可以获得接近自然光的高级荧光灯, 亮度比一般荧光灯高13,且光色好,不失真,使用寿命长,适用于各种要求自 然光的场合。 5.在制陶配料中加入混合稀土的氧化物,可大大改善陶瓷的耐高温性和脆 性。这种稀土陶瓷可用来制造切削刀具、发动机活塞等部件。稀土氧化物可使陶
FCC 催化剂 汽车用催化剂 燃料电池 玻璃脱色剂 石 油 工 业 X 射线增感屏 ○ - △ △ △ ○ △ ○ ○ - ○ - - ○ ○ - - - - - - 轻 毛织物染色剂 工 皮革鞣剂 △ △ - - - - - - - - - - - - - - - - 生 稀土生物材料 物 医 疗 稀土医疗材料 △ △ - - - - - △ △ △ △ - - - - - - - - - 注:○-已在工业应用;△-正在研究开发。 1.冶金工业应用稀土元素十分普遍。由于稀土元素对硫、氧等元素有很强 的亲和力,炼钢中常用混合稀土脱除氧、硫等杂质。氢在稀土金属中的溶解度很 大,利用混合稀土吸收钢水中的氢可以克服氢脆。在铸铁中加入稀土可使石墨球 化制成球墨铸铁,能显著地提高铸铁的机械性能。在不锈钢中加入稀土,可提高 其在热加工时的可锻性。特别是用于高强度低合金钢的数量增加更快。据统计目 前全世界每年生产 600~900 万吨高强度低合金钢,需用混合稀土 6000~7000 吨。 2.稀土催化剂广泛应用于石油化工和环境污染的治理。在重油催化裂化反 应中加入少量混合稀土,可使分子筛催化剂的效率增加 3 倍, 寿命也可延长,并 使汽油产率大幅度提高。稀土催化剂还可用于废气和废水的处理,例如,氧化铈 可脱除工业废水的氟离子,清除率高达 90%。内燃机尾气净化稀土催化剂已进 入实用阶段。鉴于环保要求,美、欧使用汽车催化剂的车辆日益增多,估计到 2000 年仅 CeO2 的消费量已达到 1900 吨/年。 3. 氧化铈或混合稀土氧化物可作精密光学玻璃的抛光剂,用于平板玻璃、 电视机显像管、照像机透镜等的研磨材料。在玻璃中添加稀土化合物可制得形形 色色的特种玻璃。例如,吸收紫外线的玻璃、耐 X— 射线玻璃和耐酸、耐热玻璃 等。含有氧化镧的光学玻璃具有高的折射率,利用这种玻璃的纤维,可制造在医 疗上作直接探视人体肠胃和腹腔的内窥镜。 4. 各种稀土荧光体和激光材料需用高纯稀土。例如彩色电视机的显像管中 含有钇、铕等稀土元素,才能产生红、蓝、绿三种基本色,进而变为五光十色的 绚丽景象。近年来彩色电视、特别是计算机显示屏的彩色化和大屏幕彩电的需求 量增加,对荧光粉的需求量大大增长。当前主导世界荧光粉生产的是日本,1989 年日本购进的 776 吨的 Y2O3 中,就有 750 吨购自我国。 稀土材料在电光源工业应用广泛由此可以获得接近自然光的高级荧光灯, 亮度比一般荧光灯高 1/3,且光色好,不失真,使用寿命长,适用于各种要求自 然光的场合。 5. 在制陶配料中加入混合稀土的氧化物,可大大改善陶瓷的耐高温性和脆 性。这种稀土陶瓷可用来制造切削刀具、发动机活塞等部件。稀土氧化物可使陶

瓷的釉彩鲜艳柔和,光彩夺目,如稀土颜料有错锆黄、镨铽锆绿、铈黄、饵红和 钻紫竿 6.稀土永磁体由于其磁性能高 己在计算机 汽车电动龙 电声器件及转 工产品诸领域中得到广泛应用,世界产量已接近万吨。稀土石榴石型磁泡信息储 存元件,尤其是钆镓石榴石(GGG)磁泡,由于其容量巨大且体积小,己在新 代计算机上应用。稀土永磁材料用于电机制造,可缩小体积,做到微型、高效化。 7.稀土在农业上也有广泛应用。现在稀土微肥适用于西瓜田中,可使西瓜 个大、皮薄、味甜,并且可提高近二成产量。施于其它瓜果、 菜园也都获得增产 优质的效果,使增收值为投入稀土微肥值的十倍以上。此微肥施于小麦和水稻 可增产8%10%。 此外,稀土金属在电子材料、原子能材料、制药合成以及超导技术等高新 技术领域的应用也日益广泛。稀土贮氢材料(己制成的主要有LaNi5及La2Mg7 等)可用于氢气贮运、能源转换、制冷及提纯氢等方面。面向未来,稀土元素作 为材料研究,在激光、发 光、 超是 化、 专 、生物等令 域将会作为主攻方向。我国拥有十分丰富的稀土资源,开展稀土的研究、开发和 应用,无疑对我国的经济建设和科学技术的发展有重要意义。 *13-3核反应和超轴元素的合成 核反应与化学反应不同,化学反应前后原子核亦即元素的种类不变,而原子 核反应涉及原子核里质子或中子的增减,经核反应后,往往导致一种元素变为另 着产生大量的能量 衰变、粒子轰击原子核、核裂变及核聚变等四种类 种同 L系, 还伴阳 ,核反应一般可分为放射性 14-3-1放射性衰变和应用 】妆时件言亦 天然放射性是指不稳定原子核自发放出α、B、Y射线的现象。大量的同种原 子核因放射性而陆续发生转变,使处于原状态的核数目不断减少的过程称为放射 性衰变。常见的衰变有以下三种。 ()a衰变 不稳定的原子核自发地放射出。射线的过程,称为α衰变。α射线是α粒子 (红e氨核)流。当质量数为238的核泰(简写为铺-238)失去一个α粒子时,剩下的 是原子序数90和质量数为234的钍核,即凸,其核反应方程式如下: 例T-→为Th+扣 (2)B-衰变 不稳定的原子核自发地放射出射线的过程,称为阝衰变。射线是高速电 子流,用e表示。例如: 7gi→Po+9e
瓷的釉彩鲜艳柔和,光彩夺目,如稀土颜料有镨锆黄、镨铽锆绿、铈黄、饵红和 钕紫等。 6. 稀土永磁体由于其磁性能高,已在计算机、汽车电动机、电声器件及轻 工产品诸领域中得到广泛应用,世界产量已接近万吨。稀土石榴石型磁泡信息储 存元件,尤其是钆镓石榴石(G G G)磁泡,由于其容量巨大且体积小,已在新一 代计算机上应用。稀土永磁材料用于电机制造,可缩小体积,做到微型、高效化。 7. 稀土在农业上也有广泛应用。现在稀土微肥适用于西瓜田中,可使西瓜 个大、皮薄、味甜,并且可提高近二成产量。施于其它瓜果、菜园也都获得增产、 优质的效果,使增收值为投入稀土微肥值的十倍以上。此微肥施于小麦和水稻, 可增产 8%~10%。 此外,稀土金属在电子材料、原子能材料、制药合成以及超导技术等高新 技术领域的应用也日益广泛。稀土贮氢材料(已制成的主要有 LaNi5 及 La2Mg7 等)可用于氢气贮运、能源转换、制冷及提纯氢等方面。面向未来,稀土元素作 为材料研究,在激光、发光、信息、永磁、超导、能源、催化、传感、生物等领 域将会作为主攻方向。我国拥有十分丰富的稀土资源,开展稀土的研究、开发和 应用,无疑对我国的经济建设和科学技术的发展有重要意义。 * 13-3 核反应和超铀元素的合成 核反应与化学反应不同,化学反应前后原子核亦即元素的种类不变,而原子 核反应涉及原子核里质子或中子的增减,经核反应后,往往导致一种元素变为另 一种元素或另一种同位素,还伴随着产生大量的能量。核反应一般可分为放射性 衰变、粒子轰击原子核、核裂变及核聚变等四种类型。 14-3-1 放射性衰变和应用 1. 放射性衰变 天然放射性是指不稳定原子核自发放出 α、β、γ射线的现象。大量的同种原 子核因放射性而陆续发生转变,使处于原状态的核数目不断减少的过程称为放射 性衰变。常见的衰变有以下三种。 (1) α衰变 不稳定的原子核自发地放射出。射线的过程,称为 α衰变。α射线是 α粒子 ( 氦核)流。当质量数为 238 的核素(简写为铀-238)失去一个 α粒子时,剩下的 是原子序数 90 和质量数为 234 的钍核,即 ,其核反应方程式如下: 在上述核反应中,方程式两边质量总数相等(即 238=234+4),原子序数之和或核 电荷总数也相等(92=90+2)。 (2) β-衰变 不稳定的原子核自发地放射出 β -射线的过程,称为 β -衰变。β -射线是高速电 子流,用 表示。例如:

由上可见,放射性元素从原子核里放射α粒子,质量数减少4,核电荷减少 2,生成的新元素在元素周期表中的位置向左移了两格:从原子核里放射B粒子, 质量数不变 核电 荷增加1,生成的新元素在元素周期表中的位置向右移了一格。 此规律称为放射性位移定律。例如: 4gBa广→数a厂eD )衰变 由激发态原子核通过发射γ射线(光子)跃迁到低能态的过程,称为Y衰变。 例如 Co_Co+Y 显然,在γ衰变时原子核的质量数和电荷数均保持不变,仅仅是能量状态发 生了变化 Y射线是一种波长极短的电磁波,即高能光子。它不为电、磁场所偏移,是 一种电中性的射线,比X射线的穿透力还强,因而有硬射线之称,可穿透200mm 厚的铁板或88mm厚的铅板,它没有质量,其光谱类似于元素的原子光谱。 人工放射性核素还有其它衰变方式,如正电子B衰变、电子俘获等。 (④)B衰变 B射线是高速正离子(c)流,正电子是电子的反物质。它的质量和电子相同, 电荷也相同,只是符号相反。B衰变可看做是核中的质子(P)转化为中子(O”)的 过程,此时核电荷减少一个单位,而质量不变: ip+e- 发生衰变的例如: 10Ne->E+e c→+c (⑤)电子俘获 原子核可以从内层K层)中俘获一个电子,使核内一个质子变成中子: 电子俘获的核衰变例如: Be geLi ioK e iAr 在放射性衰变过程中,放射性元素的核素减少到原有核数 一半所需的时间称 为半衰期。半衰期是放射性核数的一个特性常数,一般不随外界条件的变化、元 素所处的状态(游离态或化合态)的不同或元素质量的多少而改变。元素的放射性
由上可见,放射性元素从原子核里放射 α粒子,质量数减少 4,核电荷减少 2,生成的新元素在元素周期表中的位置向左移了两格;从原子核里放射 β -粒子, 质量数不变,核电荷增加 1,生成的新元素在元素周期表中的位置向右移了一格。 此规律称为放射性位移定律。例如: 4 (3) γ衰变 由激发态原子核通过发射 γ射线(γ光子)跃迁到低能态的过程,称为 γ衰变。 例如: ─→ + γ 显然,在 γ衰变时原子核的质量数和电荷数均保持不变,仅仅是能量状态发 生了变化。 γ射线是一种波长极短的电磁波,即高能光子。它不为电、磁场所偏移,是 一种电中性的射线,比 X 射线的穿透力还强,因而有硬射线之称,可穿透 200mm 厚的铁板或 88mm 厚的铅板,它没有质量,其光谱类似于元素的原子光谱。 人工放射性核素还有其它衰变方式,如正电子 β +衰变、电子俘获等。 (4) β +衰变 β +射线是高速正离子( )流,正电子是电子的反物质。它的质量和电子相同, 电荷也相同,只是符号相反。β +衰变可看做是核中的质子( )转化为中子( )的 过程,此时核电荷减少一个单位,而质量不变: 发生 β +衰变的例如: (5) 电子俘获 原子核可以从内层(K 层)中俘获一个电子,使核内一个质子变成中子: ─→ + 电子俘获的核衰变例如: ─→ + ─→ + 在放射性衰变过程中,放射性元素的核素减少到原有核数一半所需的时间称 为半衰期。半衰期是放射性核数的一个特性常数,一般不随外界条件的变化、元 素所处的状态(游离态或化合态)的不同或元素质量的多少而改变。元素的放射性
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第三章 酸碱反应和沉淀反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第二章 化学反应的方向、速率和限度.pdf
- 《基础化学》课程授课教案(无机化学讲义)第一章 化学反应中的质量关系和能量关系.pdf
- 内蒙古科技大学:《基础化学》课程教学大纲 Basic Chemistry(负责人:李国祥).pdf
- 《物理化学》课程教学资源(名词术语)物理化学专业术语中英文对照表.pdf
- 《物理化学》课程教学资源(习题解答)第1章 气体.doc
- 《物理化学》课程教学资源(习题解答)第2章 热力学第一定律.doc
- 《物理化学》课程教学资源(习题解答)第3章 热力学第二定律.doc
- 《物理化学》课程教学资源(习题解答)第4章 多组分系统热力学及其在溶液中的应用.doc
- 《物理化学》课程教学资源(习题解答)第5章 相平衡.doc
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十章 醇、酚、醚.pdf
- 《基础化学》课程授课教案(物理化学讲义)第一章 第零定律与物态方程.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十三章 羧酸衍生物.pdf
