《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性

第五章原子结构与元素周期性 在前面一至四章中,介绍并与用化学热力学、化学动力学的基础知识,从宏 观角度讨论了解离、水解、沉淀和氧化还原等化学反应的方向、速率及限度问题。 本章开始至第七章,依次介绍并运用了原子、分子和固体的结构知识,从微观角 度讨论物质的结构及其与性质的关系。 5-1原子和元素 5-1-1原子的组成和元素 自1897年英国物理学家汤姆逊J.Thomson)发现电子以来,经过了几十年 的研究,人们已经意识到原子是一种电中性的微粒,是与一个带若干(Z)正电荷 的原子核的原子核和Z个带负电荷的电子组成的:原子核是由Z个单位正电荷 的质子(P和若干个中子(口)阻成的紧密结合体,其直径不及原子的万分之一:电 子的直径更小。可见原子核和电子只占原子的极小部分,原子内部绝大部分是“空 着的”. 同一元素的原子核含有相同数目的质子,但可以含有数目不同的中子。电子、 质子、中子、光子以及在字宙射线和高能原子核物理实验中发现的一系列粒子, 统称为基本粒子。 元素是具有相同质子数的一类原子的总称。根据原子中质子数目的不同,可 以区别为不同的元素。不同的元素在元素周期表中个占据不同的位置。不同元素 的原子、质子数目由小到大排列的顺序数,称为原子序数, 因此对每一种原子来说:原子序数(Z)核内质子数=核电荷数=核外电子数 质子数相同而中子数不同的同一种元素的原子,有着基本相同的化学性质, 且在元素周期表中处于同一位置,故互称为同位素。具有确定中子数和质子数的 单核电自称为核素,例如氢有三种核素,如表51所示。除少数几中元素外绝大 多数都两种或两种以上的核素,其中锡的核素多达10种。 表51氢的同位素 原子的组成质 核素名称 核素符号 在自然界中的氢所 质子数中子数数 占的百分数% 氢或氕 坦”短 1 0 1 99.98 重氢或重氘 狂或D 1 1 0.015 超重氢或氚 H或T 1 2 3 10-16
第五章 原子结构与元素周期性 在前面一至四章中,介绍并与用化学热力学、化学动力学的基础知识,从宏 观角度讨论了解离、水解、沉淀和氧化还原等化学反应的方向、速率及限度问题。 本章开始至第七章,依次介绍并运用了原子、分子和固体的结构知识,从微观角 度讨论物质的结构及其与性质的关系。 5-1 原子和元素 5-1-1 原子的组成和元素 自 1897 年英国物理学家汤姆逊(J.J.Thomson)发现电子以来,经过了几十年 的研究,人们已经意识到原子是一种电中性的微粒,是与一个带若干(Z)正电荷 的原子核的原子核和 Z 个带负电荷的电子组成的;原子核是由 Z 个单位正电荷 的质子(p)和若干个中子(n)组成的紧密结合体,其直径不及原子的万分之一;电 子的直径更小。可见原子核和电子只占原子的极小部分,原子内部绝大部分是“空 着的”。 同一元素的原子核含有相同数目的质子,但可以含有数目不同的中子。电子、 质子、中子、光子以及在宇宙射线和高能原子核物理实验中发现的一系列粒子, 统称为基本粒子。 元素是具有相同质子数的一类原子的总称。根据原子中质子数目的不同,可 以区别为不同的元素。不同的元素在元素周期表中个占据不同的位置。不同元素 的原子、质子数目由小到大排列的顺序数,称为原子序数。 因此对每一种原子来说:原子序数(Z)=核内质子数=核电荷数=核外电子数 质子数相同而中子数不同的同一种元素的原子,有着基本相同的化学性质, 且在元素周期表中处于同一位置,故互称为同位素。具有确定中子数和质子数的 单核电自称为核素,例如氢有三种核素,如表 5-1 所示。除少数几中元素外绝大 多数都两种或两种以上的核素,其中锡的核素多达 10 种。 表 5-1 氢的同位素 原子的组成 核素名称 核素符号 质子数 中子数 质 量 数 在自然界中的氢所 占的百分数/% 氢或氕 1 0 1 ≈99.98 重氢或重氘 1 1 2 0.015 超重氢或氚 1 2 3 10-16

根据来源和稳定性,可将核素分为稳定核素和放射性核素。放射性核素的原 子核不稳定,能放出射线而蜕变成别的元素。目前已发现的118种元素的核素己 达2000种左右· 质量数相同而原子系数不同的元素,互称为异序同量素,简称同量素。 ①元素符号左上角的数字表示质量数,左下角的数字表示原子序数。 51-2反原子和反物质 1932年美国物理学家安德森(C.D.Anderson)在字宙线实验中发现了与电子质 量相同带单位正电荷的粒子 正电子(e):1956年美国物玛 学家张伯伦 (O.Chamberlain)等在加速器实验中发现了质量与正质子p*)相同带单位负电荷的 粒子一负质子)。以后又陆续发现了许多类似的情况,证实一切粒子都有与 之相对应的反粒子①。例如中子不带电但一定有磁性,反中子则呈相反的磁性。 ①反粒子的概念最初数英国物理学家狄拉克P.M.A.Dirac))提出来的 据报道,欧洲核子研究中心的德国和意大利科学家从1995年9月开始的实 验,已经成功的获得了反氢原子(有一个反质子p和一个反电子结合而成),亦 即获得了反物质。尽管这种反氢原子只能存在极短瞬间,但这项实验不仅为系统 的探索反物质世界打开了大门,而且为自然辩证法提供了极为有利的佐证,具有 5-1-3原子轨道能级 1913年玻尔在前人工作的基础上提出了玻尔原子模型,其要点如下: 1.定态轨道概念 氢原子中的电子是在氢原子核的势能场中运动,其运动轨道不是任意的,电 子只能在以原子核为中心的某些能量(E)确定的圆形轨道上运动。这些轨道的能 量状态不随时间而改变,因此被称为定态轨道。电子在定态轨道上运动时,既不 吸收也不释放能量 2.轨道能级的概念 ()最简单的原子—氢原子的光谱 (2)轨道能级的概念 不同的定态轨道能量是不同的。离核越近的轨道,能量越低,电子被原子核 束缚得越牢:离核越远的轨道,能量越高。轨道的这些能量状态,称为能级。氢 原子轨道能级如图51所示
根据来源和稳定性,可将核素分为稳定核素和放射性核素。放射性核素的原 子核不稳定,能放出射线而蜕变成别的元素。目前已发现的 118 种元素的核素已 达 2000 种左右。 质量数相同而原子系数不同的元素,互称为异序同量素,简称同量素。 ──────────────────────────────────── ① 元素符号左上角的数字表示质量数,左下角的数字表示原子序数。 *5-1-2 反原子和反物质 1932年美国物理学家安德森(C.D.Anderson)在宇宙线实验中发现了与电子质 量相同带单位正电荷的粒子— — 正电子(e+ );1956 年美国物理学家张伯伦 (O.Chamberlain)等在加速器实验中发现了质量与正质子(p+ )相同带单位负电荷的 粒子— — 负质子(p- )。以后又陆续发现了许多类似的情况,证实一切粒子都有与 之相对应的反粒子① 。例如中子不带电但一定有磁性,反中子则呈相反的磁性。 ① 反粒子的概念最初数英国物理学家狄拉克(P.M.A.Dirac)提出来的。 据报道,欧洲核子研究中心的德国和意大利科学家从 1995 年 9 月开始的实 验,已经成功的获得了反氢原子(有一个反质子 p -和一个反电子 e +结合而成),亦 即获得了反物质。尽管这种反氢原子只能存在极短瞬间,但这项实验不仅为系统 的探索反物质世界打开了大门,而且为自然辩证法提供了极为有利的佐证,具有 5-1-3 原子轨道能级 1913 年玻尔在前人工作的基础上提出了玻尔原子模型,其要点如下: 1. 定态轨道概念 氢原子中的电子是在氢原子核的势能场中运动,其运动轨道不是任意的,电 子只能在以原子核为中心的某些能量(En)确定的圆形轨道上运动。这些轨道的能 量状态不随时间而改变,因此被称为定态轨道。电子在定态轨道上运动时,既不 吸收也不释放能量。 2. 轨道能级的概念 (1) 最简单的原子──氢原子的光谱 (2) 轨道能级的概念 不同的定态轨道能量是不同的。离核越近的轨道,能量越低,电子被原子核 束缚得越牢;离核越远的轨道,能量越高。轨道的这些能量状态,称为能级。氢 原子轨道能级如图 5-1 所示

(3)基态与激发态 在正常状态下,电子尽可能处于离核较近、能量较低的轨道上,这时原子所 处的状态称为基态 ,在高温火焰下,电火花或电弧作用下,基态原子中的 获得能量,能跃迁到离核较远、能量较高的空轨道上去运动,这时原子所处的状 态称为激发态。n一∞时,电子所处的轨道能量定为零,意味者电子被激发到 这样的能级时,由于获得足够大的能量,可以完全摆脱核势能场的束缚而电离 因此,离核越近的轨道,能级越低,势能值越负。 3.玻尔原子模型的应用范围与局限性 玻尔原子模型成功的解释了氢原子和类氢原子(如H,Li2+,Be3)的光谱现 象。时至今日,玻尔提出的关于原子中轨道能级的概念,仍然有用。但是玻尔理 论有着严重的局限性,它只能解释单电子原子(或离子)光谱的一般现象,不能解 释多电子原子光谱,其根本原因在于玻尔的原子模型是建立在牛顿的经典力学理 论基础上的。它的假设是把原子描绘成一个太阳系,认为电子在核外运动就犹如 行星围绕着太阳转一样, 会遵循经典力学的运动规律,但实际上电子这样微小 运动速度又极快的粒子在极小的原子体积内运动,是根本不遵循经典力学的运 规律的。玻尔理论的缺陷,促使人们去研究和建立能描述电子内运动规律的量子 力学原子模型。 52原子结构的近代概念 1g26在奥地利科学家薛定兽E Schr0di ,18871961.图5.2)建立起描 原 规律的 有称波动力 学)理论。人们利用 一位树季理论研究愿子结的,逐步形成了原子结构的近代概老 等) 字 5-2-1电子的波、粒二象性 本世纪初人们己经发现,光不仅有微粒的性质,而且有波动的性质,即具有 波粒二象性。前面已经提及,原子中的电子是一种有确定体积(直径一般为105m) 和质量(9.1091×103kg)的粒子。因此,电子具有粒子性在此无需论证,而且这 点也早为玻尔等人所认识。问题是电子运动是香也像光子二样,表现出波动的性 1927年美国物理学家戴维逊(D.J.Davisson)等通过电子衍射实验证明了电 子运动是确实具有波动性:如图53所示,当高速运动的电子束穿过晶体光栅投 射到感光底片上时,得到的不是一个感光点,而是明暗相间的衍射环纹,与光的 衍射图相似。 后来还相继发现质子、中子等粒子均能产生衍射现象,具有宏观物体难以表 现出来的波动性,而这一特点恰是经典力学所没有认识到的。 5-2-2概率
(3) 基态与激发态 在正常状态下,电子尽可能处于离核较近、能量较低的轨道上,这时原子所 处的状态称为基态。在高温火焰下,电火花或电弧作用下,基态原子中的电子因 获得能量,能跃迁到离核较远、能量较高的空轨道上去运动,这时原子所处的状 态称为激发态。n → ∞ 时,电子所处的轨道能量定为零,意味着电子被激发到 这样的能级时,由于获得足够大的能量,可以完全摆脱核势能场的束缚而电离。 因此,离核越近的轨道,能级越低,势能值越负。 3. 玻尔原子模型的应用范围与局限性 玻尔原子模型成功的解释了氢原子和类氢原子(如 He+ , Li2+,Be3+)的光谱现 象。时至今日,玻尔提出的关于原子中轨道能级的概念,仍然有用。但是玻尔理 论有着严重的局限性,它只能解释单电子原子(或离子)光谱的一般现象,不能解 释多电子原子光谱,其根本原因在于玻尔的原子模型是建立在牛顿的经典力学理 论基础上的。它的假设是把原子描绘成一个太阳系,认为电子在核外运动就犹如 行星围绕着太阳转一样,会遵循经典力学的运动规律,但实际上电子这样微小、 运动速度又极快的粒子在极小的原子体积内运动,是根本不遵循经典力学的运动 规律的。玻尔理论的缺陷,促使人们去研究和建立能描述电子内运动规律的量子 力学原子模型。 5-2 原子结构的近代概念 1926 年奥地利科学家薛定谔(E.Schrodinger,1887~1961,图 5-2),建立起描述 微观粒子(如原子、电子等)运动规律的量子力学(有称波动力学)理论。人们利用 量子力学理论研究原子结构,逐步形成了原子结构的近代概念。 5-2-1 电子的波、粒二象性 本世纪初人们已经发现,光不仅有微粒的性质,而且有波动的性质,即具有 波粒二象性。前面已经提及,原子中的电子是一种有确定体积(直径一般为 10-15m) 和质量(9.1091×10-31kg)的粒子。因此,电子具有粒子性在此无需论证,而且这一 点也早为玻尔等人所认识。问题是电子运动是否也像光子一样,表现出波动的性 质。 1927 年美国物理学家戴维逊(D. J. Davisson)等通过电子衍射实验证明了电 子运动是确实具有波动性:如图 5-3 所示,当高速运动的电子束穿过晶体光栅投 射到感光底片上时,得到的不是一个感光点,而是明暗相间的衍射环纹,与光的 衍射图相似。 后来还相继发现质子、中子等粒子均能产生衍射现象,具有宏观物体难以表 现出来的波动性,而这一特点恰是经典力学所没有认识到的。 5-2-2 概率

若用慢射电子枪(可控制射出电子数的电子发射装置)取代电子束进行类似 图5-3所示的实验,结果发现,每个电子在感光底片上弹着的位置是无法预料的 没有固定轨道的:但是当单个的电 断的发射以后 在感光后 运动得到明暗相间的衍射环纹,这说明电子运动是有想律的 无疑衍射强度大,说明电子出现的机会多,亦即概率大:暗环纹处则正好相反。 量子力学队为,原子中个别电子运动的轨迹是无法确定的,亦即没有确定的 轨道,这一点是与经典力学有原则的差别。但是原子中电子在原子核外的分布还 是有规律的:核外空间某些区域电子出现的概率较大,而另一些电子出现的概率 较小。电子在原子核外空间某处单位体积内出现的概率称为概率密度 5-2-3原子轨道 1.波函数 1926年薛定谔根据波、粒二象性的概念提出了一个描述微观粒子运动的基本 方程一薛定谔波动方程。这个方程是一个二阶段偏微分方程,它的形式如下: 胶++正 2(.门=0 式中g叫做波函数,h为普朗克常数,m为微粒的质量,x,y,:为微粒的空间 标 对氢原子体系来说,”是描述氢核外电子运动状态的数学表达式,是空间坐 标x,少,:的函数x,小E为氢原子的总能量:V为电子的势能(亦即核 对电子的吸引能):m为电子的质量。解一个体系(例如氢原子体系)的薛定谔方程, 一般可以得到一系列的波函数Ψ1s,2s,.4和相应的一系列能量值E1s, ,E.。方程式的每一个合理的解4,就代表体系中电子的一种可能的运 动状态。例如基态氢原子中电子所处的能态: 1 官n E1=-2.179×108J 式中r为电子离原子核的距离,ao被称为玻尔半径“(53pm)π为圆周率,e为自然 对数的底数。 可见在量子力学中是用波函数和与其对应的能量来描述微观粒子运动状态 的。 原子中电子的波函数”既然是描述电子运动的数学表示式,而且又是空间 坐标的函数,其空间图像可以形象的理解为电子运动的空间范围,俗称“原子轨 道”。 这里需要特别提醒注意:此处所指的原子轨道与玻尔原子模型所指的原子轨 道截然不同。前 者指电 在原子核外运动的某个 间范围 后者是指 核外电 子运动的某个确定的圆形轨道。有时为了避免与经典力学中的玻尔轨道相混淆
若用慢射电子枪(可控制射出电子数的电子发射装置)取代电子束进行类似 图 5-3 所示的实验,结果发现,每个电子在感光底片上弹着的位置是无法预料的, 说明电子运动是没有固定轨道的;但是当单个的电子不断的发射以后,在感光底 片上仍然可以得到明暗相间的衍射环纹,这说明电子运动是有规律的。亮环纹处 无疑衍射强度大,说明电子出现的机会多,亦即概率大;暗环纹处则正好相反。 量子力学认为,原子中个别电子运动的轨迹是无法确定的,亦即没有确定的 轨道,这一点是与经典力学有原则的差别。但是原子中电子在原子核外的分布还 是有规律的:核外空间某些区域电子出现的概率较大,而另一些电子出现的概率 较小。电子在原子核外空间某处单位体积内出现的概率称为概率密度。 5-2-3 原子轨道 1. 波函数 1926 年薛定谔根据波、粒二象性的概念提出了一个描述微观粒子运动的基本 方程 ──薛定谔波动方程。这个方程是一个二阶段偏微分方程,它的形式如下: 式中 ψ 叫做波函数, h 为普朗克常数,m 为微粒的质量,x,y,z 为微粒的空间 坐标。 对氢原子体系来说,ψ是描述氢核外电子运动状态的数学表达式,是空间坐 标 x,y,z 的函数 ψ=f(x,y,z);E 为氢原子的总能量;V 为电子的势能(亦即核 对电子的吸引能);m 为电子的质量。解一个体系(例如氢原子体系)的薛定谔方程, 一般可以得到一系列的波函数 ψ1s,ψ2s,ψ2px,.ψi .和相应的一系列能量值 E1s, E2s,E2px,.Ei.。方程式的每一个合理的解 ψi就代表体系中电子的一种可能的运 动状态。例如基态氢原子中电子所处的能态: E1s=-2.179×10-18J 式中 r 为电子离原子核的距离,a0被称为玻尔半径① (53pm),π为圆周率,e 为自然 对数的底数。 可见在量子力学中是用波函数和与其对应的能量来描述微观粒子运动状态 的。 原子中电子的波函数 ψ既然是描述电子运动的数学表示式,而且又是空间 坐标的函数,其空间图像可以形象的理解为电子运动的空间范围,俗称“原子轨 道”。 这里需要特别提醒注意:此处所指的原子轨道与玻尔原子模型所指的原子轨 道截然不同。前者指电子在原子核外运动的某个空间范围,后者是指原子核外电 子运动的某个确定的圆形轨道。有时为了避免与经典力学中的玻尔轨道相混淆

又称为原子轨函(原子轨道函数之意),亦即波函数的空间图像就是原子轨道,原 子轨道的表示式就是波函数。为此,波函数与原子轨道常作同意语混用。 2.原子轨道的角度分布图 将波函数Ψ的角度分布部分(Y)作图,所得的图像就称为原子轨道的角度 分布图(见图5-4),如文字教材中的图5-4实线部分所示。 5-2-4电子云 1.概率密度 在光的波动方程中,代表电磁波的电磁场强度。由于 光的跟度:光子数目 (体玛 光子密度 而光的强度又与电磁场强度y)的绝对值平方成正比: 光的品府oxw小 所以,光子密度是与2成正比的。 同理, 在原子核外某处空间,电子出现的 率密度()也是和电子波在该处的强度()的绝对值平方成正比的: 但在研究时,有实际意义的只是它在空间各处的相对密度,而不是其绝对 值本身,故作图时可不考虑P与p之间的比例常数,因而电子在原子中核外某 处出现的概率密度可直接用来表示。 为了形象地表示核外电子运动的概率分布情况,化学上惯用小黑点分布的疏 密表示电子出现概率密度的相对大小。小黑点较密的地方,表示概率密度较大 单位体积内电子出现的机会多。用这种方法米描述电子在核外出现的概率密度分 布所得的空间图像称为电子云。 既然以小黑点的疏密来表示概率密度大小所得的图像称为电子云,概率密度 又可以直接用财来表示 ,那么若以作图, 应得到电子云的近似图像。将w 的角度分布部分T)作图, 所得的图像就称为电子云角度分布图。电子 云的角度 分布面图与相应的原子轨道角度分布剖面图基本相似,但有两点不同: ()原子轨道角度分布图带有正、负号,而电子云角度分布图均为正值(习惯 不标出正号片 (2)电子云角度分布图比原子轨道角度分布图要瘦”些,这是因为Y值一般 是小于1的,所以值就更小些 从以上介绍可以看出:原子轨道和电子云的空间图像既不是通过实验、更不 是直接观察到的,而是根据量子力学计算得到的数据绘制出来的。 52-5量子数
又称为原子轨函(原子轨道函数之意),亦即波函数的空间图像就是原子轨道,原 子轨道的表示式就是波函数。为此,波函数与原子轨道常作同意语混用。 2. 原子轨道的角度分布图 将波函数 ψ的角度分布部分(Y)作图,所得的图像就称为原子轨道的角度 分布图(见图 5-4),如文字教材中的 图 5-4 实线部分所示。 5-2-4 电子云 1.概率密度 在光的波动方程中,ψ代表电磁波的电磁场强度。由于 而光的强度又与电磁场强度(ψ)的绝对值平方成正比: 光的强度 ∝ |ψ| 2 所以,光子密度是与|ψ| 2 成正比的。同理,在原子核外某处空间,电子出现的概 率密度(ρ)也是和电子波在该处的强度(ψ)的绝对值平方成正比的: ρ∝|ψ| 2 但在研究 ρ时,有实际意义的只是它在空间各处的相对密度,而不是其绝对 值本身,故作图时可不考虑 ρ与|ψ| 2之间的比例常数,因而电子在原子中核外某 处出现的概率密度可直接用|ψ| 2来表示。 为了形象地表示核外电子运动的概率分布情况,化学上惯用小黑点分布的疏 密表示电子出现概率密度的相对大小。小黑点较密的地方,表示概率密度较大, 单位体积内电子出现的机会多。用这种方法来描述电子在核外出现的概率密度分 布所得的空间图像称为电子云。 既然以小黑点的疏密来表示概率密度大小所得的图像称为电子云,概率密度 又可以直接用|ψ| 2来表示,那么若以|ψ| 2作图,应得到电子云的近似图像。将|ψ| 2 的角度分布部分(|Y| 2 )作图,所得的图像就称为电子云角度分布图。电子云的角度 分布剖面图与相应的原子轨道角度分布剖面图基本相似,但有两点不同: (1) 原子轨道角度分布图带有正、负号,而电子云角度分布图均为正值(习惯 不标出正号); (2) 电子云角度分布图比原子轨道角度分布图要“瘦”些,这是因为 Y 值一般 是小于 1 的,所以|Y| 2值就更小些。 从以上介绍可以看出:原子轨道和电子云的空间图像既不是通过实验、更不 是直接观察到的,而是根据量子力学计算得到的数据绘制出来的。 5-2-5 量子数

欲描述某海轮在茫茫大海中的位置,只要知道该海轮的经度和纬度就足够 了。但是描述原子中各电子的状态(指电子所在的电子层和原子轨道的能级、形 ,以及电子的自旋方向等侧需要四个参数(主量子数、副量子数、 1.主量子数(n): 主量子数0m)可为零以外的正整数。例如n=1,2,3,4.等。其中每一个n值代 表一个电子层: 主量子数(n: 1 2 3 5 电子层: 第一层第二层第三层第四层第五层 电子层符号: K L M N 0 n值越小,各电子层离核越近,其能级越低。 2.副量子数(0 n值确定后,副量子数(0可为零到(n-1)的正整数。例如1=0,1,2.(n-1)。 其中每一个1值代表一个电子亚层: 副量子数(): 012345 电子亚层符号: s p d f g h 对于多电子原子来说,同 电子层中的1值越小,该电子亚层的能级越低。例如 2s亚层的能级比2p亚层的低。 3.磁量子数(m) 磁量子数m)的取值决定于1值:可取(241)个从-1到+1(包括零在内)的整 数。每一个m值代表一个具有某种空间取向的原子轨道。例如副量子数(0为1 时,磁量子数(m)值只能取-1,0,+1三个数值,这三个数值表示p亚层上的三 个相互垂直的p原子轨道。 4.自旋量子数(m) 自旋量子数m)只有+12或一1/2这两个数值,其中每一个数值表示电子的 一种自旋方向(如顺时针或逆时针方向)。 例如,在原子核外第四电子层上4s亚层的4s轨道内,以顺时针方向自旋 为特征的那个电子的的运动状态,可以用4、0、m=0、m,=+12四个量子数 来描述
欲描述某海轮在茫茫大海中的位置,只要知道该海轮的经度和纬度就足够 了。但是描述原子中各电子的状态(指电子所在的电子层和原子轨道的能级、形 状、伸展方向,以及电子的自旋方向等)则需要四个参数(主量子数、副量子数、 磁量子数和自旋量子数)才行。 1.主量子数(n): 主量子数(n)可为零以外的正整数。例如 n =1,2,3,4.等。其中每一个 n 值代 表一个电子层: 主量子数(n): 1 2 3 4 5 . 电子层: 第一层 第二层 第三层 第四层 第五层 电子层符号: K L M N O n 值越小,各电子层离核越近,其能级越低。 2.副量子数(l) n 值确定后,副量子数(l)可为零到(n-1)的正整数。例如 l=0,1,2.(n-1)。 其中每一个 l 值代表一个电子亚层: 副量子数(l): 0 1 2 3 4 5 电子亚层符号: s p d f g h 对于多电子原子来说,同一电子层中的 l 值越小,该电子亚层的能级越低。例如 2s 亚层的能级比 2p 亚层的低。 3. 磁量子数(m) 磁量子数(m)的取值决定于 l 值;可取(2l+1)个从-l 到+l(包括零在内)的整 数。每一个 m 值代表一个具有某种空间取向的原子轨道。例如副量子数(l)为 1 时 ,磁量子数(m)值只能取 -1,0,+1 三个数值,这三个数值表示 p 亚层上的三 个相互垂直的 p 原子轨道。 4.自旋量子数(ms) 自旋量子数(ms )只有+1/2 或一 1/2 这两个数值,其中每一个数值表示电子的 一种自旋方向(如顺时针或逆时针方向)。 例如,在原子核外第四电子层上 4s 亚层的 4s 轨道内,以顺时针方向自旋 为特征的那个电子的的运动状态,可以用 n=4、l=0、m=0、ms=+1/2 四个量子数 来描述

53原子中电子的分布 53-1基态原子中电子分布原理 根据原子光谱实验的结果和对元素周期系的分析、归纳,总结出核外电子分 布的基本原理。 L.泡利(Pauli)不相容原理 在同一原子中,不可能有四个量子数完全相同的电子存在。每一个轨道内最 多只能容纳两个自旋方向相反的电子。 2.能量最低原理 多电子原子处在基态时,核外电子的分布在不违反泡利原理的前提下,总是 尽先分布在能量较低的轨道,以使原子处于能量最低的状态。 3.洪特Hund规则 原子在同一亚层的等价轨道上分布电子时,将尽可能单独分布在不同的轨 道,而且自旋方向相同(或称自旋平行)。这样分布时,原子的能量较低,体系较 稳定。例如:N原子外层(2s22p3)的轨道表示式为: 0000 那么,哪些轨道能量较高,哪些轨道能量较低呢?这需要进一步了解原子 的能级 ①圆圈中每一个箭号代表一个电子,箭头方向相同的表示电子自旋方向相同。 53-2多电子原子轨道的能级 原子轨道的能量主要与主量子数()有关。对多电子原子(除H外其它元素 原子的统称)来说,原子轨道的能量还与副量子数()和原子序数有关。 原子中各原子轨道能级的高低主要根据光谱实验确定,但也可从理论上去推 算。原子轨道能级的相对高低情况,若用图示法近似表示,就是所谓近似能级图。 在无机化学中比较实用的是鲍林(Pauling)近似能级图。 某元素只要根据其原子光谱中的谱线所对应的能量,就可以作出该元素原子 的原子轨道能级图 ,1939年鲍林L.Pauling.图5-5) )对周期系中各元素原子的 原子轨道能级图进行分析、归纳,总结出多电子原子中原子轨道能级图,以表示 各原子轨道之间能量的相同高低顺序(见图5-6)
5-3 原子中电子的分布 5-3-1 基态原子中电子分布原理 根据原子光谱实验的结果和对元素周期系的分析、归纳,总结出核外电子分 布的基本原理。 1. 泡利(Pauli)不相容原理 在同一原子中,不可能有四个量子数完全相同的电子存在。每一个轨道内最 多只能容纳两个自旋方向相反的电子。 2. 能量最低原理 多电子原子处在基态时,核外电子的分布在不违反泡利原理的前提下,总是 尽先分布在能量较低的轨道,以使原子处于能量最低的状态。 3. 洪特(Hund)规则 原子在同一亚层的等价轨道上分布电子时,将尽可能单独分布在不同的轨 道,而且自旋方向相同(或称自旋平行)。这样分布时,原子的能量较低,体系较 稳定。例如:N 原子外层(2s2 2p3)的轨道表示式①为: 那么,哪些轨道能量较高,哪些轨道能量较低呢? 这需要进一步了解原子 的能级。 ① 圆圈中每一个箭号代表一个电子,箭头方向相同的表示电子自旋方向相同。 5-3-2 多电子原子轨道的能级 原子轨道的能量主要与主量子数(n)有关。对多电子原子(除 H 外其它元素 原子的统称)来说,原子轨道的能量还与副量子数(l)和原子序数有关。 原子中各原子轨道能级的高低主要根据光谱实验确定,但也可从理论上去推 算。原子轨道能级的相对高低情况,若用图示法近似表示,就是所谓近似能级图。 在无机化学中比较实用的是鲍林( Pauling )近似能级图。 某元素只要根据其原子光谱中的谱线所对应的能量,就可以作出该元素原子 的原子轨道能级图。1939 年鲍林(L.Pauling,图 5-5))对周期系中各元素原子的 原子轨道能级图进行分析、归纳,总结出多电子原子中原子轨道能级图,以表示 各原子轨道之间能量的相同高低顺序(见图 5-6)
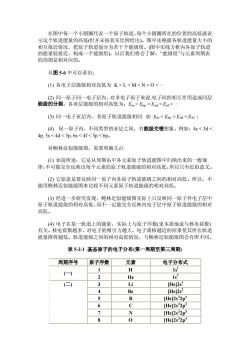
在图中每一个小圆圈代表一个原子轨道。每个小圆圈所在的位置的高低就表 示这个轨道能量的高低(但并未按真实比例绘出)。图中还根据各轨道能量大小的 相互接近情况,把原子轨道划分为若干个能级到 (图中实线方 框内各原 子轨道 的能量较接近,构成一个能级组)。以后我们将会了解:“能级组”与元素周期表 的周期是相对应的。 从图5-6中可以看出: (1)各电子层能级相对高低为K<L<M<N<O< (3)同一电子亚层内,各原子轨道能级相同:如Es<Ep<Ed<Er: (4)同一原子内,不同类型的亚层之间,有能级交错想象。例如:4s<3 4p,5s<4d<5p,6s<4f<5p<6p 对鲍林近似能级图,需要明确几点: (1)如前所述,它是从周期条中各元素原子轨道能图中归纳出来的一般规 律,不可能完全反映出每个元素的原子轨道能级的相对高低,所以只有近似意义。 (2)它原意是要反映 一原子内各原子轨道能级之间的相对高低。所以,不 能用鲍林近似能级图来比较不同元素原子轨道能级的相对高低。 (3)经进一步研究发现,鲍林近似能级图实际上只反映同一原子外电子层中 原子轨道能级的相对高低,而不一定能完全反映内电子层中原子轨道能级的相对 高低。 ,实际上与原子序数(更本质地说与核电荷数 能量降得越低。轨道能级之间的相对高低情况,与鲍林近似能级图会有所不同。 表52-1基态原子的电子分布(第一周期至第三周期 周期序号原子序数 元素 电子分布式 H (一) s He 1g2 3 Li [He]2s 4 Be [Hej2s? B [He]2s22p' [He]2s22p 7 N [Hel2s22p 8 [He]2s22p
在图中每一个小圆圈代表一个原子轨道。每个小圆圈所在的位置的高低就表 示这个轨道能量的高低(但并未按真实比例绘出)。图中还根据各轨道能量大小的 相互接近情况,把原子轨道划分为若干个能级组。(图中实线方框内各原子轨道 的能量较接近,构成一个能级组)。以后我们将会了解:“能级组”与元素周期表 的周期是相对应的。 从图 5-6 中可以看出: (1) 各电子层能级相对高低为 K < L < M < N < O < ··· (2) 同一原子同一电子层内,对多电子原子来说,电子间的相互作用造成同层 能级的分裂。各亚层能级的相对高低为:Ens < Enp < End < Enf < ··· (3) 同一电子亚层内,各原子轨道能级相同: 如 Ens < Enp < End < Enf ; (4) 同一原子内,不同类型的亚层之间,有能级交错想象。例如:4s < 3d < 4p, 5s < 4d < 5p, 6s < 4f < 5p < 6p。 对鲍林近似能级图,需要明确几点: (1) 如前所述,它是从周期糸中各元素原子轨道能图中归纳出来的一般规 律,不可能完全反映出每个元素的原子轨道能级的相对高低,所以只有近似意义。 (2) 它原意是要反映同一原子内各原子轨道能级之间的相对高低。所以,不 能用鲍林近似能级图来比较不同元素原子轨道能级的相对高低。 (3) 经进一步研究发现,鲍林近似能级图实际上只反映同一原子外电子层中 原子轨道能级的相对高低,而不一定能完全反映内电子层中原子轨道能级的相对 高低。 (4) 电子在某一轨道上的能量,实际上与原子序数(更本质地说与核电荷数) 有关。核电荷数越多,对电子的吸引力越大,电子离核越近的结果使其所在轨道 能量降得越低。轨道能级之间的相对高低情况,与鲍林近似能级图会有所不同。 表 5-2-1 基态原子的电子分布(第一周期至第三周期) 周期序号 原子序数 元素 电子分布式 1 H 1sl (一) 2 He 1s2 3 Li [He]2s1 4 Be [He]2s2 5 B [He]2s2 2p 1 6 C [He]2s2 2p2 7 N [He]2s2 2p3 (二) 8 O [He]2s2 2p4

9 F [He]2s22p5 0 Ne Hel2s 2p 11 Na [Nej3s 12 Mg [Nel3s 13 A1 [Nel3s'3p ( Si INe]3s3p 15 P [Ne]3s 3p INe]3s'3p CI [Ne]3s 3p 18 Ar [Ne]3s3p5 表5-2-2基态原子的电子分布(第四周期) 周期序号 原子序数 元素 电子分布式 19 K [Ar]4s' 20 Ca Ar]4 21 Sc [Ar]3d'4s2 22 Ti IArl3d24s2 23 24 Cr [Arl3d24s 25 Mn [Ar)3d4s 26 Fe [Ar)3d4s 27 IAr)3d4s (四) Co 28 Ni [Ar)3d'4s 29 Cu Ar]3d104s 30 Zn [Ar)3d14S2 31 Ga [Ar]3d145 4p 32 Ce [Arl3d104s 4p2 33 As [Ar]3d4s 4p 34 Se [Ar]3d434p 35 Br 36 Kr IArl3d4s4p 表5-2-3基态原子的电子分布(第五周期 周期序号 原子序数 元素 电子分布式 (五) 37 Rb [Kr]5s 38 Sr [Kr]5s2 [Kr]4d'5s 40 Zr [Kr)4d25s 41 Nb Krl4d'5✉
9 F [He]2s2 2p5 10 Ne [He]2s2 2p6 11 Na [Ne]3s1 12 Mg [Ne]3s2 13 A1 [Ne]3s2 3p1 14 Si [Ne]3s2 3p2 15 P [Ne]3s2 3p3 16 S [Ne]3s2 3p4 17 Cl [Ne]3s2 3p5 (三) 18 Ar [Ne]3s2 3p6 表 5-2-2 基态原子的电子分布(第四周期) 周期序号 原子序数 元素 电子分布式 19 K [Ar]4s1 20 Ca [Ar]4s2 21 Sc [Ar]3d1 4s2 22 Ti [Ar]3d2 4s2 23 V [Ar]3d3 4s2 24 Cr [Ar]3d5 4s1 25 Mn [Ar)3d5 4s2 26 Fe [Ar)3d6 4s2 27 Co [Ar)3d7 4s2 28 Ni [Ar)3d8 4s2 29 Cu [Ar]3d104s1 30 Zn [Ar)3d104S2 31 Ga [Ar]3d104s2 4p1 32 Ce [Ar]3d104s2 4p2 33 As [Ar]3d104s2 4p3 34 Se [Ar]3d104s2 4p4 35 Br [Ar]3dl04s2 4p5 (四) 36 Kr [Ar]3d104s2 4p6 表 5-2-3 基态原子的电子分布(第五周期) 周期序号 原子序数 元素 电子分布式 37 Rb [Kr]5s1 38 Sr [Kr]5s2 39 Y [Kr]4d1 5s2 40 Zr [Kr)4d2 5s2 (五) 41 Nb [Kr]4d4 5sl
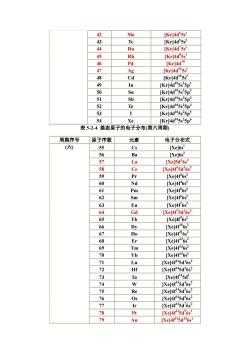
42 Mo [KrJ4d55s Te [Kr]4d5s 44 Ru IKrl4d'5s Rh [Krl4d'5s 46 Pd [Kr]4d" g Cd [Kr]4d5s 49 In IKrl4d15s25p 50 Kr4d"ss'5p 51 b [Kr]4d105s25p 52 [Kr]4d105s25p [Kr]4d105s25p 54 Xe [Kr]4d105s25p6 表5-2-4基态原子的电子分布(第六周期 周期序号 原子序数 元素 电子分布式 六) 55 C [Xe]6s' 56 [Xe]6s2 La [Xe]5d'6s2 58 Ce [Xe]4r'sd'6s2 59 60 Nd [Xej4r6s Pm [Xe]4F6s2 62 Sm [Xej4r6s 63 Eu IXel4f6s2 [Xe]4f5d'6s2 5 Tb [Xe]4f6s2 66 [Xe]4f6s 67 o [Xel4r6s 68 Er [Xel4r26s 69 Tm 70 Yb [Xel4f46s 71 [Xe]4f145d'6s2 72 Hf 73 Ta IXel4f5d 74 75 Re [Xe]4f5d6s7 76 77 78 [Xe]4r5d'6s 70 Au [Xe]
42 Mo [Kr]4d5 5s1 43 Tc [Kr]4d5 5s2 44 Ru [Kr]4d7 5s1 45 Rh [Kr]4d8 5sl 46 Pd [Kr]4d10 47 Ag [Kr]4d105s1 48 Cd [Kr]4d105s2 49 In [Kr]4d105s2 5p1 50 Sn [Kr]4d105s2 5p2 51 Sb [Kr]4d105s2 5p3 52 Te [Kr]4d105s2 5p4 53 I [Kr]4d105s2 5p5 54 Xe [Kr]4d105s2 5p6 表 5-2-4 基态原子的电子分布(第六周期) 周期序号 原子序数 元素 电子分布式 55 Cs [Xe]6s1 56 Ba [Xe]6s2 57 La [Xe]5d1 6s2 58 Ce [Xe]4f1 5d1 6s2 59 Pr [Xe]4f3 6s2 60 Nd [Xe]4f4 6s2 61 Pm [Xe]4f5 6s2 62 Sm [Xe]4f6 6s2 63 Eu [Xe]4f7 6s2 64 Gd [Xe]4f7 5d1 6s2 65 Tb [Xe]4f 9 6s2 66 Dy [Xe]4f106s2 67 Ho [Xe]4f116s2 68 Er [Xe]4f126s2 69 Tm [Xe]4f136s2 70 Yb [Xe]4f146s2 71 Lu [Xe]4f145d1 6s2 72 Hf [Xe]4f145d2 6s2 73 Ta [Xe]4f145d3 74 W [Xe]4f145d4 6s2 75 Re [Xe]4f145d5 6s2 76 Os [Xe]4f145d6 6s2 77 Ir [Xe]4f145d7 6s2 78 Pt [Xe]4f145d9 6s1 (六) 79 Au [Xe]4f145d106s1
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物.pdf
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第三章 酸碱反应和沉淀反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第二章 化学反应的方向、速率和限度.pdf
- 《基础化学》课程授课教案(无机化学讲义)第一章 化学反应中的质量关系和能量关系.pdf
- 内蒙古科技大学:《基础化学》课程教学大纲 Basic Chemistry(负责人:李国祥).pdf
- 《物理化学》课程教学资源(名词术语)物理化学专业术语中英文对照表.pdf
- 《物理化学》课程教学资源(习题解答)第1章 气体.doc
- 《物理化学》课程教学资源(习题解答)第2章 热力学第一定律.doc
- 《物理化学》课程教学资源(习题解答)第3章 热力学第二定律.doc
- 《物理化学》课程教学资源(习题解答)第4章 多组分系统热力学及其在溶液中的应用.doc
- 《物理化学》课程教学资源(习题解答)第5章 相平衡.doc
- 《物理化学》课程教学资源(习题解答)第6章 化学平衡.doc
- 《物理化学》课程各章习题(含参考答案)第八章.pdf
- 《物理化学》课程各章习题(含参考答案)第九章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程各章习题(含参考答案)第十章.pdf
- 《物理化学》课程教学资源(习题解答)第11章 化学动力学基础(一).doc
- 《物理化学》课程各章习题(含参考答案)第十二章习题详解.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
