《基础化学》课程授课教案(无机化学讲义)第八章 配位化合物

第八章配位化合物 8-1配合物的基本概念 81-1配合物的组成 向硫酸铜溶液中滴加氨水,开始有蓝色的碱式硫酸铜沉淀Cu,(OH2S0,生 成。当氨水过量时,蓝色沉淀消失,变成深蓝色的溶液。往该深蓝色溶液中加入 乙醇,立即有深蓝色晶体析出。通过化学分析确定其组成为CuSO44 NH:H2O。 利用X射线结构分析技术确知晶体中四个NH与一个Cu+互相结合,形成复杂 离子CuNH)42+。这类复杂离子称为配离子。由配离子形成的配合物,如 ICu(NH):JSO 4和KPCN是由内界和外界两部分组成的。内界为配合物的特 征部分,是中心离子和配体之间通过配位键结合而成的 一个相当稳定的整体,在 配合物化学式中以方括号标明。方括号外的离子,离中心较远,构成外界。内界 与外界之间以离子键结合。 ICu(NHs)JSO K[Fe(CN)6l 内界 外界 外界 内界 [Cu(NH3) S02 (K)4 [Fe(CN)6 中心离子 配体 中心离子 配休 Cu2 (NHa) Fe (CN) 配位原子L配位数 配位原子刊'L配位数 有些配合物不存在外界,如PtC2(NH2l、[CoC13NH3等。另外,有些配 合物是由中心原子与配体构成,如Ni(CO4小、Fe(CO)]等。 1.形成体 中心高子或中心原子统称为配合物的形成体。中心离子绝大多数是带正电荷 的阳离子,其中以过渡金属离子居多,如Fe、Cu2、Co、Ag等;少数高氧 化态的非金属元素也可作中心离子,如BF4、S证62中的B(、SiV)等。中心 原子如Ni(CO))、Fe(CO)sl中的Ni、Fe原子. 2.配位个体 配位体及配位原子 由形成体结 定数 目的 位体所形成的结构单元称为配位个体,如 [CuNH)42+、Ni(CO)]等。凡含有配位个体的化合物统称为配合物。在配合物 中与形成体结合的离子或中性分子称为配位体,简称配体,如[CuNH)4中的 NH3、F(CN)J中的CN等。在配体中提供孤对电子与形成体形成配位键的原 子称为配位原子,如配体NH中的N。常见的配位原子为电负性较大的非金属 原子N、 C和卤素等 根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配 体。 单齿配体:一个配体中只有一个配位原子,如NH,OH,X,CN,SCN 等。 ①SCN中含有S和N两个不同的配位原子,在形成配合物时,只有一个 配位原子与形成体结合。如在Fe(NCS)+中,N作配位原子,在Ag(SCN2中
第八章 配位化合物 8-1 配合物的基本概念 8-1-1 配合物的组成 向硫酸铜溶液中滴加氨水,开始有蓝色的碱式硫酸铜沉淀 Cu2(OH)2SO4生 成。当氨水过量时,蓝色沉淀消失,变成深蓝色的溶液。往该深蓝色溶液中加入 乙醇,立即有深蓝色晶体析出。通过化学分析确定其组成为 CuSO4·4NH3·H2O。 利用 X 射线结构分析技术确知晶体中四个 NH3 与一个 Cu2+互相结合,形成复杂 离子[Cu(NH3)4] 2+。这类复杂离子称为配离子。由配离子形成的配合物,如 [Cu(NH3)4]SO4和 K4[Fe(CN)6]是由内界和外界两部分组成的。内界为配合物的特 征部分,是中心离子和配体之间通过配位键结合而成的一个相当稳定的整体,在 配合物化学式中以方括号标明。方括号外的离子,离中心较远,构成外界。内界 与外界之间以离子键结合。 [Cu(NH3)4]SO4 K4[Fe(CN)6] ┌──┴ ──┐ ┌──┴ ──┐ 内界 外界 外界 内界 [Cu(NH3)4] 2+ SO4 2- (K+ )4 [Fe(CN)6] 4- ┌──┴ ──┐ ┌──┴ ──┐ 中心离子 配体 中心离子 配体 Cu2+ (NH3)4 Fe3+ (CN - )6 ↑ ↑ ↑ ↑ 配位原子┘ └配位数 配位原子┘ └配位数 有些配合物不存在外界,如[PtCl2(NH3)2]、[CoCl3(NH3)3]等。另外,有些配 合物是由中心原子与配体构成,如[Ni(CO)4]、[Fe(CO)5]等。 1.形成体 中心离子或中心原子统称为配合物的形成体。中心离子绝大多数是带正电荷 的阳离子,其中以过渡金属离子居多,如 Fe3+、Cu2+、Co2+、Ag+等;少数高氧 化态的非金属元素也可作中心离子,如 BF4 -、SiF6 2-中的 B(Ⅲ)、Si(Ⅳ)等。中心 原子如[Ni(CO)4)、[Fe(CO)5]中的 Ni、Fe 原子。 2. 配位个体、配位体及配位原子 由形成体结合一定数目的配位体所形成的结构单元称为配位个体,如 [Cu(NH3)4] 2+ 、[Ni(CO)4]等。凡含有配位个体的化合物统称为配合物。在配合物 中与形成体结合的离子或中性分子称为配位体,简称配体,如[Cu(NH3)4] 2+中的 NH3、[Fe(CN)6] 3-中的 CN-等。在配体中提供孤对电子与形成体形成配位键的原 子称为配位原子,如配体 NH3中的 N。常见的配位原子为电负性较大的非金属 原子 N、O、S、C 和卤素等原子。 根据一个配体中所含配位原子数目的不同,可将配体分为单齿配体和多齿配 体。 单齿配体:一个配体中只有一个配位原子,如 NH3,OH-,X -,CN-,SCN-① 等。 ① SCN-中含有 S 和 N 两个不同的配位原子,在形成配合物时,只有一个 配位原子与形成体结合。如在[Fe(NCS)]2+ 中,N 作配位原子,在[Ag(SCN)2] -中
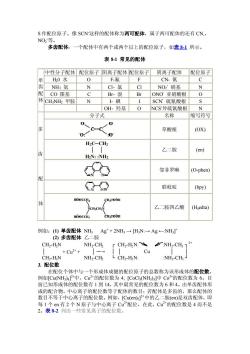
S作配位原子。像SCN这样的配体称为两可配体,属于两可配体的还有CN, NO2等。 多齿配体: 个配体中有两个或两个以上的配位原子,如表8所示。 表81常见的配体 ■中性分子配体配位原子阴离子配体配位原子阴离子配体配位原子 0水 0 F-氟 F CN.氰 齿NH;氨 N C1-氨 CI NO”酯基 N 配CO器共 Br-溴 Br ONO亚硝酸根 0 体CHNH,甲胺 SCN硫氰酸根 OH.羟基 0 NCS异硫氰酸根 N 分子式 名称 缩写符号 草酸根 (OX) 0 0 H2C-CH2 乙二胺 (en) H2N::NH2 P 邻菲罗啉 (O-phen) D 联吡啶 (bpy) 乙二胺四乙酸(Hjedta) nioccit: CCOUH 例如:()单齿配体NH,Ag+2NH→HN:一Ag←-NH (2)多齿配体乙二胺 CH2-HN NH2-CH rCH2-H2N: NH2-CH;12 +Cu2++ Cu CH2-HN NH,-CH, L CH2-H2N: NH2-CH; 3.配位数 在配位个体中与一个形成体成键的配位原子的总数称为该形成体的配位数 例如[CuNH中 Cu2的配位数为4,[CoCl(NH)]叫 Co 的配6 数为6 前己知形成体的配位数有1到14,其中最常见的配位数为6和4。由单齿配体形 成的配合物,中心离子的配位数等于配体的数目:若配体是多齿的,那么配体的 数目不等于中心离子的配位数。例如,[Cu(en22+中的乙二胺(en)是双齿配体,即 每1个en有2个N原子与中心离子Cu2配位,在此,Cu2的配位数是4而不是 2。表8-2列出一些常见离子的配位数
S 作配位原子。像 SCN-这样的配体称为两可配体,属于两可配体的还有 CN-, NO2 -等。 多齿配体:一个配体中有两个或两个以上的配位原子,如表 8-1 所示。 表 8-1 常见的配体 中性分子配体 配位原子 阴离子配体 配位原子 阴离子配体 配位原子 H20 水 O F-氟 F CN- 氰 C NH3 氨 N Cl- 氯 Cl NO2 - 硝基 N CO 羰基 C Br- 溴 Br ONO- 亚硝酸根 O CH3NH2 甲胺 N I- 碘 I SCN- 硫氰酸根 S 单 齿 配 体 OH- 羟基 O NCS-异硫氰酸根 N 分子式 名称 缩写符号 草酸根 (OX) H2C─CH2 │ │ H2N: :NH2 乙二胺 (en) 邻菲罗啉 (O-phen) 联吡啶 (bpy) 多 齿 配 体 乙二胺四乙酸 (H4edta) 例如:(1) 单齿配体 NH3 Ag+ + 2NH3 → [H3N:→ Ag ← :NH3] + (2) 多齿配体 乙二胺 CH2-H2N │ CH2-H2N + Cu2+ + NH2-CH2 │ ─→ NH2-CH2 ┌ │ └ CH2-H2N: :NH2-CH3 │ Cu │ CH2-H2N: :NH2-CH3 ┐ 2+ │ ┘ 3. 配位数 在配位个体中与一个形成体成键的配位原子的总数称为该形成体的配位数。 例如[Cu(NH3)4] 2+中,Cu2+的配位数为 4; [CoCl3(NH3)3]中 Co3+的配位数为 6。目 前已知形成体的配位数有 1 到 14,其中最常见的配位数为 6 和 4。由单齿配体形 成的配合物,中心离子的配位数等于配体的数目;若配体是多齿的,那么配体的 数目不等于中心离子的配位数。例如,[Cu(en)2] 2+中的乙二胺(en)是双齿配体,即 每 1 个 en 有 2 个 N 原子与中心离子 Cu2+配位,在此,Cu2+的配位数是 4 而不是 2。表 8-2 列出一些常见离子的配位数
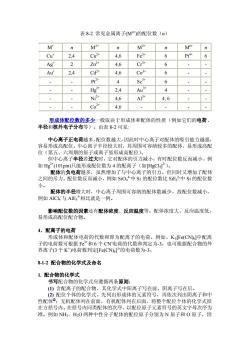
表8-2常见金属离子M的配位数(n) M M2+ n M n M n Cu" 2,4 Cu2 4,6 P+ 6 Ag' 2 7n2+ 4.6 Cr3升 6 Au 2.4 Cd2+ 4.6 Co 6 P2 4 Sc 6 Hg? 2.4 Au 4 4,6 46 4,6 形成体配位数的多少一般取决于形成体和配体的性质(例如它们的电荷、 半径和核外电子分布等)。由表8-2可见: 心离子正电荷越多,配位数越大,因此时中心离子对配体的吸引能力越强 容易 高面 心离子半径较大时 其周围可容纳较多的配体, 易形成高配 位(第五、六周 原 子或离子易形成高配位) 但中心离子半径若过大时,它对配体的引力减小,有时配位数反而减小,例 如Hg2*(101pm)只能形成配位数为4的配离子(如HgC14子)。 配体的负电荷越多,虽然增加了与中心离子的引力,但同时又增加了配体 之间的斥力,配位数反而减小,例如SO,+中Si的配位数比SiF。中Si的配位数 小。 配体的半径增大时,中心离子周围可容纳的配体数减少,故配位数减小, 例如AIC与AIF。相比就是一例。 影响配位数的因素还有配体浓度、反应温度等。配体浓度大、反应温度低, 易形成高配位配合物。 4.配离子的电荷 形成体和配体电荷的代数和即为配离子的电荷。例如,KF©(CN)中配离 子的电荷数可根据Fe和6个CN电荷的代数和判定为-3,也可根据配合物的外 界离子(3个K)电荷数判定Fe(CN6产的电荷数为-3。 812配合物的化学式及命名 1.配合物的化学式 书写配合物的化学式应遵循两条原则: ()含配离子的配合物,其化学式中阳离子写在前,阴离子写在后。 (2)配位个体的化学式,先列出形成体的元素符号,再依次列出阴离子和中 性配体@:无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括 在方括号内。在括号内同类配体的次序,以配位原子元素符号的英文字母次序为 准。例如NH、HO两种中性分子配体的配位原子分别为N原子和O原子,因
表 8-2 常见金属离子(Mn+)的配位数(n) M+ n M2+ n M3+ n M4+ n Cu+ 2,4 Cu2+ 4,6 Fe3+ 6 Pt4+ 6 Ag+ 2 Zn2+ 4,6 Cr3+ 6 - - Au+ 2,4 Cd2+ 4,6 Co3+ 6 - - - - Pt2+ 4 Sc3+ 6 - - - - Hg2+ 2,4 Au3+ 4 - - - - Ni2+ 4,6 Al3+ 4, 6 - - - - Co2+ 4,6 - - - - 形成体配位数的多少一般取决于形成体和配体的性质(例如它们的电荷、 半径和核外电子分布等)。由表 8-2 可见: 中心离子正电荷越多,配位数越大,因此时中心离子对配体的吸引能力越强, 容易形成高配位。中心离子半径较大时,其周围可容纳较多的配体,易形成高配 位(第五、六周期的原子或离子易形成高配位)。 但中心离子半径若过大时,它对配体的引力减小,有时配位数反而减小,例 如 Hg2+(101pm)只能形成配位数为 4 的配离子(如[HgCl4] 2-)。 配体的负电荷越多,虽然增加了与中心离子的引力,但同时又增加了配体 之间的斥力,配位数反而减小,例如 SiO4 4-中Si 的配位数比 SiF6 2-中 Si 的配位数 小。 配体的半径增大时,中心离子周围可容纳的配体数减少,故配位数减小, 例如 AlCl4 -与 AlF6 3-相比就是一例。 影响配位数的因素还有配体浓度、反应温度等。配体浓度大、反应温度低, 易形成高配位配合物。 4.配离子的电荷 形成体和配体电荷的代数和即为配离子的电荷。例如,K3[Fe(CN)6]中配离 子的电荷数可根据 Fe3+和 6 个 CN-电荷的代数和判定为-3,也可根据配合物的外 界离子(3 个 K + )电荷数判定[Fe(CN)6] 3-的电荷数为-3。 8-1-2 配合物的化学式及命名 1. 配合物的化学式 书写配合物的化学式应遵循两条原则: (1) 含配离子的配合物,其化学式中阳离子写在前,阴离子写在后。 (2) 配位个体的化学式,先列出形成体的元素符号,再依次列出阴离子和中 性配体① ;无机配体列在前面,有机配体列在后面,将整个配位个体的化学式括 在方括号内。在括号内同类配体的次序,以配位原子元素符号的英文字母次序为 准。例如 NH3、H2O 两种中性分子配体的配位原子分别为 N 原子和 O 原子,因
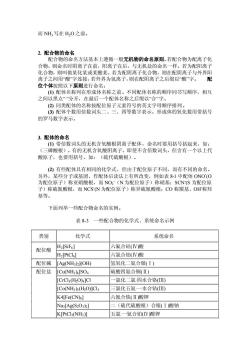
而NH写在H,O之前 2.配合物的命名 配合物的命名方法基本上遵循一般无机物的命名原则,若配合物为配离子化 合物,则命名时阴离子在前,阳离子在后,与无机盐的命名一样。若为配阳离子 化合物,则叫做某化某或某酸某。若为配阴离子化合物,则在配阴离子与外界阳 离子之间用“酸字连接,若外界为氢离子,则在配阴离子之后缀以“酸字。 配 位个体按照以下原则进行 ()配体名称列在形成体名称之前。不同配体名称的顺序同书写顺序,相互 之间以黑点“”分开,在最后一个配体名称之后缀以“合”字。 2)同类配体的名称按配位原子元素符号的英文字母顺序排列。 3)配体个数用倍数词头二、三、四等数字表示。形成体的氧化数用带括号 的罗马数字表示。 3.配体的命名 ()带倍数词头的无机含氧酸根阴离子配体,命名时要用括号括起来,如: (三磷酸根)。有的无机含氧酸阴离子,即使不含倍数词头,但含有一个以上代 酸原子,也要用括号,如: (硫代硫酸根) 2)有些配体具有相同的化学式,但由于配位原子不同,而有不同的命名 另外 某些分子或基团,作配体后读法上有所改变,例如表81中配体OO(O 为配位原子)称亚硝酸根,而NO2(N为配位原子)称硝基:SCN(S为配位房 子)称硫氰酸根,而NCSN为配位原子)称异硫氰酸根:CO称羰基、OH称羟 基等。 下面列举一些配合物命名的实例。 表8-3 一些配合物的化学式、系统命名示例 类别 化学式 系统命名 配位酸 H2[Si证6] 六氟合硅(V)酸 HPtCkI 六氯合铂(V)酸 配位碱[AgNH](O用 氢氧化二氨合银(I) 配位盐 [Cu(NH3)]SOa 硫酸四氨合铜(Ⅱ) [CrCls(H2O)4]CI 一氯化二氯四水合铬) [Co(NH3)(H2O)]CI3 三氯化五氨一水合钴() K4[Fe(CN)6] 六氧合铁(酸钾 Nas[Ag(S203)2] 二(硫代硫酸根)合银(I酸钠 K[PtCls(NH】 五氯一氨合铂(V)酸钾
而 NH3写在 H2O 之前。 2. 配合物的命名 配合物的命名方法基本上遵循一般无机物的命名原则。若配合物为配离子化 合物,则命名时阴离子在前,阳离子在后,与无机盐的命名一样。若为配阳离子 化合物,则叫做某化某或某酸某。若为配阴离子化合物,则在配阴离子与外界阳 离子之间用“酸”字连接,若外界为氢离子,则在配阴离子之后缀以“酸”字。 配 位个体按照以下原则进行命名: (1) 配体名称列在形成体名称之前。不同配体名称的顺序同书写顺序,相互 之间以黑点“·”分开,在最后一个配体名称之后缀以“合”字。 (2) 同类配体的名称按配位原子元素符号的英文字母顺序排列。 (3) 配体个数用倍数词头二、三、四等数字表示。形成体的氧化数用带括号 的罗马数字表示。 3. 配体的命名 (1) 带倍数词头的无机含氧酸根阴离子配体,命名时要用括号括起来,如: (三磷酸根)。有的无机含氧酸阴离子,即使不含倍数词头,但含有一个以上代 酸原子,也要用括号,如:(硫代硫酸根)。 (2) 有些配体具有相同的化学式,但由于配位原子不同,而有不同的命名。 另外,某些分子或基团,作配体后读法上有所改变,例如表 8-1 中配体 ONO- (O 为配位原子)称亚硝酸根,而 NO2 -(N 为配位原子)称硝基;SCN- (S 为配位原 子)称硫氰酸根,而 NCS- (N 为配位原子)称异硫氰酸根;CO 称羰基、OH-称羟 基等。 下面列举一些配合物命名的实例。 表 8-3 一些配合物的化学式、系统命名示例 类别 化学式 系统命名 H2[SiF6] 六氟合硅(Ⅳ)酸 配位酸 H2[PtCl6] 六氯合铂(Ⅳ)酸 配位碱 [Ag(NH3)2](OH) 氢氧化二氨合银(Ⅰ) [Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ) [CrCl3(H2O)4]Cl 一氯化二氯·四水合铬(Ⅲ) [Co(NH3)5(H2O)]Cl3 三氯化五氨·一水合钴(Ⅲ) K4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 Na3[Ag(S2O3)2] 二(硫代硫酸根)合银(Ⅰ)酸钠 配位盐 K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾

NH4[Cr(NCS)4NH为四(异硫氰酸根)二氨合铬(Ⅲ)酸铵 Fe(CO)s] 五羰基合铁 中性分子 [PtCl4(NH3)2] 四氯二氨合铂(V) [Co(NO2(NHs)3] 三硝基三氨合钴(山 8-2 配合物的化学键理论 由于价键理论简单明了,又能解决 一些问题,如它可以解释配离子的几何构 型,形成体的配位数以及配合物的某些化学性质和磁性,所以它有一定的用途。 但是这个理论也有缺陷,它忽略了配体对形成体的作用。而且到目前为止还不能 定量地说明配合物的性质。如无法定量地说明过渡金属配离子的稳定性随中心离 子的d电子数变化而变化的事实。也不能解释配离子的吸收光谱和特征颜色(如 T(H20)6]3+为何显紫红色)此外,价键理论根据磁矩虽然可区分中心离子d4 d7构型的八面体配合物属内轨型还是外轨型,但对具有d1,d2,d3和d9构型 的中心离子所形成的配合物,因未成对电子数无论在内轨型还是外轨型配合物中 均无差别,只根据磁矩仍无法区别。 配合物是内轨型还是外轨型,主要取决于中心高子的电子构型,高子所带的 电荷和配位原子的电负性大小。 具有d 构型的离子,只能用外层轨道形成外轨型配合物: 具有d8构型的离子如N2+,P+,P2+等,在大多数情况下形成内轨型配合 物, 具有d构型的离子,既可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原 的孤电子对引力增强,利于以其内层轨道参与成键。例如 [CoNH)62+为外轨型,而[CoNH63+为内轨型。 电负性大的原子如F,O等,与电负性较小的C原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C原子作为配位原子时(如在CN中)则常形成内轨型配合物。 821配合物的价健理 近代配合物价健理论基本要点是:形成配合物时,形成体(M)的某些价层 原子轨道在配体(L)作用下进行杂化,用空的杂化轨道接受配体提供的孤对电 子,以。配位键(M←-L)的方式结合。从近代结构理论的观点来说,亦即形成 体的杂化轨道与配位原子的某个孤对电子原子轨道相互重叠,形成配位键。因 配合物是由形成体与配体以配位键结合而成的复杂化合物 1.配合物的几何构型和配位键 (1)几何构型 由于形成体的杂化轨道都具有一定的方向性,所以配合物具有一定的几何构 型,如表8-4所示。 表8-4轨道杂化类型与配位个体的几何构型
NH4[Cr(NCS)4(NH3)2] 四(异硫氰酸根)·二氨合铬(Ⅲ)酸铵 [Fe(CO)5] 五羰基合铁 中性分子 [PtCl4(NH3)2] 四氯·二氨合铂(Ⅳ) [Co(NO2)3(NH3)3] 三硝基·三氨合钴(Ⅲ) 8-2 配合物的化学键理论 由于价键理论简单明了,又能解决一些问题,如它可以解释配离子的几何构 型,形成体的配位数以及配合物的某些化学性质和磁性,所以它有一定的用途。 但是这个理论也有缺陷,它忽略了配体对形成体的作用。而且到目前为止还不能 定量地说明配合物的性质。如无法定量地说明过渡金属配离子的稳定性随中心离 子的 d 电子数变化而变化的事实。也不能解释配离子的吸收光谱和特征颜色(如 [Ti(H2O)6]3+为何显紫红色)。此外,价键理论根据磁矩虽然可区分中心离子 d4~ d7 构型的八面体配合物属内轨型还是外轨型,但对具有 d1,d2,d3 和 d9 构型 的中心离子所形成的配合物,因未成对电子数无论在内轨型还是外轨型配合物中 均无差别,只根据磁矩仍无法区别。 配合物是内轨型还是外轨型,主要取决于中心离子的电子构型,离子所带的 电荷和配位原子的电负性大小。 具有 d 10 构型的离子,只能用外层轨道形成外轨型配合物; 具有 d 8构型的离子如 Ni2+,Pt2+,Pd2+等,在大多数情况下形成内轨型配合 物; 具有 d 4~d 7 构型的离子,既可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原子的孤电子对引力增强,利于以其内层 d 轨道参与成键。例如 [Co(NH3)6] 2+为外轨型,而[Co(NH3)6] 3+为内轨型。 电负性大的原子如 F,O 等,与电负性较小的 C 原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C 原子作为配位原子时(如在 CN-中)则常形成内轨型配合物。 8-2-1 配合物的价键理论 近代配合物价键理论基本要点是:形成配合物时,形成体(M)的某些价层 原子轨道在配体(L)作用下进行杂化,用空的杂化轨道接受配体提供的孤对电 子,以 σ配位键(M← :L)的方式结合。从近代结构理论的观点来说,亦即形成 体的杂化轨道与配位原子的某个孤对电子原子轨道相互重叠,形成配位键。因 而,配合物是由形成体与配体以配位键结合而成的复杂化合物。 1. 配合物的几何构型和配位键 (1)几何构型 由于形成体的杂化轨道都具有一定的方向性,所以配合物具有一定的几何构 型,如表 8-4 所示。 表 8-4 轨道杂化类型与配位个体的几何构型
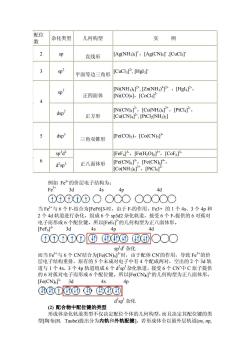
配位 杂化类型 几何构型 实例 数 2 sp 直线形 [Ag(NH3)],[Ag(CN)T ,[CuCk] 3 平面等边三角形 [CuCI3P,[HgI3] sp [Ni(NH3)4].[Zn(NH3),[HgI]2 正四面体 INi(CO)l,ICoCLT 4 dsp" [Ni(CN)4]",[Cu(NH3)4],[PtCl]", 正方形 [Cu(CN)42,[PtCl2(NH3)2] 5 dsp3 三角双锥形 [Fe(CO)s),[Co(CN)s] spd2 [FeF],[Fe(HO),[CoFB d'sp 正八面体形 [Fe(CN)],[Fe(CN], ICo(NH3)1,[PtCls12 例如Fe3+的价层电子结构为: 3d As 4d ①00①0O○○O○○○○○ 当Fer与6个F.结合为FeF63-时,由于E的作用,Fe3+的1个4s、3个4p和 2个4d轨道进行杂化,组成6个sp3d2杂化轨道,接受6个F-提供的6对孤对 电子而形成6个配位键。所以F萨的几何构型为正八面体形。 [FeFsl> 3d 4s An Ad ①①O①①DG0⑩④①○○○ spd杂化 而当FE+与6个CN结合为F(CN6子时,由于配体CN的作用,导致Fe的价 层电子结构重排,原有的5个未成对电子中有4个配成两对,空出的2个3d轨 道与1个4s、3个4D轨道组成6个dsD3杂化轨道,接受6个CN中C原子提供 的6对孤对电子而形成6个配位键。所以e(CN的几何构型为正八面体形。 [Fe(CN)] 3d 45 4p ④GXT00④G0G d2sp3杂化 (2)配合物中配位键的类型 形成体杂化轨道类型不仅决定配位个体的几何构型,而且决定其配位键的类 型[陶布(H.Taube)提出分为内轨和外轨配键]。若形成体全以最外层轨道(s,m
配位 数 杂化类型 几何构型 实 例 2 sp 直线形 [Ag(NH3)2] +,[Ag(CN)2] - ,[CuCl2] - 3 sp2 平面等边三角形 [CuCl3] 2- , [HgI3] - sp 3 正四面体 [Ni(NH3)4] 2+, [Zn(NH3) 4 ] 2+ ,[HgI4] 2-, [Ni(CO)4],[CoCl4] 2- 4 dsp 2 正方形 [Ni(CN)4] 2-,[Cu(NH3)4] 2+,[PtCl4] 2-, [Cu(CN)4] 2- , [PtCl2(NH3)2] 5 dsp3 三角双锥形 [Fe(CO)5),[Co(CN)5] 3- sp3 d 2 [FeF6] 3-,[Fe(H2O)6] 3+,[CoF6] 3- 6 d 2 sp3 正八面体形 [Fe(CN)6] 3-,[Fe(CN)6] 4-, [Co(NH3)6] 3+,[PtCl6] 2- 例如 Fe3+的价层电子结构为: Fe3+ 3d 4s 4p 4d 当 Fe3+与 6 个 F-结合为[FeF6]3-时,由于 F-的作用,Fe3+ 的 1 个 4s、3 个 4p 和 2 个 4d 轨道进行杂化,组成 6 个 sp3d2 杂化轨道,接受 6 个 F-提供的 6 对孤对 电子而形成 6 个配位键。所以[FeF6] 3-的几何构型为正八面体形。 [FeF6] 3- 3d 4s 4p 4d sp3 d 2 杂化 而当 Fe3+与 6 个 CN-结合为[Fe(CN)6] 3-时,由于配体 CN-的作用,导致 Fe3+的价 层电子结构重排,原有的 5 个未成对电子中有 4 个配成两对,空出的 2 个 3d 轨 道与 1 个 4s、3 个 4p 轨道组成 6 个 d 2 sp 3杂化轨道,接受 6 个 CN-中 C 原子提供 的 6 对孤对电子而形成 6 个配位键。所以[Fe(CN)6] 3-的几何构型为正八面体形。 [Fe(CN)6] 3- 3d 4s 4p d 2 sp 3 杂化 (2) 配合物中配位键的类型 形成体杂化轨道类型不仅决定配位个体的几何构型,而且决定其配位键的类 型[陶布(H.Taube)提出分为内轨和外轨配键]。若形成体全以最外层轨道(ns, np

d)杂化成键的,所成的配键称为外轨配键,对应的配合物称为外轨型配合物, 如FeF、NiNH)a2+等。若形成体还使用了次外层轨道[(m-I)d,s,p杂化成 键的,所成的配键称为内轨配键,对应的配合物称为内轨型配合物 ,如 [Fe(CN)6] 、[CoNH6*等。 配合物是内轨型还是外轨型与中心离子(电子构型、电荷)配位原子的性质(电 负性有关。 配合物是内轨型还是外轨型,主要取决于中心离子的电子构型,离子所带的 电荷和配位原子的电负性 只能用外层轨道形成外轨型配合物: 具有d构型的离子如Ni2+,Pt2+,P2+等,在大多数情况下形成内轨型配 合物: 具有d产d构型的离子,概可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原 的孤电子对引力增 ,利于以其内层d轨道参与成键。例如 [CoNH)为外轨型,而[CoNH%为内轨型。 电负性大的原子如F,O等,与电负性较小的C原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C原子作为配位原子时(如在CN中)则常形成内轨型配合物。 2.配合物的稳定性、磁性与键型的关系 由前面讨论可知,以spd或sp杂化轨道成键的配合物为外轨型,而以 (m-1)d2sp3或(m-1)dsp2杂化轨道成键的配合物为内轨型。对于相同中心离子,由 于sp2d2杂化轨道能量比(n-1)d2sp3杂化轨道能量高,sp3杂化轨道能量比(n-1)dsp 杂化轨道能量高,当形成相同配位数的配离子时,如FeF子和Fe(CN): NiNH)4+和Ni(CNP其稳定性是不同的 一般内轨型比外轨型稳定 价键理论不 力地说可 了面 合物的儿何构型和某些化学性质,而且也能根 据配合物中未成对电子数的多少较好地解释配合物的磁性 物质的磁性与组成物质的原子、分子或离子中电子自旋运动有关。如果物质 中正自旋电子数和反自旋电子数相等(即电子皆己成对),电子自旋所产生的藏效 应相互抵消,该物质就表现为反磁性。而当物质中正、反自旋电子数不等时(即 有成单电子 总磁效应不能互相抵消, 整个原子或分子就具有顺磁性。所以 物质的磁性强弱(用磁矩4表示 质内部未成对的电子数多少有关。根据 学理论,“与未成对电子数(n)之间存在如下关系: u=Va0+2) (磁矩的单位为波尔磁子,单位符号为BM) 据上式可估算出未成对电子数n=一5的”理论值。反之,测定配合物的 磁矩 可以了解中心离 对电 以 该配合物的磁性(>0 的具有顺磁性,0的具有反磁性),以及是内轨型还是外轨型的。 例如e中有5个未成对d电子,根据u理=a+习可估算出Fe的磁 矩理论值为: 4理=5+百=5.92B.M 实验测得[FeF6的磁矩为5.90(B.M),由表8-5可知,在FeF6中,Fe仍 保留有5个未成对电子,以sp32杂化轨道与配位原子(F)形成外轨配键,则
nd )杂化成键的,所成的配键称为外轨配键,对应的配合物称为外轨型配合物, 如[FeF6] 3-、[Ni(NH3)4] 2+等。若形成体还使用了次外层轨道[(n-1)d, ns, np]杂化成 键的,所成的配键称为内轨配键,对应的配合物称为内轨型配合物,如 [Fe(CN)6] 3-、[Co(NH3)6] 3+等。 配合物是内轨型还是外轨型与中心离子(电子构型、电荷)配位原子的性质(电 负性)有关。 配合物是内轨型还是外轨型,主要取决于中心离子的电子构型,离子所带的 电荷和配位原子的电负性大小。 具有 d 10 构型的离子,只能用外层轨道形成外轨型配合物; 具有 d 8构型的离子如 Ni2+,Pt2+,Pd2+等,在大多数情况下形成内轨型配 合物; 具有 d 4~d 7 构型的离子,既可形成内轨型,也可形成外轨型配合物。 中心离子的电荷增多有利于形成内轨型配合物。因为中心离子的电荷较多 时,它对配位原子的孤电子对引力增强,利于以其内层 d 轨道参与成键。例如 [Co(NH3)6] 2+为外轨型,而[Co(NH3)6] 3+为内轨型。 电负性大的原子如 F,O 等,与电负性较小的 C 原子比较,通常不易提供孤 电子对,它们作为配位原子时,中心离子以外层轨道与之成键,因而形成外轨型 配合物。C 原子作为配位原子时(如在 CN-中)则常形成内轨型配合物。 2. 配合物的稳定性、磁性与键型的关系 由前面讨论可知,以 sp 3 d 2或 sp 3杂化轨道成键的配合物为外轨型,而以 (n-1)d2 sp3或(n-1)dsp2杂化轨道成键的配合物为内轨型。对于相同中心离子,由 于 sp3 d 2杂化轨道能量比(n-1)d2 sp3杂化轨道能量高,sp3杂化轨道能量比(n-1)dsp2 杂化轨道能量高,当形成相同配位数的配离子时,如[FeF6] 3-和[Fe(CN)6] 3-; [Ni(NH3)4] 2+ 和[Ni(CN)4] 2-其稳定性是不同的,一般内轨型比外轨型稳定。 价键理论不仅成功地说明了配合物的几何构型和某些化学性质,而且也能根 据配合物中未成对电子数的多少较好地解释配合物的磁性。 物质的磁性与组成物质的原子、分子或离子中电子自旋运动有关。如果物质 中正自旋电子数和反自旋电子数相等(即电子皆已成对),电子自旋所产生的磁效 应相互抵消,该物质就表现为反磁性。而当物质中正、反自旋电子数不等时(即 有成单电子),总磁效应不能互相抵消,整个原子或分子就具有顺磁性。所以, 物质的磁性强弱(用磁矩 μ表示)与物质内部未成对的电子数多少有关。根据磁 学理论,μ与未成对电子数(n)之间存在如下关系: μ= (磁矩的单位为波尔磁子,单位符号为 B.M.) 根据上式可估算出未成对电子数 n =1~5 的 μ理论值。反之,测定配合物的 磁矩,也可以了解中心离子未成对电子数,从而可以确定该配合物的磁性(μ>0 的具有顺磁性,μ=0 的具有反磁性),以及是内轨型还是外轨型的。 例如 Fe3+中有 5 个未成对 d 电子,根据 μ理= 可估算出 Fe3+的磁 矩理论值为: μ理= = 5.92(B.M.) 实验测得[FeF6] 3-的磁矩为 5.90(B.M.),由表 8-5 可知,在[FeF6] 3-中,Fe3+仍 保留有 5 个未成对电子, 以 sp3d2 杂化轨道与配位原子(F)形成外轨配键,则

FeF户属外轨型,而由实验测得F(CN]的磁矩为2.0(B.M),此数值与具有 个未成对电子的磁矩理论值1.73(B.M)很接近,表明在成键过程中,中心离子的 未成对d电子数减少,d电子重新分布,腾出2个空d轨道,而以dsp杂化轨 道与配位原子(C)形成内轨配 键,所以[Fe(CN6属内轨型。 又如配位数为4的配离子NiNH)42*和Ni(CN)4]2也可通过磁性实验来确定 它们属于内轨型还是外轨型。N2中有2个未成对d电子,其磁矩理论值“理= 0r+2②-22+2)=283B.M,实验测得Ni0NH产的u实数值与u理接近, 而N(CN)4]广的“实等于0,表明前者属外轨型而后者属内轨型。 表8-5磁矩的理论值 未成对电子数 4理/B.M 1.73 283 387 4 4.90 5 5.92 价键理论的用途与缺陷 由于价键理论简单明了,又能解决一些问题,如它可以解释配离子的几何构 型,形成体的配位数以及配合物的某些化学性质和磁性,所以它有一定的用途】 是这个理论也有缺陷,它忽略了配体 对形成体的作用。而且到目前为止还不削 定量地说明配合物的性质。如无法定量地说明过渡金属配离子的稳定性随中心离 子的d电子数变化而变化的事实。也不能解释配离子的吸收光谱和特征颜色(如 TiH2O)6]3+为何显紫红色)。此外,价键理论根据磁矩虽然可区分中心离子d4~ 7构型的八面体南合物屁内幼型不是外轨型,但材且有d1,d2,d3和d9构型 的中心离子所形成的配合物,因未成对电子数无论在内轨型还是外轨型配合物中 均无差别,只根据磁矩仍无法区别。 8-2-2晶体场理论 1.晶体场理论要点 ()中心离子和配体阴离子(或极性分子)之间的相互作用,类似离子晶体 中阳、阴离子之间(或离子与偶极分子之间)的静电排斥和吸引,而不形成共价 键。 (2)中心离子的五个能量相同的d轨道由于受周围配体负电场不同程度的排 斥作用,能级发生分裂,有些轨道能量升高,有些轨道能量降低。 得由于d轨道能级的分裂,d轨道上的电子将重新分布,体系能量降低,变 即给配合物带来了额外的稳 定化能 下面我们首先介绍中心离子d轨道能级分裂情况。 2.正八面体场中d轨道能级的分裂 配体作用前,作为中心离子的五个d轨道虽然空间取向不同,(见图54) 但具有相同的能量(Eo)[见图8-1(a)】。如果该离子处在一个带负电荷的球形场中 心,则中心离子的五个d轨道都垂直地指向球壳,并受到球形场平均电场的静电
[FeF6] 3-属外轨型,而由实验测得[Fe(CN)6] 3-的磁矩为 2.0(B.M.),此数值与具有一 个未成对电子的磁矩理论值 1.73(B.M.)很接近,表明在成键过程中,中心离子的 未成对 d 电子数减少,d 电子重新分布,腾出 2 个空 d 轨道,而以 d 2 sp 3杂化轨 道与配位原子(C)形成内轨配 键,所以[Fe(CN)6] 3-属内轨型。 又如配位数为4的配离子[Ni(NH3)4] 2+和[Ni(CN)4] 2-也可通过磁性实验来确定 它们属于内轨型还是外轨型。Ni2+中有 2 个未成对 d 电子,其磁矩理论值 μ理= = =2.83B.M.,实验测得[Ni(NH3)4] 2+的 μ实数值与 μ理接近, 而[Ni(CN)4] 2-的 μ实等于 0,表明前者属外轨型而后者属内轨型。 表 8-5 磁矩的理论值 未成对电子数 μ理/B.M. 1 1.73 2 2.83 3 3.87 4 4.90 5 5.92 价键理论的用途与缺陷 由于价键理论简单明了,又能解决一些问题,如它可以解释配离子的几何构 型,形成体的配位数以及配合物的某些化学性质和磁性,所以它有一定的用途。 但是这个理论也有缺陷,它忽略了配体对形成体的作用。而且到目前为止还不能 定量地说明配合物的性质。如无法定量地说明过渡金属配离子的稳定性随中心离 子的 d 电子数变化而变化的事实。也不能解释配离子的吸收光谱和特征颜色(如 [Ti(H2O)6]3+为何显紫红色)。此外,价键理论根据磁矩虽然可区分中心离子 d4~ d7 构型的八面体配合物属内轨型还是外轨型,但对具有 d1,d2,d3 和 d9 构型 的中心离子所形成的配合物,因未成对电子数无论在内轨型还是外轨型配合物中 均无差别,只根据磁矩仍无法区别。 8-2-2 晶体场理论 1. 晶体场理论要点 (1) 中心离子和配体阴离子(或极性分子)之间的相互作用,类似离子晶体 中阳、阴离子之间(或离子与偶极分子之间)的静电排斥和吸引,而不形成共价 键。 (2) 中心离子的五个能量相同的 d 轨道由于受周围配体负电场不同程度的排 斥作用,能级发生分裂,有些轨道能量升高,有些轨道能量降低。 (3) 由于 d 轨道能级的分裂,d 轨道上的电子将重新分布,体系能量降低,变 得比未分裂时稳定,即给配合物带来了额外的稳定化能。 下面我们首先介绍中心离子 d 轨道能级分裂情况。 2. 正八面体场中 d 轨道能级的分裂 配体作用前,作为中心离子的五个 d 轨道虽然空间取向不同,(见图 5-4), 但具有相同的能量(Eo)[见图 8-1(a)]。如果该离子处在一个带负电荷的球形场中 心,则中心离子的五个 d 轨道都垂直地指向球壳,并受到球形场平均电场的静电

排斥,各个d轨道的能量都升高到Es[见图8-I(b),由于受到静电排斥的程度相 同,因而能级并不发生分裂。 如果有六个相同的配体L,各沿着X±Y,Z坐标轴接近中心离子(见图 8-2),形成八面体配离子时,带正电的中心离子与作为配体的阴离子(或极性 分子带负电的一端)相互吸引:但同时中心离子d轨道上的电子受到配体的排斥, 五个d轨道的能量相应于前面所述的o皆高升。由于y和4轨道处于和配 体迎头相碰的位置,因而这两个轨道中的电子受到静电斥力较大,能量升高 而dxy,dyz,dxz这三个轨道正好插在配体的空隙中间,因而处于这些轨道中的电 子受到静电排斥力较小,它们的能量相应比前两个轨道的能量低,但仍比中心离 子处于自由状态时d轨道能量高。即在配体的影响下,原来能量相等的轨道能 级分裂为两组见图81©小一组为能量较高的4和,轨道,称为g轨道, 它们二者的能量相等;另一组为能量较低的dy,dyz,dkz轨道,称为2g轨道, 它们三者的能量相等。 必须指出:(少配体场越强,d轨道能级分裂程度越大[图8-l(d)所示]: (2)在不同构型的配合物中,中心离子d轨道能级分裂情况不同。 3.分裂能及其影响因素 离子的d轨道受 构型配体电场的影响,能级发生分裂,分裂后最 能级和最低能级之差称为分裂能,以△0表示。如在正八面体场中分裂能(通常 用△①表示)为.B,即A0品。.Bg ①△o中的脚标o”表示八面体(octahedron) 这相当于一个电子由t2g轨道跃迁到g轨道所需要的能量。分裂能可通过配合 物的光谱实验测得。 影响分裂能大小的主要因素分述如下。 ①配合物的几何 在同种配体中, 中心离子距离相同的条件下,根据计算得出,正四面体 场中d轨道的分裂能(△②)仅为八面体场的49,即 △-(4/9)△0 ②t中的脚标“t”表示四面体(tetrahedron). 影响分裂能大小的主要因素分述如下。 2)配体的性质 同种中心离子,与不同配体形成相同构型的配离子时,其分裂能△值随配体 场强不同而变化。表86列出C3+与不同配体形成八面体配离子时分裂能的 大小。 表8-6不同配体的晶体场分裂能 配离了 [CrF]> [Cr(H2O6]3 分裂能△o/(kJ-mol-I) 158 182 208 配离子 ICr(NH ICr(en)1 ICKCNI 分裂能△o/kJ-mol-.1) 258 262 314
排斥,各个 d 轨道的能量都升高到 Es[见图 8-1(b)],由于受到静电排斥的程度相 同,因而能级并不发生分裂。 如果有六个相同的配体 L,各沿着±X,±Y,±Z 坐标轴接近中心离子(见图 8-2),形成八面体配离子时,带正电的中心离子与作为配体的阴离子(或极性 分子带负电的一端)相互吸引;但同时中心离子 d 轨道上的电子受到配体的排斥, 五个 d 轨道的能量相应于前面所述的 Eo 皆高升。由于 和 轨道处于和配 体迎头相碰的位置,因而这两个 d 轨道中的电子受到静电斥力较大,能量升高。 而 dxy,dyz,dxz 这三个轨道正好插在配体的空隙中间,因而处于这些轨道中的电 子受到静电排斥力较小,它们的能量相应比前两个轨道的能量低,但仍比中心离 子处于自由状态时 d 轨道能量高。即在配体的影响下,原来能量相等的 d 轨道能 级分裂为两组[见图 8-1(c)]:一组为能量较高的 和 轨道,称为 eg 轨道, 它们二者的能量相等;另一组为能量较低的 dxy,dyz, dxz 轨道,称为 t2g 轨道, 它们三者的能量相等。 必须指出:(1) 配体场越强,d 轨道能级分裂程度越大[图 8-1(d)所示]; (2) 在不同构型的配合物中,中心离子d 轨道能级分裂情况不同。 3. 分裂能及其影响因素 中心离子的 d 轨道受不同构型配体电场的影响,能级发生分裂,分裂后最高 能级和最低能级之差称为分裂能,以 Δo 表示。如在正八面体场中分裂能(通常 用△o①表示)为 - , 即 Δo= - 。 ①Δo 中的脚标“o”表示八面体(octahedron)。 这相当于一个电子由 t2g 轨道跃迁到 eg 轨道所需要的能量。分裂能可通过配合 物的光谱实验测得。 影响分裂能大小的主要因素分述如下。 (1) 配合物的几何构型 在同种配体中,接近中心离子距离相同的条件下,根据计算得出,正四面体 场中 d 轨道的分裂能(Δt②)仅为八面体场的 4/9,即 Δt=(4/9)Δo ② Δt 中的脚标“t”表示四面体(tetrahedron)。 影响分裂能大小的主要因素分述如下。 (2) 配体的性质 同种中心离子,与不同配体形成相同构型的配离子时,其分裂能△值随配体 场强弱不同而变化。表 8-6 列出 Cr3+与不同配体形成八面体配离子时分裂能的 大小。 表 8-6 不同配体的晶体场分裂能 配离子 [CrCl6] 3- [CrF6] 3- [Cr(H2O)6] 3+ 分裂能 Δo/(kJ·mol-1) 158 182 208 配离子 [Cr(NH3)6] 3+ [Cr(en)3] 3+ [Cr(CN)6] 3- 分裂能 Δo/(kJ·mol-1) 258 262 314

由表8一6可看出,C1-作为配体时△o值小,即它对中心离子3电子的排斥 作用较小:CN一作配体时, △o值大,即在CN-的八面体场中,中心离子3d电子强烈地被CN-排斥。显然 C-为弱场配体,CN一为强场配体。配体场强愈强,△0值就愈大。配体场强的强 弱顺序排列如下: 弱场配体 强场配体 →场强增强 I-<Br-<S2<SCN-~CI-<F-<OH-<ONO-<C20 <H2O<NCS'<edta<NH<en NO2<CN'<CO 这个顺序是从配合物的光谱实验确定的,故称为光谱化学序列。光谱化学序 列中大体上可以将HO、NH作为分界弱场配体(如厂、B、CI、F一等)和强 场配体(如NO2ˉ、CN等)的界限, ()中心离子的电荷 同种配体与同一过渡元素中心离子形成的配合物,中心离子正电荷越多,其 △值越大。这是由于随着中心离子正电荷的增多,配体更靠近中心离子,中心离 子外层d电子与配体之间的斥力增大,从而使△值增大。表8-7列出第四周期某 些M和M六水合离子的分裂能△o值。 表8-7MH,O)%P+和M(H,Ow+的分裂能 过渡元素Ti V Cr Mn Fe Co Ni Cu 中心离子d电 d2 d3 d4 d5 d6 d7 d8 d9 子数 △o/(kJ-mol-1)-15116693124111102151 中心离子d电 +3 子数 d1 d2 d3 d4 ds d6 d7 d8 △p/(kJ-mol-1)243211208251164-. (④)元素所在周期数 同种配体与相同氧化值同族过渡元素离子所形成的配合物,其△值随中心 离子在周期表中所处的周期数而递增(见表8一8)。一般第二过渡系比第一过 渡系的4大40~50%,第三过渡系比第二过渡系大20~25%。这主要是由于后 两过度系金屈离子的d轨道比较展,受配体场的作用较强列。 表8-8不同周期元素的分裂能 周期 配离子 分裂能△o/kJ-mol-l) 四[CoNH3)6]3+ 274 五[RhNH3)63+ 408 六rNH3)6]3+ 490
由表 8-6 可看出,Cl-作为配体时 Δo 值小,即它对中心离子 3d 电子的排斥 作用较小;CN-作配体时, Δo 值大,即在 CN-的八面体场中,中心离子 3d 电子强烈地被 CN-排斥。显然 Cl-为弱场配体,CN-为强场配体。配体场强愈强,Δo 值就愈大。配体场强的强 弱顺序排列如下: 弱场配体 强场配体 ───— ───────────────────────→ 场强增强 I-< Br- < S 2- < SCN- ~ Cl- < F- < OH- < ONO- < C2O4 2- < H2O < NCS- < edta < NH3 < en < NO2 - < CN- < CO 这个顺序是从配合物的光谱实验确定的,故称为光谱化学序列。光谱化学序 列中大体上可以将 H2O、NH3作为分界弱场配体(如 I -、Br-、Cl-、F -等)和强 场配体(如 NO2 -、CN-等)的界限。 (3) 中心离子的电荷 同种配体与同一过渡元素中心离子形成的配合物,中心离子正电荷越多,其 Δ值越大。这是由于随着中心离子正电荷的增多,配体更靠近中心离子,中心离 子外层 d 电子与配体之间的斥力增大,从而使 Δ值增大。表 8-7 列出第四周期某 些 M 2+和 M 3+六水合离子的分裂能 Δo 值。 表 8-7 [M(H2O)6] 2+和[M(H2O)6] 3+的分裂能 过渡元素 Ti V Cr Mn Fe Co Ni Cu 中心离子 d 电 子数 d2 d3 d4 d5 d6 d7 d8 d9 +2 Δo/(kJ·mol-1) - 151 166 93 124 111 102 151 中心离子 d 电 子数 d1 d2 d3 d4 d5 d6 d7 d8 氧 化 值 +3 Δo/(kJ·mol-1) 243 211 208 251 164 - - - (4) 元素所在周期数 同种配体与相同氧化值同族过渡元素离子所形成的配合物,其 Δ值随中心 离子在周期表中所处的周期数而递增(见表 8-8)。一般第二过渡系比第一过 渡系的 Δ大 40~50%,第三过渡系比第二过渡系大 20~25%。这主要是由于后 两过渡系金属离子的 d 轨道比较扩展,受配体场的作用较强烈。 表 8-8 不同周期元素的分裂能 周期 配离子 分裂能 Δo/(kJ·mol-1) 四 [Co(NH3)6]3+ 274 五 [Rh(NH3)6]3+ 408 六 [Ir(NH3)6]3+ 490
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(无机化学讲义)第六章 分子的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第七章 固体的结构与性质.pdf
- 《基础化学》课程授课教案(无机化学讲义)第四章 氧化还原反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第三章 酸碱反应和沉淀反应.pdf
- 《基础化学》课程授课教案(无机化学讲义)第二章 化学反应的方向、速率和限度.pdf
- 《基础化学》课程授课教案(无机化学讲义)第一章 化学反应中的质量关系和能量关系.pdf
- 内蒙古科技大学:《基础化学》课程教学大纲 Basic Chemistry(负责人:李国祥).pdf
- 《物理化学》课程教学资源(名词术语)物理化学专业术语中英文对照表.pdf
- 《物理化学》课程教学资源(习题解答)第1章 气体.doc
- 《物理化学》课程教学资源(习题解答)第2章 热力学第一定律.doc
- 《物理化学》课程教学资源(习题解答)第3章 热力学第二定律.doc
- 《物理化学》课程教学资源(习题解答)第4章 多组分系统热力学及其在溶液中的应用.doc
- 《物理化学》课程教学资源(习题解答)第5章 相平衡.doc
- 《物理化学》课程教学资源(习题解答)第6章 化学平衡.doc
- 《物理化学》课程各章习题(含参考答案)第八章.pdf
- 《物理化学》课程各章习题(含参考答案)第九章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程各章习题(含参考答案)第十章.pdf
- 《物理化学》课程教学资源(习题解答)第11章 化学动力学基础(一).doc
- 《物理化学》课程各章习题(含参考答案)第十二章习题详解.pdf
- 《物理化学》课程各章习题(含参考答案)第十一章 化学动力学基础(一).pdf
- 《基础化学》课程授课教案(无机化学讲义)第五章 原子结构与元素周期性.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
