《基础化学》课程授课教案(有机化学讲义)第七章 芳烃
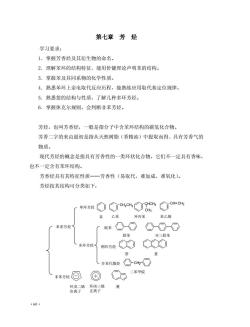
第七章芳烃 学习要求: 1.掌握芳香烃及其衍生物的命名。 2.理解苯环的结构特征,能用价键理论声明苯的结构。 3.掌握苯及其同系物的化学性质。 4.熟悉苯环上亲电取代反应历程,能熟练应用取代基定位规律。 5.熟悉萘的结构与性质,了解几种多环芳烃。 6.掌握休克尔规则,会判断非苯芳烃。 芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物。 芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的 物质。 现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味, 也不一定含有苯环结构。 芳香烃具有其特征性质一芳香性(易取代,难加成,难氧化) 芳烃按其结构可分类如下: 「单环芳烃①c4c4ch◇c+C4 CHa 苯乙苯异丙苯苯乙烯 厂苯系芳烃 「联苯☐○O-⊙-O》 联苯 对三联苯 、多环芳烃了 解0Q了 (多苯代脂轻口c吃○ 非养芳经 )同力*晚 ·60
·60· 第七章 芳 烃 学习要求: 1.掌握芳香烃及其衍生物的命名。 2.理解苯环的结构特征,能用价键理论声明苯的结构。 3.掌握苯及其同系物的化学性质。 4.熟悉苯环上亲电取代反应历程,能熟练应用取代基定位规律。 5.熟悉萘的结构与性质,了解几种多环芳烃。 6.掌握休克尔规则,会判断非苯芳烃。 芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物。 芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的 物质。 现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味, 也不一定含有苯环结构。 芳香烃具有其特征性质——芳香性(易取代,难加成,难氧化)。 芳烃按其结构可分类如下: CH2CH3 CHCH3 CH=CH2 CH3 CH2 苯系芳烃 非苯芳烃 单环芳烃 多环芳烃 联苯 稠环芳烃 多苯代脂烃 苯 乙苯 异丙苯 苯乙烯 联苯 对三联苯 萘 蒽 二苯甲烷 环戊二烯 负离子 环庚三烯 正离子 薁
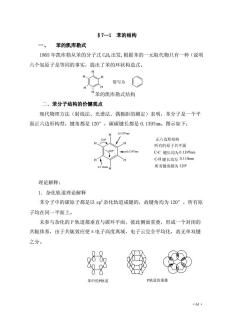
§7一1苯的结构 一、苯的凯库勒式 1865年凯库勒从苯的分子式CH。出发,根据苯的一元取代物只有一种(说明 六个氢原子是等同的事实,提出了苯的环状构造式。 ,简写为 H “苯的凯库物式结构 二、苯分子结构的价键观点 现代物理方法(射线法、光谱法、偶极距的测定)表明,苯分子是一个平 面正六边形构型,键角都是120°,碳碳键长都是0.1397m。图示如下: 0137m 正六边形结构 所有的原子共平面 C-C键长均为0.1397nm C-H键长均为0.110nm 所有键角都为120 理论解释: 1.杂化轨道理论解释 苯分子中的碳原子都是以s即杂化轨道成键的,故键角均为120°,所有原 子均在同一平面上。 未参与杂化的P轨道都垂直与碳环平面,彼此侧面重叠,形成一个封闭的 共轭体系,由于共轭效应使:电子高度离域,电子云完全平均化,故无单双键 之分。 00 0Q00 00 苯中的P轨道 P轨道的重叠 .61
·61· §7—1 苯的结构 一、 苯的凯库勒式 1865 年凯库勒从苯的分子式 C6H6出发,根据苯的一元取代物只有一种(说明 六个氢原子是等同的事实,提出了苯的环状构造式。 苯的凯库勒式结构 二、苯分子结构的价键观点 现代物理方法(射线法、光谱法、偶极距的测定)表明,苯分子是一个平 面正六边形构型,键角都是 120°,碳碳键长都是 0.1397nm。图示如下: 理论解释: 1.杂化轨道理论解释 苯分子中的碳原子都是以 sp 2杂化轨道成键的,故键角均为 120°,所有原 子均在同一平面上。 未参与杂化的 P 轨道都垂直与碳环平面,彼此侧面重叠,形成一个封闭的 共轭体系,由于共轭效应使π电子高度离域,电子云完全平均化,故无单双键 之分。 简写为 H H H H H H H H H H H H 所有的原子共平面 键长均为 键长均为 所有键角都为 C-C C-H 0.1397nm 0.110nm 120° 120° 120° 0.1397nm 0.1397nm 0.110nm 正六边形结构 苯中的P轨道 P轨道的重叠

2.分子轨道理论解释 分子轨道理论认为,分子中六个P轨道线形组合成六个π分子轨道,其中 三个成键规定,三个反键轨道。在基态时,苯分子的六个电子成对填入三个 成键轨道,其能量比原子轨道低,所以苯分子稳定,体系能量较低。 反键轨道 原子轨道 成键轨道 苯的分子轨道能级示意图 4二个节面 无节面 和S 苯分子的大π键是三个成键轨道摩期的结果子重我子都是离域的,所 以碳碳键长完全相同。 二、从氢化热看苯的稳定性 O △H120KJ/mol +4一 △H=-232K1ml ○+一○ △H=-208KJ/mdl △H紫理=-3x120=360K)1md △H实=208K/mol 苯的稳定化能(离域能或共振能)=360-208=152KJ/mo1 ·62
·62· 2.分子轨道理论解释 分子轨道理论认为,分子中六个 P 轨道线形组合成六个π分子轨道,其中 三个成键规定,三个反键轨道。在基态时,苯分子的六个π电子成对填入三个 成键轨道,其能量比原子轨道低,所以苯分子稳定,体系能量 较低 。 苯分子的大π键是三个成键轨道叠加的结果,由于π电子都是离域的,所 以碳碳键长完全相同。 二、 从氢化热看苯的稳定性 苯的稳定化能(离域能或共振能)=360-208=152KJ/mol E 原子轨道 反键轨道 成键 轨道 苯的分子轨道能级示意图 H2 2H2 3H2 H= _ 120KJ / mol H= _ 232KJ / mol H= _ 208KJ / mol H苯理=3x120=360KJ / mol H苯实=208 KJ / mol E ψ ψ ψ ψ ψ2 ψ3 4 5 6 1 无节面 三个节面 二个节面 一个节面 苯的π 电子分子轨道重叠情况

三、苯的共振式和共振论的简介 1.基本要点: a.当一个分子、离子或游离基按照理论可以写出两个以上经典结构式时, 这些经典结构式构成了一个共振杂化体,共振杂化体接近实际分子。 ⊙→©→⑦→①→⊙ b.书写极限式时,必须严格遵守经典原子结构理论。原子核的相对位置不 能改变,只允许电子排布上有所差别。 0 → 00 00 00 CH.CH.CH.CH光CH9CH CH3 c.在所有极限式中,未共用的电子数必须相等。 CHCH-CH←一CH-CH丫dGdd4 一个未公用电子 一个未公用电子 三个未公用电子 d.分子的稳定程度可用共振能表示。 苯的共振能为150.4KJ/mol 2.共振论解释苯的结构 最重要的贡献结构 重要的贡献结构 □→□ §7一2单环芳烃的异构和命名 一、异构现象 1.烃基苯有烃基的异构 例如: CHCH地c地 63
·63· 三、 苯的共振式和共振论的简介 1.基本要点: a. 当一个分子、离子或游离基按照理论可以写出两个以上经典结构式时, 这些经典结构式构成了一个共振杂化体,共振杂化体接近实际分子。 b.书写极限式时,必须严格遵守经典原子结构理论。原子核的相对位置不 能改变,只允许电子排布上有所差别。 c.在所有极限式中,未共用的电子数必须相等。 d.分子的稳定程度可用共振能表示。 苯的共振能为 150.4 KJ/mol 2.共振论解释苯的结构 §7—2 单环芳烃的异构和命名 一、 异构现象 1.烃基苯有烃基的异构 例如: CH2CH2CH3 CH CH3 CH3 O C O O O C O O O C O O - - - - - - CH3CH2CH2CH3 CH3CHCH3 CH3 CH2CH=CH2 CH2=CHCH2 CH2CHCH2 一个未公用电子 一个未公用电子 三个未公用电子 + - + - 最重要的贡献结构 最不重要的贡献结构 兰色

2.二烃基苯有三中位置异构 例如: CC 3.三取代苯有三中位置异构 例如: .O 二、命名 1.基的概念 芳烃分子去掉一个氢原子所剩下的基团称为芳基(Ary1)用Ar表示。重要 的芳基有: 苯基,用Ph或中表示 2.一元取代苯的命名 a当苯环上连的是烷基(R-),NO,-X等基团时,则以苯环为母体,叫做 某基苯。 例如: CToroe 异丙基苯叔丁基苯硝基苯 氟苯 b当苯环上连有-C00H,-S0H,-NH,-OH,-CHO,-CH=CH或R较复杂时, 则把苯环作为取代基。例如: ·64
·64· 2.二烃基苯有三中位置异构 例如: 3.三取代苯有三中位置异构 例如: 二、 命名 1.基的概念 芳烃分子去掉一个氢原子所剩下的基团称为芳基(Aryl)用 Ar 表示。重要 的芳基有: 2.一元取代苯的命名 a 当苯环上连的是烷基(R-),-NO2,-X 等基团时,则以苯环为母体,叫做 某基苯。 例如: b 当苯环上连有-COOH,-SO3H,-NH2,-OH,-CHO,-CH=CH2或 R 较复杂时, 则把苯环作为取代基。例如: R R' R R R' R' R R' R R R'' R'' R'' R' R' CH2 (C6H5CH2 -) 苄基(苯甲基),用Bz表示 苯基, 用Ph或ф 表示 CH CH3 CH3 NO2 Cl 异丙基苯 叔丁基苯 硝基苯 氯苯

moC0t 苯甲酸苯磺酸 苯甲醛 苯酚 苯胺 acn CHCHz-CH-CCHzCH % 苯乙烯 3,子二甲基4苯基已烷 3.二元取代苯的命名 取代基的位置用邻、间、对或1,2:1,3:1,4表示 例如: “ 4 OH 邻二甲苯 间二甲苯 对二甲苯邻甲基苯酚 (1,2.二甲苯)(1,2二甲苯)(1,2二甲苯) 心二甲苯) m二甲苯) p二甲苯) 。~甲基苯酚)》 4.多取代苯的命名 a取代基的位置用邻、间、对或2,3,4,.表示 b母体选择原则(按以下排列次序,排在后面的为母体,排在前面的作为 取代基。) 选择母体的顺序如下: -NO2、-X、-OR(烷氧基)、-R(烷基)、-NH、-OH、-COR、CHO、-CN、 -CONH(酰胺)、-COX(酰卤)、-C00R(酯)、-S0H、-C0OH、-NR等 例如: 6心 2 对装对复基装酸间基米甲酸装餐羟基26 .65
·65· 3.二元取代苯的命名 取代基的位置用邻、间、对或 1,2; 1,3; 1,4 表示。 例如: 4.多取代苯的命名 a 取代基的位置用邻、间、对或 2,3,4,.表示 b 母体选择原则(按以下排列次序,排在后面的为母体,排在前面的作为 取代基。) 选择母体的顺序如下: -NO2、 -X、 -OR(烷氧基)、 -R(烷基)、 -NH2、 -OH、 -COR、 -CHO、 -CN、 -CONH2(酰胺)、 -COX(酰卤)、 -COOR(酯)、 -SO3H、 -COOH、 -N + R3等 例如: COOH SO3H CHO OH NH2 CH=CH2 CH3-CH2-CH-C-CH2-CH3 CH3 CH3 苯甲酸 苯磺酸 苯甲醛 苯酚 苯胺 苯乙烯 3,3-二甲基-4-苯基己烷 CH3 CH3 CH3 H3C CH3 CH3 OH H3C 邻二甲苯 间二甲苯 对二甲苯 邻甲基苯酚 (1,2-二甲苯) (1,2-二甲苯) (1,2-二甲苯) (o- 二甲苯) (m-二甲苯) (p-二甲苯) (o-甲基苯酚) OH Cl NH2 SO3H COOH NO2 COOH HO NO2 NH2 Cl OCH3 对氯苯酚 对氨基苯磺酸 间硝基苯甲酸 3-硝基-5-羟基 苯甲酸 2-甲氧基-6- 氯苯胺
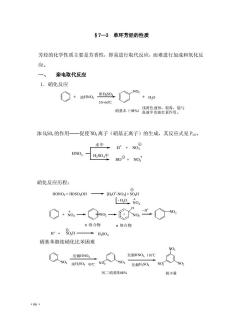
§7一3单环芳烃的性质 芳烃的化学性质主要是芳香性,即易进行取代反应,而难进行加成和氧化反 应。 一、亲电取代反应 1.硝化反应 O·o20 5560C 时基本(98%)波被争被货很喜用能与 浓HS0,的作用一促使NO,离子(硝基正离子)的生成,其反应式见P。 水中,r+NO9 HNO,s0中HoO+No时 硝化反应历程: HON0+H0S0,0H→馬,0-NO+S0,H -HO NO2 H ◇+a一◇o一⊙Xo出Co x络合物。络合物 H+SO.H- →HS0 硝基苯继续硝化比苯困难 0 w,R0,元 发烟HNO. 发烟HNO3,110C NO NO 间二硝基苯88% 极少量 66
·66· §7—3 单环芳烃的性质 芳烃的化学性质主要是芳香性,即易进行取代反应,而难进行加成和氧化反 应。 一、 亲电取代反应 1.硝化反应 浓 H2SO4的作用——促使+ NO2离子(硝基正离子)的生成,其反应式见 P157。 硝化反应历程: 硝基苯继续硝化比苯困难 浓HNO3 浓H2SO4 NO2 硝基本(98%) 55~60℃ H2O 浅黄色液体,很毒,能与 血液中的血红素作用。 HNO3 水中 H2SO4中 H + + NO3 HO + NO2 NO2 NO NO2 2 NO2 NO2 发烟HNO3, H2SO4 NO2 浓 发烟HNO3, 95℃ 发烟H2SO4 110℃ 间二硝基苯88% 极少量 HONO2 + HOSO2OH [H2O + -NO2 ] + SO4H - H2O NO2 NO2 NO2 H NO2 NO2 - H + H + + SO4H H2SO4 + π 络合物 σ 络合物
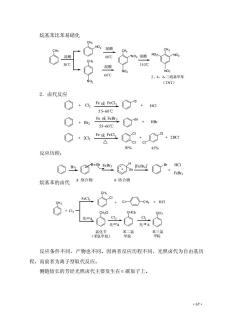
烷基苯比苯易硝化 NO:混酸 60℃ NO 混酸 110℃ 60C NO 2,4,6 2.卤代反应 ◇+a,e成eaCa+Hg 5560℃ O+贴gC,m 55-60℃ 04a。C0:m △ 50% 45% 反应历程: 04t⊙画g”,m 烷基苯的卤代:络合物 G。络合物 C.a 反应条件不同,产物也不同。因两者反应历程不同,光照卤代为自由基历 程,而前者为离子型取代反应。 侧链较长的芳烃光照卤代主要发生在α碳原子上。 67
·67· 烷基苯比苯易硝化 2.卤代反应 反应历程: 烷基苯的卤代 反应条件不同,产物也不同。因两者反应历程不同,光照卤代为自由基历 程,而前者为离子型取代反应。 侧链较长的芳烃光照卤代主要发生在α碳原子上。 CH3 CH3 NO2 CH3 CH3 CH3 NO2 NO2 NO2 NO2 NO2 混酸 NO2 混酸 混酸 30℃ 60℃ 60℃ 110℃ 混酸 2,4,6-三硝基甲苯 (TNT) Cl Br Cl Cl Cl Cl + Cl2 Fe FeCl 或 3 55~60℃ + Br2 Fe FeBr 或 3 55~60℃ + 2Cl2 Fe FeCl 或 3 + + + + HCl HBr 2HCl 50% 45% Br2 FeBr3 H Br [FeBr4 ] - Br + HCl FeBr3 Br-Br π 络合物 σ络合物 CH3 + Cl2 FeCl3 光orΔ CH3 Cl + Cl CH3 + HCl CH2Cl CHCl2 CCl3 Cl2 Cl2 光orΔ 光 orΔ 氯化苄 (苯氯甲烷) 苯二氯 甲烷 苯三氯 甲烷
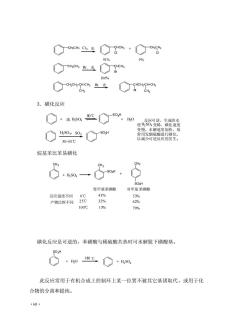
◇otch8o·g 91% 9% ◇CN◇gc 100P% GCHOHCR去 8"2 3.磺化反应 +sa贮so1,0 使瓷晓的炎 09C 史慢,水解速度加快, 赏摄发壁陵被陵生: 30-50℃ 烷基苯比苯易磺化 8 !. 邻甲基苯磺酸对甲基苯磺酸 反应温度不问 43% 53% 产物比例不同 32% 62% 100℃ 13% 79% 磺化反应是可逆的,苯磺酸与稀硫酸共热时可水解脱下磺酸基。 90H +h0侧℃◇+,s0, 此反应常用于有机合成上控制环上某一位置不被其它基团取代,或用于化 合物的分离和提纯。 68
·68· 3.磺化反应 烷基苯比苯易磺化 磺化反应是可逆的,苯磺酸与稀硫酸共热时可水解脱下磺酸基。 此反应常用于有机合成上控制环上某一位置不被其它基团取代,或用于化 合物的分离和提纯。 CH2CH3 Cl CHCH3 + CH2CH2 2, 光 Cl Cl 91% 9% CH2CH3 Br, 光 CHCH3 Br 100% CH2CH2 -CH-CH3 CH3 CHCH2 -CH-CH3 Br CH3 Br, 光 SO3H + 浓 H2SO4 80℃ H2O H2SO4, 30~50℃ SO3 + SO3H 反应可逆,生成的水 使 变稀,磺化速度 变慢,水解速度加快,故 常用发烟硫酸进行磺化, 以减少可逆反应的发生。 H2SO4 CH3 CH3 CH3 SO3H SO3H + + H2SO4 邻甲基苯磺酸 对甲基苯磺酸 反应温度不同 0℃ 25℃ 100℃ 产物比例不同 43% 32% 13% 53% 62% 79% SO3H + H2 SO4 ℃ + H2O 180

磺化反应历程: 2HS04±S03+H,0+Hs04 Cs-⊙兰 4.付瑞德一克拉夫茨(C.Friede一J.M.Crafts)反应 1877年法国化学家付瑞德和美国化学家克拉夫茨发现了制备烷基苯和芳酮 的反应,简称为付一克反应。前者叫付一克烷基化反应,后者叫付一克酰基化 反应。 (1)烷基化反应 苯与烷基化剂在路易斯酸的催化下生成烷基苯的反应称为付一克烷基化反 应。 C+CH,CH BrAICh◇c%o+Br 025℃ 76% 反应历程: CHCH,k+AC→aH,8-BrNd→CH,d4,+[Na,副 Oo一⊙业0w, 此反应中应注意以下几点: 1°常用的催化剂是无水A1Cla,此外FeCl、BF、无水F、SnC1、ZnCl、 HPO4、HS0,等都有催化作用。 2°当引入的烷基为三个碳以上时,引入的烷基会发生碳链异构现象。 例如: ◇:CINGICNG NG8Ceuo4aw 异丙苯(6-69%正丙苯(35-31% 69
·69· 磺化反应历程: 4.付瑞德—克拉夫茨(C.Friede —J.M.Crafts)反应 1877 年法国化学家付瑞德和美国化学家克拉夫茨发现了制备烷基苯和芳酮 的反应,简称为付—克反应。前者叫付—克烷基化反应,后者叫付—克酰基化 反应。 (1) 烷基化反应 苯与烷基化剂在路易斯酸的催化下生成烷基苯的反应称为付—克烷基化反 应。 反应历程: 此反应中应注意以下几点: 1°常用的催化剂是无水 AlCl3,此外 FeCl3、BF3、无水 HF、SnCl4、ZnCl2、 H3PO4、H2SO4等都有催化作用。 2°当引入的烷基为三个碳以上时,引入的烷基会发生碳链异构现象。 例如: 2 H2SO4 SO3 + H3O + + HSO4 SO3H H S O SO3 O O + δ δ H + CH2CH3 + CH3CH2Br AlCl3 + HBr 76% 0~25 ℃ CH2CH3 CH3 CH2 Br + AlCl 3 HBr CH3CH2 -Br.AlCl3 δ δ CH3CH2 + [AlCl3Br] + CH3CH2 CH2CH3 H H + AlCl 3 + CH CH3 CH3 CH2CH2CH3 + CH3CH2CH2Cl AlCl3 + 异丙苯(65~69%) 正丙苯(35~31%)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第八章 吸光光度法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第一章 绪论.pdf
- 《基础化学》课程授课教案(分析化学讲义)第五章 配位滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第六章 氧化还原滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第七章 重量分析法和沉淀滴定法.pdf
- 《基础化学》课程授课教案(分析化学讲义)第二章 误差及分析数据的统计处理.pdf
- 《基础化学》课程授课教案(分析化学讲义)第一章绪论.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十三章 镧系和锕系元素.pdf
- 《基础化学》课程授课教案(分析化学讲义)第三章 滴定分析.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十章 卤素和氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十二章 过渡元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第十一章 卤素及氧族元素.pdf
- 《基础化学》课程授课教案(无机化学讲义)第九章 碱金属和碱土金属元素.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十章 醇、酚、醚.pdf
- 《基础化学》课程授课教案(物理化学讲义)第一章 第零定律与物态方程.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十三章 羧酸衍生物.pdf
- 《基础化学》课程授课教案(物理化学讲义)第二章 热力学第一定律.pdf
- 《基础化学》课程授课教案(物理化学讲义)第五章 化学平衡.pdf
- 《基础化学》课程授课教案(物理化学讲义)第四章 溶液(Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第三章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第二部分 电解与极化作用(electrolysis and polarization).pdf
- 《基础化学》课程授课教案(物理化学讲义)第六章 相平衡(Phase equilibrium).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第三部分 第三部分 可逆电池(Reversible Cell).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第一部分 电解质溶液(Electrolytic Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第九章 化学动力学.pdf
- 《基础化学》课程授课教案(物理化学讲义)第十章 胶体.pdf
- 内蒙古科技大学:《基础化学》课程教学实验指导(有机化学、无机化学、分析化学、物理化学).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷2(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷2(答案).pdf
