《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第一部分 电解质溶液(Electrolytic Solution)

第七章电化学 第一部分电解质溶液(Electrolytic Solution)(教案) 一、教学方案 ①掌握电导、比电导及摩尔电导率的概念,熟悉电导测定的应用: 和影响因素度及离子电导的概念 教学目的和要 ⑤掌握离子强度、平均活度与平均活度系数的概念,稀溶液中电解质平均 活度系数的计算: ⑧了解强电解质溶液离子互吸理论和电导理论。 ①摩尔电导率等概念及计算: 2.教学重点 ②离子独立运动定律: ③平均活度与平均活度系数。 3.教学难点 ①浓度对比电导及摩尔电导率的影响: ②强电解质溶液理论。 ①授课全部用多媒体电子教案,告别了传统的粉笔加黑板的单一教学模 4.教学方法和手 段 教学内容及课 2款药T 铭和迁移 时分配 学@5学助 ⑤572.5强电解质溶液离子互吸理论和电导理论。(1学时) 一、教室内容 §7-l电解质溶液的电导和测定方法(Conductance of electrolyte solution and its 电质的导电 为什么稀盐酸溶液能够导电呢? 物质的量浓度 电导率xS·m C/mol·dnm 273.15K291.15K298.15K 10 6.643 9.820 11.173 1.1192 1.288 0.12270.14114
第七章 电化学 第一部分 电解质溶液(Electrolytic Solution)(教案) 一、教学方案 1. 教学目的和要 求 ① 掌握电导、比电导及摩尔电导率的概念,熟悉电导测定的应用;; ② 掌握离子迁移数的概念和影响因素; ③ 了解离子迁移数的测定方法,离子淌度及离子电导的概念; ④ 掌握离子独立运动定律的原理,并能计算电解质在无限稀释时的摩尔电 导率; ⑤ 掌握离子强度、平均活度与平均活度系数的概念,稀溶液中电解质平均 活度系数的计算; ⑥ 了解强电解质溶液离子互吸理论和电导理论。 2. 教学重点 ① 摩尔电导率等概念及计算; ② 离子独立运动定律; ③ 平均活度与平均活度系数。 3. 教学难点 ① 浓度对比电导及摩尔电导率的影响; ② 强电解质溶液理论。 4. 教学方法和手 段 ① 授课全部用多媒体电子教案,告别了传统的粉笔加黑板的单一教学模 式; ② 辅导答疑采用电子邮件及在线论坛等模式; ③ 测验、考试的试卷由试题库自动组卷及试题分析。 5. 教学内容及课 时分配 ① §7-1电解质溶液的电导和测定方法; (2学时) ② §7-2 离子的电迁移和迁移数; (1.5学时) ③ §7-3 极限迁移数的测定方法,离子淌度与离子电导; (0.5学时) ④ §7-4 电解质溶液的平均活度与平均活度系数; (1学时) ⑤ §7-5 强电解质溶液离子互吸理论和电导理论。 (1学时) 二、教案内容 §7-1电解质溶液的电导和测定方法(Conductance of electrolyte solution and its Mensuration) §7.1.1电解质溶液的导电现象 为什么稀盐酸溶液能够导电呢? 电导率κ/S·m 物质的量浓度 -1 C/mol·dm-3 273.15K 291.15K 298.15K 1.0 0.1 0.01 6.643 0.7154 0.07751 9.820 1.1192 0.1227 11.173 1.2886 0.14114

表7-1-2标准KC1溶液的电导率 01.69 图7-1-2 + 图7-1-1
表7-1-2 标准KCl溶液的电导率 图7-1-2 图7-1-1

电子导体(金属等):电子的定向运动 离子导体(电解质溶液等):离子的定向运动+电极反应电极反应:电极上进行的得失 电子的反应阳极:发生氧化反应的电极(2C1一2e一CL1) 阴极:发生还原反应的电极(2H+2e→且,↑) 电池反应:两个电极反应的总和(2C1+2H→C1,1+H↑)》 离子导体与电子导体的比较: 号的义膜号体导电能力大小的物理量美值为电的版。符号为 G,单位为s(1S=12-1), e ←● ← ← ● ←● 离子在电上的反应 图7-1-5
电子导体(金属等): 电子的定向运动 离子导体(电解质溶液等): 离子的定向运动+电极反应电极反应:电极上进行的得失 电子的反应阳极: 发生氧化反应的电极 (2Cl- - 2e-→ Cl2 ↑) 阴极: 发生还原反应的电极 (2H+ + 2e- → H2 ↑) 电池反应: 两个电极反应的总和 (2Cl- + 2H+ →Cl2 ↑ + H2 ↑) 离子导体与电子导体的比较: §7.1.2. 电导(conductance) 1 电导的物理意义∶量度导体导电能力大小的物理量,其值为电阻的倒数。 符号为 G,单位为S ( 1S=1Ω-1), 图7-1-5
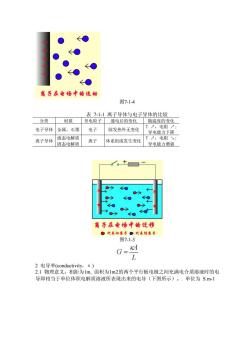
←● 离子在电场中的运动 图7-14 表711离子导体与电子导体的比较 分类材质导电粒子通电后的变化随温度的变化 电子导体金属、石墨电子除发热外无变化 T,电阻: 导电能力下降 高子号体商肉灯体系甜度双生安化甘电产 30→ 07o 离子在电场中的迁移 代泰和离子。代泰离子 图7-1-3 G= L 2由导率(conductivity,.K) 2】物理意义:相距为1m,面积为1m2的两个平行板电极之间充满电介质溶液时的电 导即相当于单位体积电解质溶液所表现出来的电导(下图所示)。·单位为S.m-1
图7-1-4 表 7-1-1 离子导体与电子导体的比较 分类 材质 导电粒子 通电后的变化 随温度的变化 电子导体 金属、石墨 电子 除发热外无变化 T ↗,电阻 ↗; 导电能力下降 离子导体 液态电解质 固态电解质 离子 体系组成发生变化 T ↗,电阻 ↘; 导电能力增强 图7-1-3 2 电导率(conductivity,κ) 2.1 物理意义:相距为1m, 面积为1m2的两个平行板电极之间充满电介质溶液时的电 导即相当于单位体积电解质溶液所表现出来的电导(下图所示)。. 单位为 S.m-1
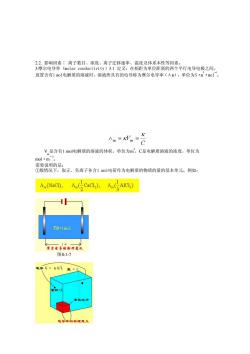
2.2.影响因素:离子数目、浓度、离子迁移速率、温度及体系本性等因素。 3摩尔电导率(molar conductivity)3.1定义:在相距为单位距离的两个平行电导电极之间, 放置含有1o1电解质的溶液时,溶液所具有的电导称为摩尔电导率(Am),单位为S·m·mol。 个 c V是含有1mol电解质的溶液的体积,单位为m,C是电解质溶液的浓度,单位为 mol·m. 西餐瓷的是取正、负高千各合1m1电药作为电解质的物质的量的基本单元。 A.(NaCI), ).) nB=1mol 图8-1-7 单位立
2.2. 影响因素∶ 离子数目、浓度、离子迁移速率、温度及体系本性等因素。 3.摩尔电导率(molar conductivity)3.1 定义:在相距为单位距离的两个平行电导电极之间, 放置含有1 mol电解质的溶液时,溶液所具有的电导称为摩尔电导率(Λm),单位为S·m 2 ·mol -1 。 V m 是含有1 mol电解质的溶液的体积,单位为m 3,C是电解质溶液的浓度,单位为 mol·m -3。 需要说明的是: ①般情况下,取正、负离子各含1 mol电荷作为电解质的物质的量的基本单元。例如: 图8-1-7

图81-6 (7-1-1) (7-1-2) ②的物质的量的基木单元应致。32影角素浓度、离子迁移速率、温度及体系术 4电导的测量(Measurement of conductance) 41原理( 电导是电阻得导数,因此由试验测出溶液的电阻,即可求出电导.测量溶液电阻要用(10002 交流电桥,否则将改变电解质溶液的组成。 42测量装置 E为放有待测溶液的电导池 电阻待测G为耳机或阴极 4.3测量步骤 ①测定电导池常数 电导池常数K,=L/A, R-p4=pk R=KR 两电极间距离L和镀有铂黑的电极面积无法用实验测量,通常用己知电导率的KCI溶液(见 下表》注入电导池,测定电阻后得
图8-1-6 (7-1-1) (7-1-2) ②CB与Λm的物质的量的基本单元应一致。3.2 影响因素:浓度、离子迁移速率、温度及体系本 性等因素。 4 电导的测量(Measurement of conductance) 4.1 原理(principle) 电导是电阻得导数,因此由试验测出溶液的电阻,即可求出电导。测量溶液电阻要用(1000Hz) 交流电桥,否则将改变电解质溶液的组成。 4.2 测量装置 常用的韦斯顿电桥如图所示,AB为均匀的滑线电阻,R1为可变电阻,并联一个可变电容以便调节 与电导池实现阻抗平衡,E为放有待测溶液的电导池,电阻待测。G为耳机或阴极示波器,接通电 源后,移动C点,使DGC线路中无电流通过,如用耳机则听到声音最小,这时D,C两点电位降相等, 电桥达平衡。根据几个电阻之间关系就可求得待测溶液的电导。 4.3 测量步骤 ① 测定电导池常数 电导池常数 Kcell = L/A, 两电极间距离L和镀有铂黑的电极面积A无法用实验测量,通常用已知电导率的KCl溶液(见 下表)注入电导池,测定电阻后得到Kcell

太选电原幻 电解质电手测定 图7-1-8 Rs R G- 1 R AC 1 R,RR BC R 测定待测溶 用 标准KC 溶液电导的重要因素 电导越大,这是与电导率不同的地方。Kohlrausch从大量的电导实验数据观察到 摩尔电导与浓度的关系符合下述经验关系式:CA什∧=人入 +=Λ入入 oc
图7-1-8 测定待测溶液 于是,用标准KCl 5 影响电解质溶液电导的重要因素 5.1 浓度对电导的影响 几种电解质水溶液在 电导越大,这是与电导率不同的地方。 Kohlrausch 从大量的电导实验数据观察到 摩尔电导与浓度的关系符合下述经验关系式: CA+∧=∧ −++=∧λλ 上
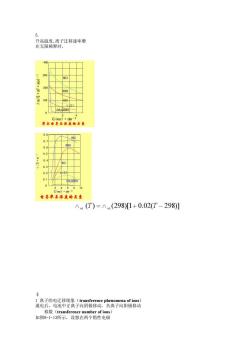
高温度,离子迁移速率增 在无限稀释时, 300 00H 厚东电系5浓麦的头系 08T 0.7 0.0 05A 0.4 c 68 电与浓的美 Am(T)=A.(298)1+0.02(T-298)] 1离子的电迁移现象(transference phenomena of ions) 通电后,电池中正离子向阴极移动, 负离子向阳极移动
5. 升高温度,离子迁移速率增 在无限稀释时, § 1 离子的电迁移现象(transference phenomena of ions) 通电后,电池中正离子向阴极移动,负离子向阳极移动 移数(transference number of ions) 如图8-1-13所示,设想在两个惰性电极

中部区及阴极区三个部分。假定未通电前,各区均含有正、负离子各5l +、-号代替。 有40l正离子发生还原反应。两电极间正、负离子要共同承担40l电子电量的运输任务。 种 qq 019 图821离子的电迁移现象 T/K273283293298 KCI 0.7680.7690.7700.769 KOH 0.7950.7980.7980.798 NaOH 10.7670.7680.7660.766 表7一4一1温度对1一1型电解质平均活度系数的影响 ) t.= 9, 1.= 上式可推广应用到一般类型的电解质。 3迁移数的测定(det nsference number) 移数的常用万法是架面移动法mnudm》, 所示
、中部区及阴极区三个部分。假定未通电前,各区均含有正、负离子各5 mol +、-号代替。 上有4 mol正离子发生还原反应。两电极间正、负离子要共同承担4 mol电子电量的运输任务。 一种 qq T/K 273 283 293 298 KCl KOH NaOH 0.768 0.795 0.767 0.769 0.798 0.768 0.770 0.798 0.766 0.769 0.798 0.766 表 7-4-1 温度对1-1型电解质平均活度系数的影响 ; 上式可推广应用到一般类型的电解质。 3 迁移数的测定(determination of transference number) 测定迁移数的常用方法是界面移动法(moving boundary method),如下图8-2-2 所示

两种电解溶液HCI及CdCL,由AA分界,当Q的电量通入后,分界面移动了x距离 到达BB,设界面面积为A,电解质浓度为C,则 xACZ F=t Q t.=xACZ.F/Q 的o田T m。试计算t (Li) 解:按上式, tLi=xACZF/Q-0.010×1.25×103×7.30×102×1000/1.80×103× 1490/96487=0.328 4影响迁移数的因素(influence factor for transference number) 4.1温度的影响 表7-21 KCI溶液中K在不同温度、 不同浓度下的迁移数 Cmol·dm 0.000 0.005 0.010.02 T/K 0.4924 0.49280.49060.4889 318 0.48870.48860.4885
两种电解溶液HCl 及CdCl2由AA′分界,当Q的电量通入后,分界面移动了x距离 到达BB ′,设界面面积为A ,电解质浓度为C,则 xACZ + F=t + Q t + =xACZ + F/Q 例4 用0.010 mol·dm -3 LiCl 作界面移动法试验。所用迁移管的面积为1.25× 10 -5 m 2 。使用1.80×10 -3 A 的电流通入1490s后发现界面移动了7.30×10 -2 m。试计算t (Li + )。 解∶按上式, t (Li + )=xACZ + F/Q=0.010 × 1.25 × 10 -5 × 7.30 × 10 -2 × 1000/1.80 × 10 -3 × 1490/96487=0.328 4 影响迁移数的因素(influence factor for transference number) 4.1 温度的影响 表7-2-1 KCl溶液中K +在不同温度、不同浓度下的迁移数 C/mol·dm -3 T/K 0.000 0.005 0.01 0.02 298 308 318 0.49280.49060.4889 0.4926 0.4903 0.4887 0.4925 0.4902 0.4886 0.4924 0.4901 0.4885
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第三部分 第三部分 可逆电池(Reversible Cell).pdf
- 《基础化学》课程授课教案(物理化学讲义)第六章 相平衡(Phase equilibrium).pdf
- 《基础化学》课程授课教案(物理化学讲义)第七章 电化学 第二部分 电解与极化作用(electrolysis and polarization).pdf
- 《基础化学》课程授课教案(物理化学讲义)第三章 热力学第二定律 The Second Law of Thermodynamics.pdf
- 《基础化学》课程授课教案(物理化学讲义)第四章 溶液(Solution).pdf
- 《基础化学》课程授课教案(物理化学讲义)第五章 化学平衡.pdf
- 《基础化学》课程授课教案(物理化学讲义)第二章 热力学第一定律.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十三章 羧酸衍生物.pdf
- 《基础化学》课程授课教案(物理化学讲义)第一章 第零定律与物态方程.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十章 醇、酚、醚.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十一章 醛和酮.pdf
- 《基础化学》课程授课教案(有机化学讲义)第十二章 羧酸.pdf
- 《基础化学》课程授课教案(有机化学讲义)第七章 芳烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第六章 对映异构.pdf
- 《基础化学》课程授课教案(有机化学讲义)第五章 脂环烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第九章 卤代烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第四章 炔烃和二烯烃.pdf
- 《基础化学》课程授课教案(分析化学讲义)第四章 酸碱滴定法.pdf
- 《基础化学》课程授课教案(有机化学讲义)第二章 烷烃.pdf
- 《基础化学》课程授课教案(有机化学讲义)第三章 单烯烃.pdf
- 《基础化学》课程授课教案(物理化学讲义)第九章 化学动力学.pdf
- 《基础化学》课程授课教案(物理化学讲义)第十章 胶体.pdf
- 内蒙古科技大学:《基础化学》课程教学实验指导(有机化学、无机化学、分析化学、物理化学).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷2(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷2(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷4(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷3(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷3(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷4(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷6(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷6(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷5(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷5(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷8(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷8(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷7(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷7(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷9(答案).pdf
