河南师范大学:《物理化学》课程教学资源(PPT课件)第四章 化学平衡

第四章化学平衡 本章目录 一反应的等温方程和平衡常数 二标准生成自由能与平衡常数 三一些因素对平衡的影响 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 第四章 化学平衡 本章目录

§41反宝的等温方程和年衡常款 本节要目 化学反应的平衡条件 二范特荷夫等温方程 三平衡常数 小 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 本节要目

食 §4,1反寇的等温方程和平衡常赵 一、化学反应的平衡条件 1.反应的摩尔吉布斯能变 2、平衡条件 3.为什么会存在化学平衡? 4.亲和势(affinity) 上页 下页 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 一、化学反应的平衡条件 1.反应的摩尔吉布斯能变 2、平衡条件 3.为什么会存在化学平衡? 4. 亲和势(affinity)

§4.1反寇的等温方程和平衡常款 1.反应的摩尔吉布斯能变 化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个 化学反应,设为: dD+eE+.→P+gG+. 在体系内发生了微小的变化(包括温度、压力和化学反应的变化), 体系内各物质的量相应地有微小的变化(设无非体积功),则 dG=-SdT+dP+∑h.dng 如果变化是在等T,P进行的,则 dG=∑4.d血。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 1. 反应的摩尔吉布斯能变 化学反应体系: 封闭的单相体系,不作非膨胀功,发生了一个 化学反应,设为: 在体系内发生了微小的变化(包括温度、压力和化学反应的变化), 体系内各物质的量相应地有微小的变化(设无非体积功),则 如果变化是在等T, P进行的,则 d e f g D E F G + + → + + dG= -SdT+VdP+ B B dnB dG= B B B dn

§4,1反寇的等温方程和平衡常赵 根据反应进度的定义,可以得到: d5= dng-Vpdg (dGr,p=∑Madne=∑e4ad5 (dng vad) 对于为微小变化或为1mo1时体系的吉布斯能的改变为: △G m ∑g4a 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 根据反应进度的定义,可以得到: 对于为微小变化或为1mol时体系的吉布斯能的改变为: B d B d n = B B dn =ν dξ , B B B B B B ( )d d d G n T p = = B B (d d ) n = , r m B B T P G G = =

§4.1反寇的等温方程和平衡常款 公式理解: a) 在一个无限量的体系内,体系的发生一个o变化引起G的变化 b)在一个有限量的体系内,体系发生一个微小变化d5,引起体系发 生一个dG的变化。 对A,Gm的理解: 1)量纲:J.mo1 2)强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则发生变化,引起变化, 所以不是一个定值。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 公式理解: a) 在一个无限量的体系内,体系的发生一个mol变化引起G的变化 b) 在一个有限量的体系内,体系发生一个微小变化d ,引起体系发 生一个dG的变化。 对 的理解: 1)量纲:J.mol-1 2) 强度性质,与体系的物质的量无关 3)对同一化学反应来讲,其具体值与计量方程式写法有关 4)随着反应的进行,由于浓度发生变化,则B发生变化,引起变化, 所以不是一个定值。 r m G

§4,1反寇的等温方程和平衡常赵 2.平衡条件 用 , ∑y4。 △,G,判断都是等效的 (A,Gm)T.0 反应自发地向左进行,不可能自发 向右进行 (△,Gmhp=0 反应达到平衡 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 2. 平衡条件 用 , , 判断都是等效的 T P, G B B r m G r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行,不可能自发 向右进行 r m , ( ) 0 G T p = 反应达到平衡
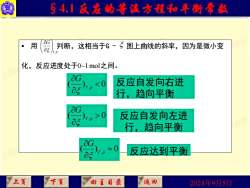
§4.1反寇的等温方程和平衡常款 用 判断,这相当于G-5图上曲线的斜率,因为是微小变 /T P 化,反应进度处于0~1mol之间。 0 反应自发向左进 行,趋向平衡 =0 反应达到平衡 上页 下页 回主目录 返国 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 • 用 判断,这相当于G - 图上曲线的斜率,因为是微小变 化,反应进度处于0~1 mol之间。 T P, G ( ) , 0 T p G 反应自发向右进 行,趋向平衡 ( ) , 0 T p G 反应自发向左进 行,趋向平衡 ( ) , = 0 T p G 反应达到平衡
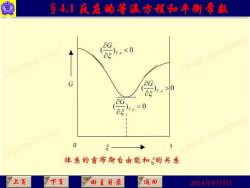
§4.1反寇的等温方程和年衡常赵 爱0 G 0 1 体亲的吉布斯自由能和的关系 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数

§4.1反寇的等温方程和平衡常赵 3.为什么会存在化学平衡? 在等温等压下,当反应物的化学势的总和大于产物化学势的总和 时反应自发向右进行,既然产物的化学势较低,为什么反应通常 不能进行到底,而是进行到一定程度达到平衡后就不再进行。 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进 行到底。只有逆反应与正反应相比小到可以忽略不计的反应,可 以粗略地认为可以进行到底。这主要是由于存在混合吉布斯自由 能的缘故。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 §4.1 反应的等温方程和平衡常数 3. 为什么会存在化学平衡? 在等温等压下,当反应物的化学势的总和大于产物化学势的总和 时反应自发向右进行,既然产物的化学势较低,为什么反应通常 不能进行到底,而是进行到一定程度达到平衡后就不再进行。 严格讲,反应物与产物处于同一体系的反应都是可逆的,不能进 行到底。只有逆反应与正反应相比小到可以忽略不计的反应,可 以粗略地认为可以进行到底。这主要是由于存在混合吉布斯自由 能的缘故
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第三章 溶液 solution.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第一章 热力学第一定律.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第十一章 表面现象.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第十章 电解与极化作用.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)绪论.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第二十三章 类脂、萜类、甾族、生物碱.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第二十二章 氨基酸、多肽、蛋白质和核酸.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第二十一章 碳水化合物-糖 Carbohydrates saccharides.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第二十章 杂环化合物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十九章 含硫、磷和硅的化合物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十八章 其它含氮化合物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十六章 不饱和羧酸和取代羧酸.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十五章 羧酸衍生物.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十四章 羧酸.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十三章 不饱和醛酮,取代醛酮,紫外光谱.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十二章 醛和酮.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十一章 醚.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第十章 醇、酚.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第九章 核磁共振谱、红外光谱和质谱.ppt
- 河南师范大学:《有机化学》课程教学资源(PPT课件)第八章 芳香化合物.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第五章 相平衡.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第七章 化学动力学.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第八章 电解质溶液.ppt
- 河南师范大学:《物理化学》课程教学资源(PPT课件)第九章 可逆电池.ppt
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验一 醋酸纤维薄膜电泳分离核苷酸.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验二 菜花(花椰莱)中核酸的分离和鉴定.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验三 酵母RNA的提制(浓盐法).doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验四 甲醛滴定法测定氨基氮.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验五 蛋白质的水解和氨基酸的纸层析法分离.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验六 蛋白质含量测定(考马斯亮蓝G-250法).doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验七 小麦萌发前后淀粉酶活力的比较.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验九 酶的基本性质.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验十 脲酶Km值测定.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验十一 蛋白质脱盐.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验十二 聚丙烯酰胺凝胶电泳.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验十三 蛋白质的两性性质及等电点的测定.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验十四 还原糖和总糖含量的测定.doc
- 河南农业大学:《生物化学》课程教学资源(实验指导)实验十六 用阳离子交换树脂摄取氯化钠.doc
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第一章 核酸化学 Chemistry Is the Logic of Biological Phenomena.ppt
- 河南农业大学:《生物化学》课程PPT教学课件(本科双语教学)第三章 酶 Protein Structures.ppt
