内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷10(试题)

普化无机试卷 班级 姓名」 分数 一、选择题(共15题30分) 欲除去CuSO4酸性溶液中少量F心,加入下列试剂效果最好的是. A)氨水 (B)NaOH C)HS水 (D)CuXOH)-CO 用反应Zn+2Ag一2Ag+Zn2组成原电池,当Zm2和Ag均为1mol·dm3, 在298.15K时,该电池的标准电动势E9为 (A)E=2(Ag'/Ag)-(ZnIZn) (B)Ee=(Ag'/Ag)2-(Zn2/Zn) (C)E-(Ag"IAg)-(Zn"Zn) (D)E=(Zn2/Zn)-(Ag'/Ag) 3.2分(6649) 6649 AgC1在纯水中的溶解度比在0.10mol·dm3NaC1溶液中的溶解度大:.() (AgC:Km=1.77×1010 (A)约7.5×103倍 B)约75×10倍 (C)约75倍 (D)不是以上数据 6a2分0ou1 已知NHs(g)的△rH日=46kJ·mor',H-H键能为435kJ·mol,N=N键能为941 kmor,则一H键的平均键能kmor为 (A)-382 B)1169 (C)382 (D)-l169 5.2分(0885) 0885 一级反应的半衰期与反应物初始浓度的关系为.。 (A)成正比 B)成反比 (C)无关 (D)立方根成正比 6.2分(0506) 0506 在523K时,PCl,(g)一PC1g)+Clg),K9=1.85,则反应的△,G(J·mo 为 (A)2.67 (C26.38
普化无机试卷 班级 姓名 分数 一、选择题 ( 共 15 题 30 分 ) 1. 2 分 (1562) 1562 欲除去 CuSO4 酸性溶液中少量 Fe3+,加入下列试剂效果最好的是.( ) (A) 氨水 (B) NaOH (C) H2S 水 (D) Cu2(OH)2CO3 2. 2 分 (0767) 0767 用反应 Zn + 2Ag+ 2Ag + Zn2+ 组成原电池,当[Zn2+]和[Ag+ ]均为 1 mol·dm-3, 在 298.15 K 时,该电池的标准电动势 E 为. ( ) (A) E = 2 (Ag+ /Ag) – (Zn2+/Zn) (B) E = [ (Ag+ /Ag)] 2– (Zn2+/Zn) (C) E = (Ag+ /Ag) – (Zn2+/Zn) (D) E = (Zn2+/Zn) – (Ag+ /Ag) 3. 2 分 (6649) 6649 AgCl 在纯水中的溶解度比在 0.10 mol·dm-3 NaCl 溶液中的溶解度大:.( ) (AgCl:Ksp = 1.77 10-10) (A) 约 7.5 103倍 (B) 约 7.5 102倍 (C) 约 75 倍 (D) 不是以上数据 4. 2 分 (0414) 0414 已知 NH3(g)的 f Hm = -46 kJ·mol-1,H— H 键能为 435 kJ·mol-1,NN 键能为 941 kJ·mol-1,则 N— H 键的平均键能(kJ·mol-1 )为.( ) (A) -382 (B) 1169 (C) 382 (D) -1169 5. 2 分 (0885) 0885 一级反应的半衰期与反应物初始浓度的关系为. ( ) (A) 成正比 (B) 成反比 (C) 无关 (D) 立方根成正比 6. 2 分 (0506) 0506 在 523 K时,PCl5 (g) PCl3 (g) + Cl2 (g), K p = 1.85,则反应的 rGm (kJ·mol-1 ) 为. ( ) (A) 2.67 (B) -2.67 (C) 26.38 (D) -2670

32分a59 按照软硬酸碱理论,下列反应不能按正向进行的是. (A)Cas +2HO- →CaOH2+HS (B)HgF:+Bel →Hgl2+BeF (C)CH,Hgl+HCI →CH,HgCI+HI (D)[AgCI]+2CN->[Ag(CN)2T+2cr 8n03分(6709 用铬(相对原子质量=52)的碱性溶液按下列半反应电镀一片金属: Cro+4HO+6e>Cr+80H 若电流是96.5A,如果要镀出52g铬需用的时间是 .( (A)2005 B)300s (C)400s D)600s 9.2分(7408) 7408 N(SH和N(CHb都是Lewis碱,其碱性. (A)N(SiH)3>N (CH:) (B)N(SiH3)Hg2Cl2+Sn 12.2分(0623) 0623 0.1mol·dm3H,PO,溶液中,下述关系错误的是 .( (A)H门>0.1mol·dm3 (B)[OH]>[PO] (C)[H,PO ][HPO] (D)HPo<0.1mol·dm3
7. 2 分 (1595) 1595 按照软硬酸碱理论,下列反应不能按正向进行的是.( ) (A) CaS + 2H2O Ca(OH)2 + H2S (B) HgF2 + BeI2 HgI2 + BeF2 (C) CH3HgI + HCl CH3HgCl + HI (D) [AgCl]+ 2CN [Ag(CN)2 ] + 2Cl 8. 2 分 (6705) 6705 用铬(相对原子质量 = 52)的碱性溶液按下列半反应电镀一片金属: CrO 2 4 + 4H2O + 6e Cr + 8OH 若电流是 96.5 A,如果要镀出 5.2 g 铬需用的时间是. ( ) (A) 200 s (B) 300 s (C) 400 s (D) 600 s 9. 2 分 (7408) 7408 N (SiH3 )3和 N (CH3 )3都是 Lewis 碱,其碱性.( ) (A) N (SiH3)3 > N (CH3)3 (B) N (SiH3)3 0.1 mol·dm-3 (B) [OH] > [ PO4 3] (C) [ H2PO4 ] > [ HPO4 2] (D) [H3PO4] < 0.1 mol·dm-3

82分00 下列各组物质中,不能稳定存在的一组是 .() (A)CoO:,CeOz,CrO: (B)GeCla,TiCl,VOCl (C)Cul,TIl,Aul (D)BiCls.TI,CeCl 2分6m 正极为饱和甘汞电极,负极为玻璃电极,分别插入以下各种溶液,组成四种电池,使电 池电动势最大的溶液是, (A)0.10mol·dm3HAc B)0.10mol·dm3 HCOOH (C)0.10mol·dm3NaAc (D)0.10mol·dm3HCl 15.2分(0617) 0612 如果0.1mol·dm3HCN溶液中0.01%的HCN是电离的,那么氧氰酸的电离常数 是. (A)102 (B)103 (C)107 (D)10 二、填空题(共10题20分) 如果发现了第121号元素M,则其所在周期数为一,所在族为;其金属活 泼性较同族其它元素要 :其特征氧化态的氧化物化学式为 2分9 AgCIO:在苯中的溶解性明显高于在烷烃中的溶解性,用Lwis酸碱性质对此事实作出 的解释是 2分3 锌钡白(俗称立德粉Lithopone)是由 组成的:可由 和 _反应制造它。 2分 HPO2和Cu2反应的化学方程式是 其反应的电池电动势是 (°(Cu2*/Cu)=0.34V,p°(HPO/HP02)=-0.50V)
13. 2 分 (7694) 7694 下列各组物质中,不能稳定存在的一组是.( ) (A) Co2O3,CeO2,CrO3 (B) GeCl4,TiCl4,VOCl2 (C) CuI,TlI,AuI (D) BiCl5,TlI3,CeCl4 14. 2 分 (3723) 3723 正极为饱和甘汞电极,负极为玻璃电极,分别插入以下各种溶液,组成四种电池,使电 池电动势最大的溶液是.( ) (A) 0.10 mol·dm-3 HAc (B) 0.10 mol·dm-3 HCOOH (C) 0.10 mol·dm-3 NaAc (D) 0.10 mol·dm-3 HCl 15. 2 分 (0617) 0617 如果 0.1 mol·dm-3 HCN 溶液中 0.01% 的 HCN 是电离的,那么氢氰酸的电离常数 是. ( ) (A) 10-2 (B) 10-3 (C) 10-7 (D) 10 二、填空题 ( 共 10 题 20 分 ) 16. 2 分 (0937) 0937 如果发现了第 121 号元素 M,则其所在周期数为_,所在族为_;其金属活 泼性较同族其它元素要_;其特征氧化态的氧化物化学式为_。 17. 2 分 (1939) 1939 AgClO4在苯中的溶解性明显高于在烷烃中的溶解性,用 Lewis 酸碱性质对此事实作出 的解释是 。 18. 2 分 (1235) 1235 锌钡白(俗称立德粉 Lithopone)是由_组成的;可由_ _和_反应制造它。 19. 2 分 (7338) 7338 H3PO2和 Cu2+反应的化学方程式是 。 其反应的电池电动势是 。 ( (Cu2+/Cu) = 0.34 V, (H3PO3/H3PO2) = -0.50 V)

20.2分(1917) 1917 判断相对Lewis碱性(1)(但Si20和HC)zO:(2)(HSi)N和(HCbN:其中较强的是 ,(2) 2L.2分(7634) 7634 下列各离子的额色为: (1)Cr(H2O) (2)CucI- (3)Fe(H,O) (4)Ni(NH3) 22.2分(1944) 1944 氮化锂与液氨作用的反应方程式为 252g2分1528 《梦溪笔谈)记载“信州铅山具有苦泉,流以为涧。挹其水熬之,则成胆矾,.。熬 胆矾铁釜,久之亦化为铜。”苦泉中之水称胆水。胆矾、胆水是 和 。表示“铁釜化为铜”过程的反应方程式是: 24.2分(1297 1297 不用热力学数据判断LiF(s)+Cs(s)=Li(s)+CsF(s)反应进行的方向 是 一因为 25.2分(7672) 7672 d区和p区金屈自上而下族氧化态稳定性变化的趋势为d区 p 三、计算题(共3题30分) 26.10分(1098)
20. 2 分 (1917) 1917 判断相对 Lewis 碱性(1) (H3Si)2O 和(H3C)2O;(2) (H3Si)3N 和(H3C)3N ;其中较强的是 (1) ,(2) 。 21. 2 分 (7634) 7634 下列各离子的颜色为: (1) Cr(H O) 2 6 3 。 (2) CuCl 4 2 。 (3) Fe(H O) 2 6 3 。 (4) Ni(NH )3 6 2 。 22. 2 分 (1944) 1944 氮化锂与液氨作用的反应方程式为 。 23. 2 分 (1528) 1528 〈梦溪笔谈〉记载“信州铅山具有苦泉,流以为涧。挹其水熬之,则成胆矾,.。熬 胆矾铁釜,久之亦化为铜。” 苦泉中之水称胆水 。 胆矾、胆水是_和 _。表示“铁釜化为铜”过程的反应方程式是: _。 24. 2 分 (1297) 1297 不 用 热 力 学 数 据 判 断 LiF(s) + CsI(s) = LiI(s) + CsF(s) 反 应 进 行 的 方 向 是 ,因为 。 25. 2 分 (7672) 7672 d区和 p 区金属自上而下族氧化态稳定性变化的趋势为 d 区 ,p 区 。 三、计算题 ( 共 3 题 30 分 ) 26. 10 分 (1098)

1098 金属钾具有体心立方品格,已知K原子半径为0.231m,相对原子质量39.1,计算 ()K原子的空间利用率:(2)K的密度。 27.10分(1161) 1161 用AgNO,、NH·H,O、NHNO,配制成的1.0dm溶液中,其浓度依次为1.0xI02 8.0×102,2.0mol·dm3.25℃时,K,(NH)=1090,假设配离子产物只有AgNH,1, 其稳定常数为K。=1016。计算该溶液的pH值及Ag和NH;的平衡浓度。 28.10分(4142) 414 原电池:Cu|Cu21.0mol·dm‖AuCL40.10mol·dm.C(0.10mol·dm3)lAu 己知:9e(AuAu)=1.50V,e(AuClz/Au)=1.00V,pe(CCu)=0.34V ()写出两极反应和电池反应: (2)来原电池的电动 (③)求电池反应的平衡常数: (4)求AuCI的K。 四、问答题(共4题20分) u分0 试设计以钛白粉为原料制备纯金属钛的方法步骤,并写出主要反应方程式。 指出下列反应中的酸与碱: ()FeCl+Cr→FeCl] (2)r+l2—→15 (3)[SnCls]-+(CO)sMnCI->(CO)sMn-SnCl:+cr 31.5分(7481) 7481 根据Pauling规则判断下述分子的结构式: H,PO,pK1=2.12:H,PO,pK1=1.80:H,PO2,pK=2.0
1098 金属钾具有体心立方晶格,已知 K 原子半径为 0.231 nm,相对原子质量 39.1,计算: (1) K 原子的空间利用率;(2) K 的密度。 27. 10 分 (1161) 1161 用 AgNO3、NH3·H2O、NH4NO3 配制成的 1.0 dm3溶液中,其浓度依次为 1.0 10-2, 8.0 10-2,2.0 mol·dm-3。25℃时,Ka ( NH4 ) = 10 –9.70,假设配离子产物只有 Ag(NH3 ) 2 , 其稳定常数为 K 稳 = 107.16。计算该溶液的 pH 值及 Ag+ 和 NH3的平衡浓度。 28. 10 分 (4142) 4142 原电池:Cu│Cu2+(1.0 mol·dm-3 )‖AuCl4 - (0.10 mol·dm-3 ), Cl- (0.10 mol·dm-3 )│Au 已知: (Au3+/Au) = 1.50 V, (AuCl 4 /Au) = 1.00 V, (Cu2+/Cu) = 0.34 V (1) 写出两极反应和电池反应; (2) 求原电池的电动势; (3) 求电池反应的平衡常数; (4) 求 AuCl 4 的 K 稳。 四、问答题 ( 共 4 题 20 分 ) 29. 5 分 (1604) 1604 试设计以钛白粉为原料制备纯金属钛的方法步骤,并写出主要反应方程式。 30. 5 分 (1930) 1930 指出下列反应中的酸与碱: (1) FeCl3 + Cl [FeCl4 ] (2) I+ I2 I 3 (3) [SnCl3] + (CO)5MnCl (CO)5Mn-SnCl3 + Cl 31. 5 分 (7481) 7481 根据 Pauling 规则判断下述分子的结构式: H3PO4,pKa1 = 2.12;H3PO3,pKa1 = 1.80;H3PO2,pKa = 2.0
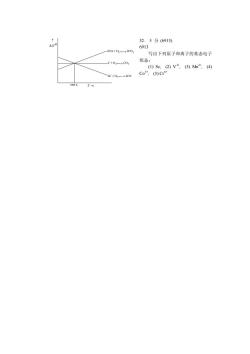
32.5分(6913) 6913 2C0+0,→2C0, 写出下列原子和离子的基态电子 C+0,c0组态 (1)Sc,(2)V,(3)Mm2,(4) 2C+0:-→2C0 Co+,(⑤)Cr+ T→
32. 5 分 (6913) 6913 写出下列原子和离子的基态电子 组态 : (1) Sc, (2) V3+, (3) Mn2+, (4) Co3+, (5) Cr6+ 1000 K T G 2C + O 2 2CO C + O 2 CO 2 2CO + O 2 2CO 2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷9(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷10(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷9(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷7(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷7(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷8(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷8(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷5(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷5(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷6(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷6(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷4(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷3(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷3(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷4(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷2(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷2(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷1(答案).pdf
- 内蒙古科技大学:《基础化学》课程教学实验指导(有机化学、无机化学、分析化学、物理化学).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷11(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷11(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷12(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷12(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷13(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷13(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷14(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷14(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷15(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷1(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(无机化学)试卷15(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷1(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷2(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷2(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷3(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷3(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷5(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷4(答案).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷5(试题).pdf
- 内蒙古科技大学:《基础化学》课程试题习题(分析化学)试卷4(试题).pdf
