《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-5/6

第五章酸碱平衡与酸碱滴定法 acid-base equilibrium and titration 5.1溶液中的酸碱反应与平衡 5.2酸碱组分平衡浓度与分布分数 5.3溶液中的H+浓度计算 5.4对数图解法 5.5酸碱缓冲溶液 5.6 酸碱指示剂 5.7酸碱滴定原理 5.8终点误差 5.9酸碱滴定法的应用 5.10非水溶液酸碱滴定简介
1 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分平衡浓度与分布分数 5.3 溶液中的H+浓度计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用 5.10 非水溶液酸碱滴定简介 第五章 酸碱平衡与酸碱滴定法 (acid-base equilibrium and titration)

5.7 酸碱滴定原理 > 强酸强碱的滴定 一元弱酸弱碱的滴定 多元酸和混合酸的滴定 1 的变化 pH 2 3 4 3.1 5. 溶園 因素 2
Analytical Chemistry 2 酸碱滴定原理 ➢ 强酸强碱的滴定 ➢ 一元弱酸弱碱的滴定 ➢ 多元酸和混合酸的滴定 1.滴定过程中pH值的变化 2.滴定曲线的形状 3.滴定突跃 4.指示剂的选择 5. 影响滴定突跃的因素

571 强酸(碱)的滴定 强碱滴定强酸 以0.1000mol/LNa0H滴定20.00mL0.1000mo/LHC为例 NaOH+HCI NaCH+H,O (1)滴定开始前:HCI 按HCI计算pH,pH=1.00 (2)计量点前:HCl(剩余)+NaCI 按剩余HCI计算pH 山东置子大军 Analytical Chemistry 3
Analytical Chemistry 3 以0.1000mol/L NaOH滴定20.00 mL 0.1000 mol/L HCl为例 强酸(碱)的滴定 NaOH+HCl = NaCl+H2 O 一、 强碱滴定强酸 (1)滴定开始前: HCl 按HCl计算pH, pH=1.00 (2)计量点前:HCl(剩余)+NaCl 按剩余HCl计算pH

>加入18.00mLNa0H(=0.90) 日1=20.00-18.0)×0.1000 =5.3×10-3molL 20.00+18.00 pH=2.28 >加入19.98mLNa0H(计量点前0.1%,=0.999,差约半滴) H*]=20.00-19.98)x0.100 pH=4.30 20.00+19.98 =5.0×105moL (3)化学计量点:NaCI(a=1.00) 按H20计算pH,[H]=107mol/L,pH=7.00 山本理王大军 Analytical Chemistry A
Analytical Chemistry 4 ➢加入18.00mL NaOH (a=0.90) = 5.3×10 mol/L 20.00 +18.00 (20.00 -18.00)×0.1000 [H ] = + -3 pH=2.28 ➢加入19.98mL NaOH (计量点前0.1%,a=0.999,差约半滴) = 5.0×10 mol/L 20.00 +19.98 (20.00 -19.98)×0.1000 [H ] = + -5 pH=4.30 (3)化学计量点:NaCl (a=1.00) 按H2O计算pH, [H+ ] = 10-7 mol/L,pH=7.00

(4)计量点后:NaC+NaOH(过量) 按过量NaOH计算pH >加入20.02mLNa0H(计量点后0.1%,a=1.001,差约半滴) [0]=20.02-20.0)×0.10 20.00+20.02 0=5.0×105molL p0H=4.30 pH=9.70 >加入22.00mLNa0H(a=1.10) [0H]=(2.00-20.00)×0.100 20.00+22.00 =4.8×103moL p0H=2.32 pH=11.68 加东理2大深 Analytical Chemistry 5
Analytical Chemistry 5 (4)计量点后:NaCl+NaOH(过量) 按过量NaOH计算pH ➢加入20.02mL NaOH(计量点后0.1% ,a=1.001,差约半滴) = 5.0×10 mol/L 20.00 + 20.02 (20.02 - 20.00)×0.1000 [OH ] = - -5 pOH=4.30 ➢加入22.00mL NaOH (a=1.10) pOH=2.32 = 4.8×10 mol/L 20.00 + 22.00 (22.00 - 20.00)×0.1000 [OH ] = - -3 pH=9.70 pH=11.68
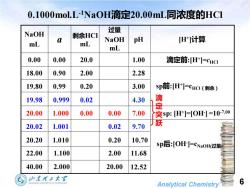
0.1000mol.L1NaOH滴定20.00mL同浓度的HC1 NaOH 过量 2 剩余HC】 NaOH pH [H]计算 mL mL mL 0.00 0.00 20.0 1.00 滴定前H]=cHC 18.00 0.90 2.00 2.28 19.80 0.99 0.20 3.00 Sp前:H]=CHC(剩余) 19.98 0.999 0.02 4.30 定 20.00 1.000 0.00 0.00 7.00 突sp:H]=[OH=10-7.00 20.02 1.001 0.02 9.70 跃 20.20 1.010 0.20 10.70 sp后:[OH=CNaoHO过量 22.00 1.100 2.00 11.68 40.00 2.000 20.00 12.52 山东理王大军 Analytical Chemistry 6
Analytical Chemistry 6 0.1000mol.L-1NaOH滴定20.00mL同浓度的HCl 40.00 2.000 20.00 12.52 22.00 1.100 2.00 11.68 sp后:[OH- ]=cNaOH(过量) 20.20 1.010 0.20 10.70 20.02 1.001 0.02 9.70 20.00 1.000 0.00 0.00 7.00 sp: [H+ ]=[OH- ] =10-7.00 19.98 0.999 0.02 4.30 19.80 0.99 0.20 3.00 sp前:[H+ ]=cHCl(剩余) 18.00 0.90 2.00 2.28 滴定前:[H+ 0.00 0.00 20.0 1.00 ]=cHCl [H+ pH ]计算 过量 NaOH mL 剩余HCl mL a NaOH mL 滴 定 突 跃
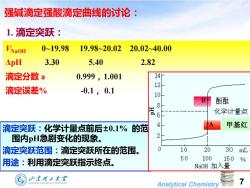
强碱滴定强酸滴定曲线的讨论: 1.滴定突跃: 0≈19.98 19.98~20.02 20.0240.00 △pH 3.30 5.40 2.82 滴定分数a 0.999,1.001 14 滴定误差% 12 -0.1,0.1 10 B 酚酞 6 化学计量点 滴定突跃:化学计量点前后±0.1%的范 甲基红 围内pH急剧变化的现象。 2 滴定突跃范围:滴定突跃所在的范围。 10 20 30 mL 用途:利用滴定突跃指示终点。 50 100 150% NaOH加入量 加东理王大? 7 Analytical Chemistry
Analytical Chemistry 7 1. 滴定突跃: 强碱滴定强酸滴定曲线的讨论: VNaOH 0~19.98 19.98~20.02 20.02~40.00 ΔpH 3.30 5.40 2.82 滴定分数 a 0.999,1.001 滴定误差% -0.1, 0.1 滴定突跃:化学计量点前后±0.1% 的范 围内pH急剧变化的现象。 滴定突跃范围:滴定突跃所在的范围。 用途:利用滴定突跃指示终点。 甲基红
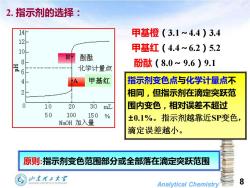
2.指示剂的选择: 14 甲基橙(3.1~4.4)3.4 10 甲基红(4.4~6.2)5.2 B 酚酞 8 化学计量点 酚酞(8.0~9.6)9.1 6 4 甲基红 指示剂变色点与化学计量点不 2 相同,但指示剂在滴定突跃范 10 20 30 mL 围内变色,相对误差不超过 50 100 150% NaOH加入量 ±0.1%。指示剂越靠近SP变色, 滴定误差越小。 原则:指示剂变色范围部分或全部落在滴定突跃范围 Analytical Chemistry 8
Analytical Chemistry 8 2. 指示剂的选择: 原则:指示剂变色范围部分或全部落在滴定突跃范围 指示剂变色点与化学计量点不 相同,但指示剂在滴定突跃范 围内变色,相对误差不超过 ±0.1%。指示剂越靠近SP变色, 滴定误差越小。 甲基橙(3.1~4.4)3.4 甲基红(4.4~6.2)5.2 酚酞(8.0~9.6)9.1 甲基红

3.影响滴定突跃范围的因素: 浓度NaOH→HC) 突跃范围 0.01→0.01 5.3~8.7 10.7 0.1→0.1 4.39.7 1→1 3.3~10.7 7 53 4. 溶液浓度增大10倍,突跃增加2个 3.3 pH单位。 c个,∠pH个,可选指示剂增多 >1.0mol/L,M03.1~4.4,R(4.4~6.2),PP(8.0~9.6) >0.1mol/L,MO,MR,PP >0.01mol/L,MR PP Analytical Chemistry 9
Analytical Chemistry 9 3. 影响滴定突跃范围的因素: 浓度(NaOH →HCl) 突跃范围 0.01→0.01 5.3~8.7 0.1→0.1 4.3~9.7 1→1 3.3~10.7 c↑,⊿pH↑,可选指示剂增多 10.7 9.7 8.7 7.0 5.3 4.3 溶液浓度增大 3.3 10倍,突跃增加2个 pH单位。 ➢ 1.0 mol/L, MO (3.1~4.4),MR (4.4~6.2),PP(8.0~9.6) ➢ 0.1mol/L, MO,MR,PP ➢ 0.01mol/L, MR ,PP
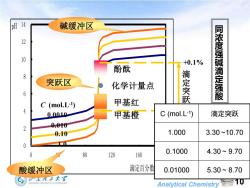
pH 14 碱缓冲区 12 10 +0.1% 酚酞 突跃区 化学计量点 6 滴定突跃 同浓度强碱滴定强酸 C (mol.L-1) 甲基红 0.0010 甲基橙 C(mol.L-1) 滴定突跃 2 0.00 0.10 1.000 3.30~10.70 0 80 120 160 0.1000 4.30~9.70 酸缓冲区 滴定百分数 0.01000 5.30~8.70 ⑤大¥ Analytical Chemistry10
Analytical Chemistry 10 0 2 4 6 8 1 0 1 2 1 4 0 4 0 8 0 120 160 200 滴定百分数% pH 甲基橙 甲基红 酚酞 C (mol.L-1 ) 同 浓 度 强 碱 滴 定 强 酸 化学计量点 1.0 0.10 0.010 0.0010 滴 定 突 跃 -0.1% +0.1% 酸缓冲区 突跃区 碱缓冲区 V(NaOH) 中和% pH 0.00 0.00 1.00 18.00 90.00 2.30 19.80 99.00 3.30 19.98 99.90 4.30 20.00 100.0 7.00 20.02 100.1 9.70 C (mol.L-1 ) 滴定突跃 1.000 3.30 ~10.70 0.1000 4.30 ~ 9.70 0.01000 5.30 ~ 8.70
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-6/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-1/4.ppt
- 《分析化学》课程教学资源(课件讲稿)第六章 配位滴定-2/4.pdf
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-3/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第4章 多组分系统热力学.pdf
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律_课件_第3章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律_课件_第2章 热力学第一定律.ppt
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定-4/6.pdf
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-3/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-2/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-1/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-3/3.ppt
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理-2/3.pdf
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-1.ppt
- 《分析化学》课程课后习题(含答案)第十章.doc
- 《分析化学》课程课后习题(含答案)第九章.doc
- 《分析化学》课程课后习题(含答案)第八章.doc
- 《分析化学》课程课后习题(含答案)第七章.doc
- 《分析化学》课程课后习题(含答案)第六章.doc
- 《分析化学》课程课后习题(含答案)第五章.doc
- 《分析化学》课程课后习题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第十章.doc
- 《分析化学》课程课后思考题(含答案)第八章.doc
- 《分析化学》课程课后思考题(含答案)第七章.doc
- 《分析化学》课程课后思考题(含答案)第六章.doc
