《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3

第七章 氧化还原滴定法 Oxidation-Reduction Titration 7.1氧化还原平衡 7.2氧化还原滴定原理 7.3氧化还原滴定的预处理 7.4常用的氧化还原滴定法 7.5氧化还原滴定结果的计算
1 7.1 氧化还原平衡 7.2 氧化还原滴定原理 7.3 氧化还原滴定的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算 第七章 氧化还原滴定法 (Oxidation-Reduction Titration)

7.4 氧化还原滴定的方法 高锰酸钾法 重铬酸钾法 碘量法 山东理工大军 Analytical Chemistry 2
Analytical Chemistry 2 高锰酸钾法 重铬酸钾法 碘量法 氧化还原滴定的方法

7.41 KMnO法 一、 概述 氧化能力 KMnO4,强氧化剂 还原产物 与plH有关 强酸性: Mn04+8Ht+5e=Mn2++4H20 E0=1.51y 微酸性、中性或弱碱性: Mn04+2H20+3e=Mn02+40H E0=0.59v NaOH浓度大于2moL1的碱性介质: Mn04+e=Mn042- E0=0.564V 加东理2大? Analytical Chemistry 3
Analytical Chemistry 3 一、概述 KMnO4,强氧化剂 氧化能力 还原产物 与pH有关 强酸性: MnO4 - + 8 H+ + 5e = Mn2+ + 4H2O Eө =1.51v 微酸性、中性或弱碱性: MnO4 - + 2H2O + 3e = MnO2 + 4OH- Eө =0.59v NaOH浓度大于2mol·L-1的碱性介质: MnO4 - + e = MnO4 2- Eө =0.564v KMnO4法
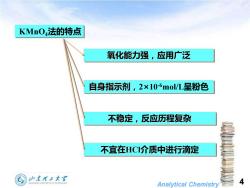
KMnO4法的特点 氧化能力强,应用广泛 自身指示剂,2×10-6mo/L呈粉色 不稳定,反应历程复杂 不宜在HC介质中进行滴定 少本理子大军 Analytical Chemistry 4
Analytical Chemistry 4 KMnO4法的特点 氧化能力强,应用广泛 自身指示剂,2×10-6mol/L呈粉色 不稳定,反应历程复杂 不宜在HCl介质中进行滴定
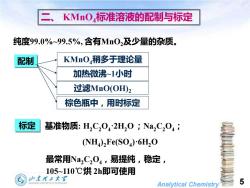
二、KMnO,标准溶液的配制与标定 纯度99.0%~99.5%,含有Mn0,及少量的杂质。 配制 KMnO,稍多于理论量 加热微沸~1小时 过滤MnO(OHD2 棕色瓶中,用时标定 标定 基准物质:H2C2042H20;Na2C204 (NH)Fe(SO)6HO 最常用Na,C,04,易提纯,稳定 105~110℃烘2h即可使用 加东理2大军 Analytical Chemistry 5
Analytical Chemistry 5 二、 KMnO4标准溶液的配制与标定 纯度99.0%~99.5%, 含有MnO2及少量的杂质。 标定 基准物质: H2C2O4·2H2O ;Na2C2O4; (NH4 ) 2Fe(SO4 )·6H2O 配制 棕色瓶中,用时标定 加热微沸~1小时 过滤MnO(OH)2 KMnO4稍多于理论量 最常用Na2C2O4,易提纯,稳定, 105~110℃烘 2h即可使用
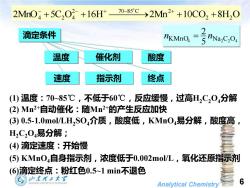
2MnO4+5C,O2+16H 70-85c→2Mn2++10C02+8H20 滴定条件 5VINa.C.O 温度 催化剂 酸度 速度 指示剂 终点 (1)温度:70~85℃,不低于60℃,反应缓慢,过高H,C,04分解 (2)Mn2+自动催化:随Mn2+的产生反应加快 (3)0.5-1.0mol/LH,S0,介质,酸度低,KMn04易分解,酸度高, H2C204易分解: (④)滴定速度:开始慢 (⑤)KMnO4自身指示剂,浓度低于0.002mo/L,氧化还原指示剂 (6)滴定终点:粉红色0.5~1min不退色 G》也本理王大¥ Analytical Chemistry 6
Analytical Chemistry 6 2MnO 5C O 16H 2Mn 10CO2 8H2 O 2 70~85 C 2 4 + 2 4 + ⎯⎯ ⎯→ + + − − + + KMnO4 5 Na2 C2 O4 2 n = n 指示剂 终点 催化剂 酸度 速度 温度 滴定条件 (1) 温度:70~85℃,不低于60℃,反应缓慢,过高H2C2O4分解 (2) Mn2+自动催化:随Mn2+的产生反应加快 (3) 0.5-1.0mol/LH2 SO4介质,酸度低,KMnO4易分解,酸度高, H2C2O4易分解; (4) 滴定速度:开始慢 (5) KMnO4自身指示剂,浓度低于0.002mol/L,氧化还原指示剂 (6)滴定终点:粉红色0.5~1 min不退色

三 、KMnO4法应用示例 (1)直接滴定法-H,0,测定 2MnO4+5H,02+16H=2Mn2++502个+8H,0 5 NH202=nKMnOa 2 加东理王大军 Analytical Chemistry
Analytical Chemistry 7 三、 KMnO4法应用示例 (1) 直接滴定法-H2O2测定 H2 O2 KMnO4 2 5 n = n 2MnO 5H O 16H 2Mn 5O2 8H2 O 2 4 + 2 2 + = + + − + +

(2)间接滴定法-Ca2+的测定 Ca2++C20}→CaC204↓H→H2C204 KMn04→CO2 (a)溶解:CaC03+H+=Ca2++C02+H,0 (b)转化:Ca2++C,042=CaC204↓ (c)沉淀溶解:CaC204+Ht→Ca2++C20,2 (d滴定: 2MnO4+5C,O}+16H+=2Mn2++10C0,+8H,O -nKMnOa 山东理王大军 Analytical Chemistry 8
Analytical Chemistry 8 (a)溶解:CaCO3 +H+ = Ca2+ +CO2 +H2O (b)转化:Ca2+ +C2O4 2- =CaC2O4 ↓ (c)沉淀溶解:CaC2O4 +H+ →Ca2+ +C2O4 2- (d)滴定: (2) 间接滴定法-Ca2+的测定 2 KMnO 2 2 4 H 2 4 2 2 4 2 Ca + C O ⎯→CaC O ⎯⎯→H C O ⎯⎯ ⎯4→CO + + − 2MnO 5C O 16H 2Mn 10CO2 8H2 O 2 2 4 + 2 4 + = + + − − + + Ca KMnO4 2 5 n = n
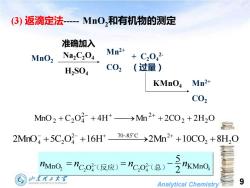
(3)返滴定法-MnO,和有机物的测定 准确加入 Na2C204 Mn2+ MnO2 C2042 H2S04 C02 (过量) KMnO Mn2+ C02 Mm02+C202+4H+→Mn2++2C02+2H20 2Mn04+5C,0}+16Ht70-85c→2Mm2++10C02+8H,0 hMn0,=nc,o(反应)=nc,0(总)- 夕东程子大军 Analytical Chemistry 9
Analytical Chemistry 9 MnO2 准确加入 Na2C2O4 H2SO4 Mn2+ CO2 + C2O4 2- (过量) KMnO4 Mn2+ CO2 4 2 2 4 2 2 2 4 MnO O O KMnO 2 5 n n n n C C = (反应) − = (总) − − 2MnO 5C O 16H 2Mn 10CO2 8H2 O 2 70~85 C 2 4 + 2 4 + ⎯⎯ ⎯→ + + − − + + MnO C O 4H Mn 2CO2 2H2 O 2 2 2 + 2 4 + ⎯→ + + − + + (3) 返滴定法- MnO2和有机物的测定

(4)化学需氧量Chemical Oxygen Demand CODMn[GB] 表示水体受还原性物质(主要是有机物)污染程度的综合 性指标。它是指水体易被强氧化剂氧化的还原性物质所消耗的 氧化剂所相当的氧量,以mg/L表示。 KMnO 试样 标液KMnO4 KMnO标液Na,C,O4 NazC2O HzS0沸水加热(过量) (过量) 2Mn04+5C20+16H+→2Mn2++10C02+8H20 Mn04_5e→Mh2+ n0, 5 nKMnO,(反应) 024e→2H20 KNnO多y-子mNaC0, {[C(+小kMn0,-号(CP)Na,co,}M,×1000 Wo2 (mg/L)=
Analytical Chemistry 10 (4) 化学需氧量Chemical Oxygen Demand CODMn[GB] 表示水体受还原性物质(主要是有机物)污染程度的综合 性指标。它是指水体易被强氧化剂氧化的还原性物质所消耗的 氧化剂所相当的氧量,以 mg / L 表示。 O2 4 KMnO(反应) 4 5 n = n 试样 标液KMnO4 H2SO4沸水加热 KMnO4 (过量) 标液Na2C2O4 Na2C2O4 (过量) KMnO4 2MnO 5C O 16H 2Mn 10CO2 8H2 O 2 2 4 + 2 4 + ⎯→ + + − − + + − ⎯⎯5 → 2+ MnO4 Mn e O2 ⎯⎯4e →2H2 O ( KMnO(总) 4 Na2 C2 O4 ) 5 2 4 5 = n − n s 1 2 KMnO N a C O O o (mg/L) ( ) } 1000 5 2 {[ ( )] 4 5 2 2 4 2 4 2 V C V V CV M w + − =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第4章 多组分系统热力学.pdf
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律_课件_第3章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律_课件_第2章 热力学第一定律.ppt
- 《物理化学》课程教学资源(课件讲稿)第0章 绪论.pdf
- 《物理化学》课程教学课件(PPT讲稿)01章 气体.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-3/4.ppt
- 《分析化学》课程教学资源(课件讲稿)第六章 配位滴定-2/4.pdf
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-1/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-6/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-5/6.ppt
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定-4/6.pdf
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-3/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-2/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-1/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-3/3.ppt
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理-2/3.pdf
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-1.ppt
- 《分析化学》课程课后习题(含答案)第十章.doc
- 《分析化学》课程课后习题(含答案)第九章.doc
- 《分析化学》课程课后习题(含答案)第八章.doc
