《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律_课件_第3章 热力学第二定律

归东理子大 SHANDONG UNIVERSITY OF TECHNOLOGY 第三章 热力学第二定律 不可能把热从低温 物体传到高温物体, 而不引起其它变化 The Second Law of Thermodynamics 2 2025/4/2
2 2025/4/2 2 第三章 不可能把热从低温 物体传到高温物体, 而不引起其它变化

第三章热力学第二定律 中东理工大 SHANDONG UNIVERSITY OF TECHNOLOGY §3.1 自发变化的共同特征 §3.2 热力学第二定律 §3.3 Carnot定理 §3.4 熵的概念 §3.5 Clausius?不等式与熵增加原理 §3.6 热力学基本方程与T-S图 §3.7 熵变的计算 §3.8 熵和能量退降 §3.9 热力学第二定律的本质和熵的统计意义 3 2025/4/2
3 2025/4/2 3 第三章 热力学第二定律 §3.1 自发变化的共同特征 §3.2 热力学第二定律 §3.3 Carnot定理 §3.4 熵的概念 §3.5 Clausius不等式与熵增加原理 §3.6 热力学基本方程与T-S图 §3.7 熵变的计算 §3.8 熵和能量退降 §3.9 热力学第二定律的本质和熵的统计意义

第三章热力学第二定律 力东露子大 SHANDONG UNIVERSITY OF TECHNOLOGY §3.10 Helmholtz和Gibbs自由能 §3.11 变化的方向与平衡条件 §3.12 △G的计算示例 §3.13 几个热力学函数间的关系 §3.14 热力学第三定律及规定熵 2025/4/2
4 2025/4/2 4 第三章 热力学第二定律 §3.10 Helmholtz和Gibbs自由能 §3.11 变化的方向与平衡条件 §3.13 几个热力学函数间的关系 §3.12 G 的计算示例 §3.14 热力学第三定律及规定熵

力东理子大彩 SHANDONG UNIVERSITY OF TECHNOLOGY 在一定条件下,一化学变化或物理变化能不能自 动发生?能进行到什么程度?这就是过程的方向、 限度问题。 历史上曾有人试图用第一定律中的状态函数U、H来判断 过程的方向,其中比较著名的是“Thomson-Berthelot规 则”。其结论:凡是放热反应都能自动进行;而吸热反应均 不能自动进行。 但研究结果发现,不少吸热反应仍能自动进行。高温下的水 煤气反应Cs)+H2O(g)→C0(g+H2(g)就是一例。 热力学第一定律只能告诉人们一化学反应的能量效 应,但不能解决化学变化的方向和限度问题
5 在一定条件下,一化学变化或物理变化能不能自 动发生? 能进行到什么程度? 这就是过程的方向、 限度问题。 历史上曾有人试图用第一定律中的状态函数U、H来判断 过程的方向,其中比较著名的是“Thomson-Berthelot 规 则 ” 。其结论:凡是放热反应都能自动进行;而吸热反应均 不能自动进行。 但研究结果发现,不少吸热反应仍能自动进行。高温下的水 煤气反应C(s)+H2O(g)→CO(g)+H2 (g)就是一例。 热力学第一定律只能告诉人们一化学反应的能量效 应,但不能解决化学变化的方向和限度问题

东理王大深 SHANDONG UNIVERSITY OF TECHNOLOGY 人类经验说明:自然界中一切变化过程都是有方向和限 度的,且是自动发生的,称为“自发过程”Spontaneous process。 如: 方向 限度 决定因素 热:高温→低温 温度均匀 温度 电流:高电势→低电势 电势相同 电势 气体:高压→低压 压力相同 压力 钟摆:动能→热 静止 热功转化 那么决定一切自发过程的方向和限度的共同因 素是什么?
6 人类经验说明:自然界中一切变化过程都是有方向和限 度的,且是自动发生的,称为“自发过程” Spontaneous process 。 如: 方向 限度 热: 高温→低温 温度均匀 电流:高电势→低电势 电势相同 气体:高压→低压 压力相同 钟摆:动能→热 静止 决定因素 温度 电势 压力 热功转化 那么决定一切自发过程的方向和限度的共同因 素是什么?

§3.1自发过程的共同特征-自发过程邀程函麼 LOGY 1.理想气体自由膨胀: 要使系统恢复原状, 2=W=△U=△H=0,△>0 可经定温压缩过程 ()r△U=0,△H=0,2=-W≠0, 臺 膨胀 压缩 PpVpT 结果环境对气体做功W,气体对环境放出热Q,环 境是否能恢复原状,决定于热Q能否全部转化为功 W而不引起任何其它变化
7 §3.1自发过程的共同特征-自发过程与可逆过程的区别 1.理想气体自由膨胀: Q=W=U=H=0, V>0 结果环境对气体做功W,气体对环境放出热Q ,环 境是否能恢复原状,决定于热Q能否全部转化为功 W而不引起任何其它变化 要使系统恢复原状, 可经定温压缩过程 真 空 p1 ,V1 ,T p2 ,V2 ,T p1 ,V1 ,T ( )T U=0, H=0, Q=-W0, 膨胀 压缩
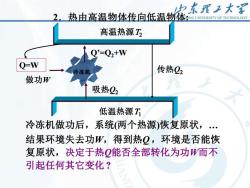
归东理工大 2,热由高温物体传向低温物体NG UNIVERSTTY OF TECHNOLOGY 高温热源乃 Q'=Q2+W Q-W 冷冻机 传热22 做功W 吸热22 低温热源T 冷冻机做功后,系统(两个热源)恢复原状,. 结果环境失去功W,得到热Q,环境是否能恢 复原状,决定于热Q能否全部转化为功W而不 引起任何其它变化?
8 2.热由高温物体传向低温物体: 冷冻机做功后,系统(两个热源)恢复原状,. 结果环境失去功W,得到热Q ,环境是否能恢 复原状,决定于热Q能否全部转化为功W而不 引起任何其它变化 ? 低温热源T1 高温热源T2 传热Q2 吸热Q2 做功W Q’=Q2+W Q=W
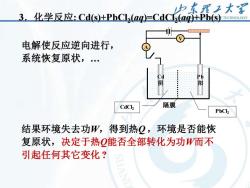
中东理子大 3.化学反应:Cds)+PbCL2(ag=CdC5(ag+Pb(S TECINOLOGY 电解使反应逆向进行, 系统恢复原状, 阴 阳 CdCk 隔膜 PbCl 结果环境失去功W,得到热Q,环境是否能恢 复原状,决定于热Q能否全部转化为功而不 引起任何其它变化?
9 3.化学反应: Cd(s)+PbCl2 (aq)=CdCl2 (aq)+Pb(s) 电解使反应逆向进行, 系统恢复原状,. 结果环境失去功W,得到热Q ,环境是否能恢 复原状,决定于热Q能否全部转化为功W而不 引起任何其它变化 ? Cd 阴 Pb 阳 A V 隔膜 PbCl2 CdCl2

口东翟王大 人类经验总结: SHANDONG UNIVERSITY OF TECHNOLOGY “功可以自发地全部变为热,但热不可 能全部变为功,而不引起任何其它变 化” 一切自发过程都是不可逆过程,而且 他们的不可逆性均可归结为热功转换过 程的不可逆性,因此,他们的方向性都可用 热功转化过程的方向性来表达
10 人类经验总结: “功可以自发地全部变为热,但热不可 能全部变为功,而不引起任何其它变 化”。 一切自发过程都是不可逆过程, 而且 他们的不可逆性均可归结为热功转换过 程的不可逆性,因此,他们的方向性都可用 热功转化过程的方向性来表达

力东理子大 SHANDONG UNIVERSITY OF TECHNOLOGY 自发变化某种变化有自动发生的趋势,一旦发生就 无需借助外力,可自动进行,这种变化称为自发变化 自发变化的共同特征一不可逆性任何自发变化的逆 过程是不能自动进行的。例如: (1) 焦耳热功当量中功自动转变成热; (2) 气体向真空膨胀; (3) 热量从高温物体传入低温物体; (4) 浓度不等的溶液混合均匀; (5) 锌片与硫酸铜的置换反应等, 它们的逆过程都不能自动进行。当借助外力,系统 恢复原状后,会给环境留忑不可磨灭的影响
11 2025/4/2 11 自发变化 某种变化有自动发生的趋势,一旦发生就 无需借助外力,可自动进行,这种变化称为自发变化 自发变化的共同特征—不可逆性 任何自发变化的逆 过程是不能自动进行的。例如: (1) 焦耳热功当量中功自动转变成热; (2) 气体向真空膨胀; (3) 热量从高温物体传入低温物体; (4) 浓度不等的溶液混合均匀; (5) 锌片与硫酸铜的置换反应等, 它们的逆过程都不能自动进行。当借助外力,系统 恢复原状后,会给环境留下不可磨灭的影响
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律_课件_第2章 热力学第一定律.ppt
- 《物理化学》课程教学资源(课件讲稿)第0章 绪论.pdf
- 《物理化学》课程教学课件(PPT讲稿)01章 气体.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 教材 物理化学-傅献彩第五版上册(高等教育出版社).pdf
- 《物理化学》课程教学资源(A)Ⅱ 教材 物理化学-傅献彩第五版下册(高等教育出版社).pdf
- 《物理化学》课程教学资源(A)Ⅱ 教材 物理化学学习及考研指导(科学出版社).pdf
- 山东理工大学:《物理化学》课程授课教案(讲义,讨论稿,A Ⅱ).doc
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅰ 课件 第4章 多组分系统热力学.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-3/4.ppt
- 《分析化学》课程教学资源(课件讲稿)第六章 配位滴定-2/4.pdf
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-1/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-6/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-5/6.ppt
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定-4/6.pdf
