《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3

第七章 氧化还原滴定法 Oxidation-Reduction Titration 7.1氧化还原平衡 7.2氧化还原滴定原理 7.3氧化还原滴定的预处理 7.4常用的氧化还原滴定法 7.5氧化还原滴定结果的计算
1 7.1 氧化还原平衡 7.2 氧化还原滴定原理 7.3 氧化还原滴定的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算 第七章 氧化还原滴定法 (Oxidation-Reduction Titration)

7.2 氧化还原滴定原理 722 氧化还原滴定曲线 在1mol/LH2S04介质中,用0.1000mol/LCe4+滴定20.0mL 0.1000mol/LFe2+溶液。 Ce++Fe2+=Ce3++Fe3+ Fe3++e-Fe2+ E92=0.68v Ce++e=Ce3+ E91=1.44v g △E°n1.44-0.68 0.059 0.059 =12.88 山东用王大军 Analytical Chemistry 2
Analytical Chemistry 2 在1 mol/L H2SO4 介质中,用0.1000 mol/L Ce4+ 滴定20.0 mL 0.1000 mol/L Fe2+溶液。 + + + + + = + 4 2 3 3 Ce Fe Ce Fe 氧化还原滴定曲线 12.88 0.059 1.44 0.68 0.059 lg ' ' = − = = E n K + + + = 3 2 Fe e Fe 0.68v ' 2 = E + + + = 4 3 Ce e Ce 1.44v ' 1 = E 氧化还原滴定原理

滴定至任何一点达到平衡时,体系中两电对的电位相等: E=E9+0059l18Ccm Ccw=E°2+0.0591 Ce四 Ce 滴定过程中电势的计算 1、滴定前: 空气氧化产生少量的Fe3+,组成Fe3+Fe2+电对,但cc3+未知, 故不可算 加东理王大军 Analytical Chemistry 3
Analytical Chemistry 3 滴定至任何一点达到平衡时,体系中两电对的电位相等: Ce(III) ' Ce(IV) 1 0.059lg C C E = E + Fe(II) ' Fe(III) 2 0.059lg C C = E + 1、滴定前: 空气氧化产生少量的Fe3+ ,组成Fe3+/Fe2+电对,但 cFe3+未知, 故不可算 滴定过程中电势的计算
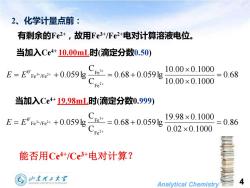
2、化学计量点前: 有剩余的Fe2+,故用Fe3+/Fe2+电对计算溶液电位。 当加入Ce4+10.00mL时(滴定分数0.50) E=E°e*me*+0.0591g一e=0.68+0.0591g 10.00×0.1000 510.00×0.1000 =0.68 Fe2 当加入Ce4+19.98mL时(滴定分数0.999) 0.059 Ce=0.68+0.059g 9.98×0.100 0.02×0.100 2=0.86 能否用Ce4+/Ce3+电对计算? 山东大军 Analytical Chemistry 4
Analytical Chemistry 4 2、化学计量点前: 有剩余的Fe2+ ,故用Fe3+/Fe2+电对计算溶液电位。 当加入Ce4+ 10.00mL时(滴定分数0.50) 0.68 10.00 0.1000 10.00 0.1000 0.68 0.059lg C C 0.059lg 2 3 3 2 Fe Fe Fe /Fe 0 = = + = + + + + + E E 当加入Ce4+ 19.98mL时(滴定分数0.999) 0.86 0.02 0.1000 19.98 0.1000 0.68 0.059lg C C 0.059lg 2 3 3 2 Fe Fe Fe /Fe 0 = = + = + + + + + E E 能否用Ce4+/Ce3+电对计算?

3、化学计量点后: Ce4+过量,按Ce4+/Ce3+电对计算 当加入Ce4+20.02mL时(滴定分数1.001) E=E'ceIce*+0.0591g Ce4+ 0.02×0.1000 =1.44+0.0591g20.00×0.1000 =1.26 加东理王大军 Analytical Chemistry 5
Analytical Chemistry 5 3、化学计量点后: Ce4+过量,按Ce4+/Ce3+电对计算 当加入Ce4+ 20.02mL时(滴定分数1.001) 1.26 20.00 0.1000 0.02 0.1000 1.44 0.059lg C C 0.059lg 3 4 4 3 Ce Ce Ce /Ce 0 = = + = + + + + + E E

4、化学计量点时 C e4+ Es=E°cec+0.0S9Bcc Er-E0059C e3 Fe2+ C 2EFE+E+0050鸡C Fe3+ Fe2+ sp时 E9ce1co++E9ee21.44+0.6 3=1.06 2 2 少东理工大军 Analytical Chemistry 6
Analytical Chemistry 6 4、化学计量点时 + + = + + + 2 3 3 2 Fe Fe Fe /Fe 0 s p C C E E 0.059lg + + = + + + 3 4 4 3 Ce Ce Ce /Ce 0 s p C C E E 0.059lg + + + + + + + + = + + 2 3 3 4 4 3 3 2 Fe Fe Ce Ce Fe /Fe 0 Ce /Ce 0 s p C C C C 2E E E 0.059lg sp时 2 4 3 3 2 Fe /Fe 0 Ce /Ce 0 sp + + + + + = E E E 1.06 2 1.44 0.68 = + = 4+ = 2+ 3+ = 3+ Ce Fe Fe Ce C C ,C C
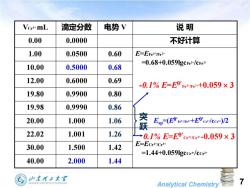
Vce艹mL 滴定分数 电势V 说明 0.00 0.0000 不好计算 1.00 0.0500 0.60 E=EFe3/Fe2 =0.68+0.059 lgcFe+/cFe24 10.00 0.5000 0.68 12.00 0.6000 0.69 -0.1%E=E9'rme2+0.059×3 19.80 0.9900 0.80 19.98 0.9990 0.86 20.00 1.000 1.06 窦 Esp-(E0're+E0ce/cce)/2 22.02 1.001 1.26 →0.1%E=E9'ce+ce*-0.059×3 30.00 1.500 1.42 E=Ece艹/CeH =1.44+0.059gcce+/cce+ 40.00 2.000 1.44 加东理2大? Analytical Chemistry
Analytical Chemistry 7 VCe4+ mL 滴定分数 电势 V 说 明 0.00 0.0000 不好计算 1.00 0.0500 0.60 E=EFe3+/Fe2+ =0.68+0.059lgcFe3+/cFe2+ 10.00 0.5000 0.68 12.00 0.6000 0.69 19.80 0.9900 0.80 19.98 0.9990 0.86 20.00 1.000 1.06 Esp=(EFe3+/Fe2++ECe4+/cCe3+)/2 22.02 1.001 1.26 E=ECe4+/Ce3+ =1.44+0.059lgcCe4+/cCe3+ 30.00 1.500 1.42 40.00 2.000 1.44 突 跃 -0.1% E=EFe3+/Fe2++0.059 3 0.1% E=ECe4+/Ce3+ -0.059 3

E 1.26 1.06 0.86 % 当n,≠n2时? 山本理王大军 Analytical Chemistry 8
Analytical Chemistry 8 1.26 1.06 0.86 E % 当n1 n2 时?

一、化学计量点(通式) n201+n1R2=n2R1+n102 Ep=E91+0.059,n n CR C02 E=”+0.0S9gCR n (n+n2)Esp=nEo+nE h,E+n,Eg n1+n2 E91: 氧化剂电对对应的条件电极电势 E9,:还原剂电对对应的条件电极电势 以上公式仅适用于对称电对 山东理王大 Analytical Chemistry 9
Analytical Chemistry 9 1 1 R O 1 1 ' sp C C lg 0.059 n E = E + 2 2 R O 2 2 ' sp C C lg 0.059 n E = E + ' 2 2 ' 1 2 sp 1 1 ) (n + n E = n E + n E 1 2 1 1 2 2 / n n n E n E Es p + + = 以上公式仅适用于对称电对 E ´1: 氧化剂电对对应的条件电极电势 E ´2 :还原剂电对对应的条件电极电势 一、化学计量点(通式) n2O1+n1R2=n2R1+n1O2

滴定突跃 设滴定剂E,被滴定剂E9 (1)sp前:-0.1%(a=99.9%) E=g+0059g999=时+005 g103 n 0.1 n (2)sp后:+0.1%(a=100.1%) E=+0059g00=g+0059 103 n 100.0 n 突跃范围: 0.059 g103 0.059 g103 n mistry 10
Analytical Chemistry 10 二、滴定突跃 ' 2 ' 1 设滴定剂E ,被滴定剂E (1) sp前:-0.1% (a=99.9%) 3 2 ' 2 2 ' 2 lg10 0.059 0.1 99.9 lg 0.059 n E n E = E + = + (2) sp后:+0.1% (a=100.1%) -3 1 ' 1 1 ' 1 lg 10 0.059 100.0 0.1 lg 0.059 n E n E = E + = + 突跃范围: + + -3 1 ' 1 3 2 ' 2 lg10 0.059 lg10 ~ 0.059 n E n E
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第4章 多组分系统热力学.pdf
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律_课件_第3章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律_课件_第2章 热力学第一定律.ppt
- 《物理化学》课程教学资源(课件讲稿)第0章 绪论.pdf
- 《物理化学》课程教学课件(PPT讲稿)01章 气体.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-3/4.ppt
- 《分析化学》课程教学资源(课件讲稿)第六章 配位滴定-2/4.pdf
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-1/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-6/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-5/6.ppt
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定-4/6.pdf
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-3/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-2/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-1/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-3/3.ppt
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理-2/3.pdf
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-1.ppt
- 《分析化学》课程课后习题(含答案)第十章.doc
- 《分析化学》课程课后习题(含答案)第九章.doc
- 《分析化学》课程课后习题(含答案)第八章.doc
- 《分析化学》课程课后习题(含答案)第七章.doc
