《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-3/6

第五章酸碱平衡与酸碱滴定法 (acid-base equilibrium and titration) 5.1溶液中的酸碱反应与平衡 5.2酸碱组分平衡浓度与分布分数 5.3溶液中的H浓度计算 5.4对数图解法 5.5酸碱缓冲溶液 5.6酸碱指示剂 5.7酸碱滴定原理 5.8终点误差 5.9酸碱滴定法的应用 5.10非水溶液酸碱滴定简介
1 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分平衡浓度与分布分数 5.3 溶液中的H+浓度计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用 5.10 非水溶液酸碱滴定简介 第五章 酸碱平衡与酸碱滴定法 (acid-base equilibrium and titration)

5.3 溶液中的H+浓度计算 强酸(碱)溶液 ·一元弱酸(碱)溶液 多元弱酸(碱)溶液 ·两性物质 ·混合酸碱溶液 少东理2大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 2
Analytical Chemistry 2 溶液中的H+浓度计算 • 强酸(碱)溶液 • 一元弱酸(碱)溶液 多元弱酸(碱)溶液 • 两性物质 • 混合酸碱溶液

531 强酸(强碱)溶液 一、一元强酸 浓度为cmol/L的HCI溶液 PBE [H]=[OH]+[CI] [H+]=[OH-]+c=k/H*]+c 整理得 [H]-cH]-k.=0 [H']=c+vc+4K 2 讨论,若允许误差士≤5%,有: (1)当c≥10-6mol/L时,H1=c; (2)当c≤10-8mol/L时,H1=[0H=10-7 (3)当108<c<10-6mol/L时,求解一元二次方程 Analytical Chemistry 3
Analytical Chemistry 3 强酸(强碱)溶液 浓度为c mol/L 的 HCl溶液 [H ] [OH ] [Cl ] PBE c k c w [H ] [OH ] /[H ] 整理得 [H ] [H ] 0 2 w c k 2 4 [H ] 2 Kw c c 讨论,若允许误差±≦5% ,有: (1)当c ≥10-6mol/L时, [H+] = c ; (2)当c ≤10 -8mol/L时, [H+] = [OH-]=10 -7 (3)当10-8< c <10-6mol/L时,求解一元二次方程 一、一元强酸

二、一元强碱,将H+换成OH即可 [OH-]=c+vc+4K 2 例 cHc=105.0或者 10-8.0moL,pH=? 0.10mo/LH2SO4溶液的pH? (Ko2=1.0×10-0.2) 山东翼2大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 4 二、一元强碱,将H+换成OH-即可 2 4 [OH ] 2 Kw c c 例 cHCl=10 -5.0 或者 10 -8.0 mol·L-1 , pH=? 0.10 mol/L H2SO4 溶液的pH ? (Ka2=1.0×10 -0.2)

532 弱酸(弱碱)溶液 一、一元弱酸(弱碱) 浓度为c。mol/L的HA溶液 溶液中平衡: HA→A H,0*←+H,0H→OH PBE: [H]=[A]+[OH] 解离平衡 [A]= K.[HA] Kw [OH-]= [H] [H] H*]= K[HA]Kw [H][H+] 精确式 [H*P+K[H*P-(Kc+K)[H*]-KK=0 中东上多 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 5
Analytical Chemistry 5 弱酸(弱碱)溶液 HA A H [H ] [HA] [A ] a K H H3O H2O OH H [H ] [A ] [OH ] 溶液中平衡: PBE: [H ] [OH ] w K [H ] [H ] [HA] [H ] a w K K 浓度为ca mol/L 的 HA溶液 [H ] [H ] ( )[H ] 0 3 2 a a Kw KaKw K K c 精确式 解离平衡

通常在相对误差不大于5%的前提下,根据具体情况近似处理。 [H']=K.[HA]+K KaCa≥10Kw 水的离解不计 c/K,<100时,弱酸浓度比 [H]=√K.HA] 较小,电离程度不太弱, 离解部分不能忽略不计 物料平衡 解离平衡 [HA]=c -[H*] [H']=K,(c-[H') 近似式 [H+]2+K。[H+]-Kaca=0w[H]= 上本理≥大罗 2 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 6 [H ] [HA] Ka Kw a a 10Kw K c [HA] [H ] a c [H ] ( [H ]) a K ca [H ] [HA] Ka [H ] a [H ] a a 0 2 K K c 2 4 [H ] a a 2 a a K K K c 近似式 物料平衡 解离平衡 通常在相对误差不大于5%的前提下,根据具体情况近似处理。 水的离解不计 c/Ka<100时,弱酸浓度比 较小,电离程度不太弱, 离解部分不能忽略不计
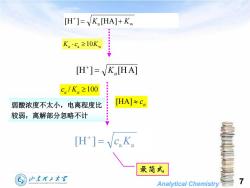
[H]=VK [HA]+K K。ca≥10K [H]=K[HA] ca/K。≥100 弱酸浓度不太小,电离程度比 [HA]≈ca 较弱,离解部分忽略不计 [H]=√cK。 最简式 山东翟王大军 7 Analytical Chemistry
Analytical Chemistry 7 [H ] [HA] Ka Kw a a 10Kw K c [H ] [HA] Ka / 100 a Ka c a [HA] c [H ] aKa c 最简式 弱酸浓度不太小,电离程度比 较弱,离解部分忽略不计

[H']=VK [HA]+Kw K。c。<10K [H]=K[HA]+K c/K2≥100 [HA]≈ca [Ht]=√caKa+Kw 近似式 少东理2大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 8
Analytical Chemistry 8 [H ] [HA] Ka Kw Ka Kw [H ] [HA] / 100 a Ka c a [HA] c a a Kw K c 10 [H ] caKa Kw 近似式

1、一元弱酸水溶液计算公式: cKa≥10Kw且c,/K2≥100[H]=Vc Ks cKa≥10Kw但c/K2<100 H]=-k:+vK:2+4Kc, 2 cKa<10Kw但ca/Ka≥100[H+]=cKa+Kw 归东翟王大 HANDONG UNIVERS1 Y OF TE INOLO分 Analytical Chemistry 9
Analytical Chemistry 9 caKa 10Kw但ca / Ka 100 1、一元弱酸水溶液[H+]计算公式: 10 / 100 caKa Kw且ca Ka a a [H ] c K 2 4 [H ] a a 2 a a K K K c caKa 10K w但ca / Ka 100 a a w [H ] c K K

例1计算0.10moL1HAc溶液的pH值。 解:已知c=0.10moL1,K,=1.8×10-5,cK。>10Kw 又因为c/K>100,故可采用最简式计算。 [H*]=VKc=1.8x105x0.10=1.34×103(mo1.L)pH=2.87 例2计算0.10moL1一氯乙酸(CH2ClC0OH)溶液的pH值。 解:已知c=0.10moL1,K2=1.4X10-3,cK,>10K 但c/K,<100,故要采用近似式计算。 [H]=-K,+K2+4Kc 2 =-1.4×103+V1.4×103)2+4×1.4×103×0.10 =1.12×10-2(mol●L-) 2 pH=1.96 少东理2大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 10
Analytical Chemistry 10 例2 计算0.10mol·L-1一氯乙酸(CH2ClCOOH)溶液的pH值。 例1 计算0.10mol·L-1HAc溶液的pH值。 , pH=2.87 解:已知c=0.10mol·L-1,Ka =1.8×10-5, 又因为c/Ka>100,故可采用最简式计算。 a Kw cK 10 [ ] 1.8 10 0.10 1.34 10 ( ) 5 3 1 H Ka c mol L 解:已知c=0.10mol·L-1,Ka =1.4×10-3, , 但c/Ka<100,故要采用近似式计算。 a Kw cK 10 2 4 [ ] 2 K K K c H a a a 1.12 10 ( ) 2 1.4 10 (1.4 10 ) 4 1.4 10 0.10 2 1 3 3 2 3 mol L pH=1.96
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定-4/6.pdf
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-5/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-6/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-1/4.ppt
- 《分析化学》课程教学资源(课件讲稿)第六章 配位滴定-2/4.pdf
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-3/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第4章 多组分系统热力学.pdf
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-2/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-1/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-3/3.ppt
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理-2/3.pdf
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-1.ppt
- 《分析化学》课程课后习题(含答案)第十章.doc
- 《分析化学》课程课后习题(含答案)第九章.doc
- 《分析化学》课程课后习题(含答案)第八章.doc
- 《分析化学》课程课后习题(含答案)第七章.doc
- 《分析化学》课程课后习题(含答案)第六章.doc
- 《分析化学》课程课后习题(含答案)第五章.doc
- 《分析化学》课程课后习题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第十章.doc
- 《分析化学》课程课后思考题(含答案)第八章.doc
- 《分析化学》课程课后思考题(含答案)第七章.doc
- 《分析化学》课程课后思考题(含答案)第六章.doc
- 《分析化学》课程课后思考题(含答案)第五章.doc
- 《分析化学》课程课后思考题(含答案)第三章.doc
