《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-2/6

第五章酸碱平衡与酸碱滴定法 acid-base equilibrium and titration 5.1溶液中的酸碱反应与平衡 5.2酸碱组分平衡浓度与分布分数 5.3溶液中的H+浓度计算 5.4对数图解法 5.5酸碱缓冲溶液 5.6 酸碱指示剂 5.7酸碱滴定原理 5.8终点误差 5.9酸减滴定法的应用 5.10非水溶液酸碱滴定简介
1 5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分平衡浓度与分布分数 5.3 溶液中的H+浓度计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用 5.10 非水溶液酸碱滴定简介 第五章 酸碱平衡与酸碱滴定法 (acid-base equilibrium and titration)

513 溶液中的其他相关平衡 明确几个基本概念: 1、酸度:溶液的氢离子浓度,也用pH表示。 2、碱度:溶液的氢氧根离子浓度,或pOH。 3、分析浓度:溶液中某种物质或组分的总浓度,又叫标 签浓度,用c表示。 4、平衡衡浓度:平衡衡体系中实际存在的某种型体的浓度, 用〔〕表示。 例如:0.1mol/LHCL、HAc溶液 HC1:c=0.1mol/L,〔Ht〕=0.1mol/L HAc c=0.1 mol/L, 〔H〕0.1mol/L 少本理子大军 〔HAc〕≠0.1mol/L Analytical Chemistry 2
Analytical Chemistry 2 明确几个基本概念 : 1、酸度:溶液的氢离子浓度,也用pH表示。 2、碱度:溶液的氢氧根离子浓度,或pOH。 3、分析浓度:溶液中某种物质或组分的总浓度,又叫标 签浓度,用c表示。 4、平衡浓度:平衡体系中实际存在的某种型体的浓度, 用〔 〕表示。 例如:0.1mol/LHCl、HAc溶液 HCl: c=0.1 mol/L, 〔H+ 〕 =0.1 mol/L HAc : c=0.1 mol/L, 〔H+ 〕≠0.1 mol/L 〔HAc〕≠0.1 mol/L 溶液中的其他相关平衡

一、物料平衡Mass Balance Equation MBE 在一个化学平衡体系中,某给定物质的总浓度(分析浓度) 与各有关形式平衡浓度之和相等。 例 NaH2PO4水溶液 MBE c [Na*]=[H,PO]+[H2PO ]+[HPO]+[PO] 加东理2大深 Analytical Chemistry 3
Analytical Chemistry 3 一、物料平衡 Mass Balance Equation MBE 在一个化学平衡体系中,某给定物质的总浓度(分析浓度) 与各有关形式平衡浓度之和相等。 MBE 例 NaH2PO4 水溶液 [Na ] [H PO ] [H PO ] [HPO ] [PO ] 3 4 2 3 4 2 4 4 + − − − c = = + + +

二、电荷平衡Charge Balance Equation CBE 溶液呈电中性,溶液中阳离子所带正电荷的量应等于阴离 子所带负电荷的量。 例 NaH,PO4水溶液 CBE Na*]+H]=H,PO4]+2[HPO42]+3PO43]+[OH于 山本理王大军 Analytical Chemistry 4
Analytical Chemistry 4 二、电荷平衡 Charge Balance Equation CBE 溶液呈电中性,溶液中阳离子所带正电荷的量应等于阴离 子所带负电荷的量。 CBE 例 NaH2PO4 水溶液 [Na ] [H ] [H PO ] 2[HPO ] 3[PO ] [OH ] 3 4 2 2 4 4 + + − − − − + = + + +

三、质子平衡式Proton Balance Equation PBE 溶液中的酸碱反应,得质子物质(碱)得到的质子的量 与失质子物质(酸)失去质子的量相等。 质子平衡式(PBE)建立的方法: (1)找出参考水准:通常选原始的酸碱组分或溶液 中大量存在的并与质子转移直接相关的酸碱组分。 (2)写出质子转移关系。 (3)根据得失质子的物质的量相等的原则,写出PBE。 山东理子大军 Analytical Chemistry
Analytical Chemistry 5 溶液中的酸碱反应,得质子物质(碱)得到的质子的量 与失质子物质(酸)失去质子的量相等。 质子平衡式(PBE)建立的方法: (1)找出参考水准:通常选原始的酸碱组分或溶液 中大量存在的并与质子转移直接相关的酸碱组分。 (2)写出质子转移关系。 (3)根据得失质子的物质的量相等的原则,写出PBE。 三、质子平衡式 Proton Balance Equation PBE
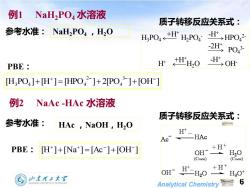
例1 NaH2PO4水溶液 质子转移反应关系式: 参考水准:NaH2PO4,H2O HPO+HHPO:H>HPO 2HP043 PBE H HHO H OH [H,PO4]+H]=HPO42]+2PO4]+[OH] 例2 NaAc-HAc水溶液 质子转移反应关系式: 参考水准: HAc NaOH,H2O Ac HAc PBE [H*]+[Na*]=[Ac-]+[OH-] +H+ OH H,O (CNaOH) (CNaOH) oH°二H,0 +H+ H3O+ 山东理王大军 Analytical Chemistry 6
Analytical Chemistry 6 参考水准: NaH2PO4 ,H2O 质子转移反应关系式: 例2 NaAc -HAc 水溶液 参考水准: HAc ,NaOH,H2O 质子转移反应关系式: PBE: [H ] [Na ] [Ac ] [OH ] + + − − + = + 例1 NaH2PO4 水溶液 [H PO ] [H ] [HPO ] 2[PO ] [OH ] 3 4 2 3 4 4 + − − − + = + + H3PO4 H2PO4 - HPO4 -H 2- + -2H+ -H+ PO4 3- H+ +H H2O OH- + +H+ PBE:

PBE的特点: (1)参考水准不出现在PBE中; (2)只有参与质子转移的型体才包含在PBE中; (3)等式其中一边的物质比参考水准的质子多,而且多 几个质子,相应的系数为几;等式另一边的物质比参考水 准的质子少,而且少几个质子,相应的系数为几。 g) 力东理王大军 Analytical Chemistry
Analytical Chemistry 7 PBE的特点: (1)参考水准不出现在PBE中; (2)只有参与质子转移的型体才包含在PBE 中; (3)等式其中一边的物质比参考水准的质子多,而且多 几个质子, 相应的系数为几;等式另一边的物质比参考水 准的质子少,而且少几个质子, 相应的系数为几

5.2 酸碱组分平衡浓度与分布分数 鉴别方法:低种瓶添再藤解水后,红添额色支深蓝持酒也变流,国雨色法:竹酒不色 原理:花青素酸碱 形式颜色不同 克红酒 惨服红酒 勾兑红酒 加随后变蓝加对前 加碱后变淡道加碱前 加碱后不变色加碱前 一定pH下,酸碱组分 在溶液中是怎样分布 紫甘薯花青素在不同PH值下的颜色变化 的? 力东理王大翟 可用AN阳7车TVOFTECHN0国 Analytical Chemistry 8
Analytical Chemistry 8 酸碱组分平衡浓度与分布分数 • 原理:花青素酸碱 形式颜色不同 一定pH下,酸碱组分 在溶液中是怎样分布 紫甘薯花青素在不同PH值下的颜色变化 的?

分布分数: 溶液中某酸碱组分的平衡浓度占其总浓度的分数。又称分布 系数。用6表示。 。=[某一型体 一元弱酸溶液 多元弱酸溶液 g) 山东理王大深 Analytical Chemistry 9
Analytical Chemistry 9 分布分数: 溶液中某酸碱组分的平衡浓度占其总浓度的分数。又称分布 系数。用 i 表示。 一元弱酸溶液 多元弱酸溶液 c [某一型体] i =

521 元酸(碱)的分布分数 一元弱酸的分布分数: HA亡H+A K。 [H][A] [HA] 8==[HA] [HA] [H] [HA]+[A] H*1+K 6=dA=A]= [A] K。 [HA]+[A] [H*]+Ka SmA+=1 δ,=f(Ka,pH) 山东理王大军 Analytical Chemistry 10
Analytical Chemistry 10 一元酸(碱)的分布分数 [HA] [H ][A ] + − Ka = 1 HA - [HA] [HA] [H ] [HA] [A ] [H ] a c K + + = = = = + + 0 A - [A ] [A ] [HA] [A ] [H ] a a K c K − − + = = = = + +f (K , p H) i = a H + HA + A 一、 一元弱酸的分布分数: + - =1 HA A δ δ
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-3/6.ppt
- 《分析化学》课程教学资源(课件讲稿)第五章 酸碱滴定-4/6.pdf
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-5/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-6/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-1/4.ppt
- 《分析化学》课程教学资源(课件讲稿)第六章 配位滴定-2/4.pdf
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-3/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《分析化学》课程教学课件(PPT讲稿)第五章 酸碱滴定-1/6.ppt
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-3/3.ppt
- 《分析化学》课程教学资源(课件讲稿)第三章 分析化学中的误差及数据处理-2/3.pdf
- 《分析化学》课程教学课件(PPT讲稿)第三章 分析化学中的误差及数据处理-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第一章 绪论-1.ppt
- 《分析化学》课程课后习题(含答案)第十章.doc
- 《分析化学》课程课后习题(含答案)第九章.doc
- 《分析化学》课程课后习题(含答案)第八章.doc
- 《分析化学》课程课后习题(含答案)第七章.doc
- 《分析化学》课程课后习题(含答案)第六章.doc
- 《分析化学》课程课后习题(含答案)第五章.doc
- 《分析化学》课程课后习题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第十章.doc
- 《分析化学》课程课后思考题(含答案)第八章.doc
- 《分析化学》课程课后思考题(含答案)第七章.doc
- 《分析化学》课程课后思考题(含答案)第六章.doc
- 《分析化学》课程课后思考题(含答案)第五章.doc
- 《分析化学》课程课后思考题(含答案)第三章.doc
- 《分析化学》课程课后思考题(含答案)第二章.doc
