《物理化学》课程教学资源(A)Ⅱ 课件 第11章 化学动力学基础(一)

第十一章化学动力学基础(一) 冰强2黑 §11.1化学动力学的任务和目的 §11.2化学反应速率的表示法 §11.3化学反应的速率方程 §11.4具有简单级数的反应 §11.5几种典型的复杂反应 *§11.6基元反应的微观可逆性原理 §11.7温度对反应速率的影响 *§11.8关于活化能 §11.9链反应 *§11.10拟定反应历程的一般方法
§11.1 化学动力学的任务和目的 第十一章 化学动力学基础(一) §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程 §11.4 具有简单级数的反应 §11.5 几种典型的复杂反应 *§11.6 基元反应的微观可逆性原理 §11.7 温度对反应速率的影响 *§11.8 关于活化能 §11.9 链反应 *§11.10 拟定反应历程的一般方法

§11.1化学动力学的任务和目的 域塑摆 INLAIESITEOF TECHNONIGY 1.化学热力学的研究对象和局限性 2.化学动力学的研究对象 3.化学动力学的基本任务 4.化学动力学的目的 5.化学动力学发展简史
§11.1 化学动力学的任务和目的 1. 化学热力学的研究对象和局限性 2. 化学动力学的研究对象 3. 化学动力学的基本任务 4. 化学动力学的目的 5. 化学动力学发展简史

§11.1化学动力学的任务和目的 冰2辉 1,化学热力学的研究对象和局限性 研究对象:研究化学变化的方向、能达到的最大限度以及外界 条件对平衡的影响。 局限性:化学热力学只能预测反应的可能性,但无法预料反应 能否发生?反应的速率如何?反应的机理如何?例如 △,G9/kJ.mol- N2+3H2→NH3(g)-16.63 H2+201→10(0 -237.19 热力学只能判断这两个反应都能发生,但如何使它发生,热 力学无法回答
§11.1 化学动力学的任务和目的 研究对象:研究化学变化的方向、能达到的最大限度以及外界 条件对平衡的影响。 局限性:化学热力学只能预测反应的可能性,但无法预料反应 能否发生?反应的速率如何?反应的机理如何?例如 1. 化学热力学的研究对象和局限性 能否发生?反应的速率如何?反应的机理如何?例如 2 2 3 2 2 2 1 3 ( ) 2 2 1 ( ) 2 N H NH g H O H O l 1 / 16.63 237.19 r m G kJ mol 热力学只能判断这两个反应都能发生,但如何使它发生,热 力学无法回答

§11.1化学动力学的任务和目的 距摆 BININLNIHSITL OF TEDRNONGY 2.化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及温度、 压力、催化剂、溶剂和光照等外界因素对反应速率的影响, 把热力学的反应可能性变为现实性 例如: 动力学认为: 1 +3H2→NH3(8) W2 需一定的T,p和催化剂 2 1 H2+ 502→H20(I) 点火,升温或催化剂
化学动力学研究化学反应的速率和反应的机理以及温度、 压力、催化剂、溶剂和光照等外界因素对反应速率的影响, 把热力学的反应可能性变为现实性 2. 化学动力学的研究对象 §11.1 化学动力学的任务和目的 动力学认为: 需一定的T,p和催化剂 点火,升温或催化剂 例如: 2 2 3 2 2 2 1 3 ( ) 2 2 1 ( ) 2 N H NH g H O H O l

§11.1化学动力学的任务和目的 冰2黑 PINTTOF TENOIG 3.化学动力学的基本任务 1、研究各种因素(浓度、温度、光、介质.)对 反应速率的影响。 2、揭示反应的机理(即反应实际进行的具体步骤)。 3、研究物质的结构与反应速率的关系
1、 研究各种因素(浓度、温度、光、介质)对 反应速率的影响。 3. 化学动力学的基本任务 §11.1 化学动力学的任务和目的 2、揭示反应的机理(即反应实际进行的具体步骤)。 3、研究物质的结构与反应速率的关系

§11.1化学动力学的任务和目的 强型探 INLAIESITEOF TECHNONIGY 4.化学动力学的目的 控制反应速率 得到预期的产品。 控制反应机理 不同的反应,往往速率相差很大,可分: 慢:如岩石风化,地壳中的某些反应。 中:几十秒~几十天范围一本课程主要研究对象。 快:离子反应,爆炸反应一现代动力学研究的活 跃领域,激光、分子束技术
控制反应速率 控制反应机理 得到预期的产品。 不同的反应,往往速率相差很大 往往速率相差很大,可分: 4.化学动力学的目的 §11.1 化学动力学的任务和目的 慢:如岩石风化,地壳中的某些反应 地壳中的某些反应。 中:几十秒 几十天范围—本课程主要 研究对象。 快:离子反应,爆炸反应—现代动力学研究的活 跃领域,激光、分子束技术

§11.1化学动力学的任务和目的 冰强2 5.化学动力学发展简史 质量作用定律 阿累尼乌斯公式 十九世纪后半叶 宏观动力学阶段 活化能 碰撞理论 过渡态理论 基元反应动力学阶段 链反应的发现 由于分子束和激光技术 二十世纪五十年代 的发展和应用,开创了 微观动力学阶段 分子反应动态学
5. 化学动力学发展简史 十九世纪后半叶 质量作用定律 阿累尼乌斯公式 宏观动力学阶段 活化能 碰撞理论 §11.1 化学动力学的任务和目的 二十世纪前叶 二十世纪五十年代 基元反应动力学阶段 由于分子束和激光技术 的发展和应用,开创了 分子反应动态学 碰撞理论 过渡态理论 链反应的发现 微观动力学阶段

§11.2 化学反应速率的表示法 2螺 INLNISITEOF TEDRNONGY 1.速度和速率 2.化学反应速率 3.化学反应速率的测定
§11.2 化学反应速率的表示法 1.速度和速率 2.化学反应速率 3.化学反应速率的测定

§11.2化学反应速率的表示法 冰强2黑 PINTTOF TENOIG 1. 速度和速率 速度 velocity 是矢量,有方向性。 速率 rate 是标量,无方向性,都是正值。 例如: R→P 速度 d[R] 0 dt dt 速率 dlRl_d[Pl>o dt dt
§11.2 化学反应速率的表示法 速度 velocity 是矢量,有方向性。 速率 rate 是标量 ,无方向性,都是正值。 例如: R P 1. 速度和速率 t t d[R] d[P] 0 0 d d 速度 t t d[R] d[P] 0 d d 速率 例如: R P
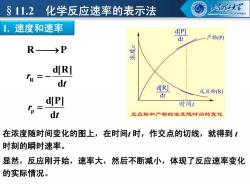
§11.2化学反应速率的表示法 2摆 INLAIESITEOF TECHNONIGY 1.速度和速率 d[P] -产物(P) R→P 娱 d[R] R=- dt d[R] 反应物R) dt dP] = 时间1 dt 反应物和产物的浓度随时间的变化 在浓度随时间变化的图上,在时间时,作交点的切线,就得到t 时刻的瞬时速率。 显然,反应刚开始,速率大,然后不断减小,体现了反应速率变化 的实际情况
R P r t R d[R] d 1. 速度和速率 §11.2 化学反应速率的表示法 在浓度随时间变化的图上,在时间t 时,作交点的切线,就得到 t 时刻的瞬时速率。 r t p d[P] d 显然,反应刚开始,速率大,然后不断减小,体现了反应速率变化 的实际情况
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 教材 物理化学-傅献彩第五版上册(高等教育出版社).pdf
- 《物理化学》课程教学资源(A)Ⅱ 教材 物理化学-傅献彩第五版下册(高等教育出版社).pdf
- 《物理化学》课程教学资源(A)Ⅱ 教材 物理化学学习及考研指导(科学出版社).pdf
- 山东理工大学:《物理化学》课程授课教案(讲义,讨论稿,A Ⅱ).doc
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第10章 电解与极化作用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第11章 化学动力学基础(一).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第12章 化学动力学基础(二).pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第13章 表面物理化学.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第14章 胶体与大分子溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)01章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学(电解质溶液).ppt
- 《物理化学》课程教学课件(PPT讲稿)表面现象.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学资源(A)Ⅱ 课件 第9章 可逆电池的电动势及其应用.pdf
- 《物理化学》课程教学资源(A)Ⅱ 课件 第8章 电解质溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)01章 气体.ppt
- 《物理化学》课程教学资源(课件讲稿)第0章 绪论.pdf
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第一定律_课件_第2章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 热力学第二定律_课件_第3章 热力学第二定律.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第4章 多组分系统热力学.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 相平衡_课件_第5章 相平衡.ppt
- 《物理化学》课程教学资源(A)Ⅰ 课件 第六章 化学平衡.pdf
- 《物理化学》课程教学课件(PPT讲稿)第六章 化学平衡_练习题_练习题.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第十章 吸光光度法-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第九章 重量分析-1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)第八章 沉淀滴定法(Precipitation Titrations).ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-3/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-2/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第七章 氧化还原-1/3.ppt
- 《分析化学》课程教学课件(PPT讲稿)第六章 配位滴定-4/4.ppt
