《物理化学》课程电子教案(PPT教学课件)第08章 电解与极化作用
物理化学电子教案一第八章 电解 与 极化作用 电解池 阴极曲线 阳极曲线 原电池 E可送-△E不可运 -E送十△E不可送 负极曲线 正 曲线 E送 7 电位 十0 电位 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 物理化学电子教案—第八章

第八章电解与极化作用 8.1分解电压 8.2极化作用 8.3电解时电极上的反应 8.4金属的电化学腐蚀与防腐 8.5化学电源 8.6辅导答疑 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 第八章 电解与极化作用 8.1 分解电压 8.2 极化作用 8.3 电解时电极上的反应 8.4 金属的电化学腐蚀与防腐 8.5 化学电源 8.6 辅导答疑

8.1理论分解电压 理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势 E(理论分解)=E(可逆) 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 8.1 理论分解电压 理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势 E E ( ) ( ) 理论分解 可逆 =
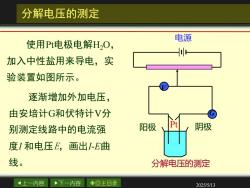
分解电压的测定 电源 使用Pt电极电解HO, H 加入中性盐用来导电,实 验装置如图所示。 逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强 阳极 阴极 度I和电压E,画出I-E曲 线。 分解电压的测定 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 分解电压的测定 使用Pt电极电解H2O, 加入中性盐用来导电,实 验装置如图所示。 逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强 度I 和电压E,画出I-E曲 线。 电源 分解电压的测定 阳极 Pt 阴极 V G
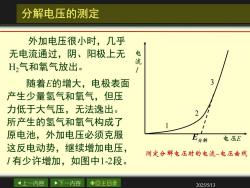
分解电压的测定 外加电压很小时,几乎 无电流通过,阴、阳极上无 电流 H,气和氧气放出。 随着E的增大,电极表面 3 产生少量氢气和氧气,但压 力低于大气压,无法逸出。 所产生的氢气和氧气构成了 原电池,外加电压必须克服 E分解 电压E 这反电动势,继续增加电压, 测定分解电压时的电流一电压曲线 I有少许增加,如图中1-2段。 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 分解电压的测定 外加电压很小时,几乎 无电流通过,阴、阳极上无 H2气和氧气放出。 随着 E的增大,电极表面 产生少量氢气和氧气,但压 力低于大气压,无法逸出。 所产生的氢气和氧气构成了 原电池,外加电压必须克服 这反电动势,继续增加电压, I 有少许增加,如图中 1 - 2段。 E I E 1 2 3
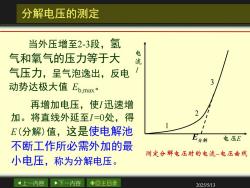
分解电压的测定 当外压增至2-3段,氢 气和氧气的压力等于大 电流 气压力,呈气泡逸出,反电 动势达极大值Ebmx· 再增加电压,使I迅速增 加。将直线外延至I=0处,得 E(分解)值,这是使电解池 分解 电压E 不断工作所必需外加的最 测定分解电压时的电流电压曲线 小电压,称为分解电压。 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 分解电压的测定 当外压增至2-3段,氢 气和氧气的压力等于大 气压力,呈气泡逸出,反电 动势达极大值 Eb,max。 再增加电压,使I 迅速增 加。将直线外延至I =0处,得 E(分解)值,这是使电解池 不断工作所必需外加的最 小电压,称为分解电压。 E I E 1 2 3

实际分解电压 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势n阴和阳),以及克服电 池电阻所产生的电位降R。这三者的加和就称为实 际分解电压。 E(分解)=E(可逆)+△E(不可逆)+R △E(不可逆)=7(阳)+阴) 显然分解电压的数值会随着通入电流强度的 增加而增加。 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 实际分解电压 ( ) ( ) ( ) ( ) ( ( ) ) E E E IR E = + + = + 分解 可逆 不 阳 可逆 不可逆 阴 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 和 ,以及克服电 池电阻所产生的电位降 。这三者的加和就称为实 际分解电压。 ( ) 阴 ( ) 阳 IR 显然分解电压的数值会随着通入电流强度的 增加而增加

8.2极化作用 极化(polarization) 当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极平衡电势E(阳,平)和阴 极平衡电势E阴,平)。 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对平衡电势的偏离称为电极的极化。 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 8.2 极化作用 极化(polarization) 当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极平衡电势 和阴 极平衡电势 。 E( ) 阳,平 E( ) 阴,平 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对平衡电势的偏离称为电极的极化

极化的类型 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析。 。上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 极化的类型 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析

极化的类型 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (2)电化学极化 电极反应总是分若干步进行,若其中一步反应 速率较慢,需要较高的活化能,为了使电极反应顺 利进行所额外施加的电压称为电化学超电势(亦称 为活化超电势),这种极化现象称为电化学极化。 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 极化的类型 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (2)电化学极化 电极反应总是分若干步进行,若其中一步反应 速率较慢,需要较高的活化能,为了使电极反应顺 利进行所额外施加的电压称为电化学超电势(亦称 为活化超电势),这种极化现象称为电化学极化
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程电子教案(PPT教学课件)第12章 胶体与大分子溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第11章 界面现象.ppt
- 《物理化学》课程电子教案(PPT教学课件)第10章 化学动力学基础(二).ppt
- 《物理化学》课程电子教案(PPT教学课件)第09章 化学动力学基础(一).ppt
- 《物理化学》课程复习题(无答案).doc
- 《物理化学》课程教学资源(各章授课教案).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验。专业类).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验,基础类).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅲ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅱ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅰ).doc
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定铁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定邻菲咯啉铁配合物的组成.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备及含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)紫外分光光度法测定苯酚的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)磺基水杨酸与Fe3 离子配合物稳定常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)人血清总胆固醇含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)阿司匹林含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)酸碱标准溶液的比较和标定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)配合物的生成和性质.ppt
- 《物理化学》课程电子教案(PPT教学课件)第05章 化学平衡.ppt
- 《物理化学》课程电子教案(PPT教学课件)第06章 电解质溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第07章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第04章 相平衡.ppt
- 《物理化学》课程电子教案(PPT教学课件)第03章 溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第01章 热力学第一定律及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第02章 热力学第二定律.ppt
- 《物理化学》课程电子教案(PPT教学课件)第00章 绪论.ppt
- 《生物化学》课程教学大纲 Biochemistry(上册).doc
- 《生物化学》课程教学大纲 Biochemistry(下册).doc
- 《生物化学》课程作业试题库(含参考答案).doc
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(3/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(1/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十七章 激素.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(2/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十五章 核酸的研究方法.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十四章 核酸的理化性质.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(4/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(3/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十章 酶动力学(酶促反应动力学).ppt
