《物理化学》课程电子教案(PPT教学课件)第07章 可逆电池的电动势及其应用
物理化学电子教案一第七章 可逆电沁的电动势及其应用 EN (A) 1.5 0 Fe B 1.0 (B) Fe2O3 0.5 腐蚀区 (D) Fe2+ (b) H20 -0.5 -1.0 (C) Fe (a) -1.5 H2 Ex 02468 101214 pH 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 物理化学电子教案—第七章

第七章可逆电池的电动势及其应用 7.1可逆电池和可逆电极 7.2电动势的测定 7.3可逆电池的书写方法及电动势的取号 7.4可逆电池的热力学 7.5电动势产生的机理 7.6电极电势和电池的电动势 7.7浓差电池和液体接界电势 78电动势测定的应用 7.9生物电化学 7.10辅导答疑 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 7.1 可逆电池和可逆电极 第七章 可逆电池的电动势及其应用 7.2 电动势的测定 7.9 生物电化学 7.3 可逆电池的书写方法及电动势的取号 7.4 可逆电池的热力学 7.5 电动势产生的机理 7.6 电极电势和电池的电动势 7.7 浓差电池和液体接界电势 7.8 电动势测定的应用 7.10 辅导答疑

7.1可逆电池和可逆电极 电化学与热力学的联系 组成可逆电池的必要条件 可逆电极的类型 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 7.1 可逆电池和可逆电极 电化学与热力学的联系 组成可逆电池的必要条件 可逆电极的类型

电化学与热力学的联系 热力学 rG1ER 电化学 (A,G)1.P.R Wimas =-nEF 桥梁公式: (A,GR= nEF 5 =-cEF 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 电化学与热力学的联系 桥梁公式: r , , f,max r m , , ( ) ( ) T P R T P R G W nEF nEF G zEF = = − = − = −
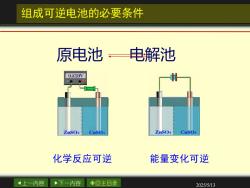
组成可逆电池的必要条件 原电池电解池 0.810V CuSO4 ZnSO4 CuSo4 化学反应可逆 能量变化可逆 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 组成可逆电池的必要条件 化学反应可逆 能量变化可逆 原电池 电解池

组成可逆电池的必要条件 例如有电池 Zn(s)ZnSOHCIAgCI(s)Ag(s) 作为原电池 (-)Zns)→Zn2++2e (+)2AgCI(s)+2e->2Ag(s)+2CI 净反应: Zn(s)+2AgCI(s)>2Ag(s)+ZnCl2 作为电解池 阴极:Zn2++2e→Zn(s) 阳极:2Ags)+2CI→2 AgCI(s)+2e 总反应:2Ags)+ZnCl2→Zn(s)+2AgCl(s) 上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 组成可逆电池的必要条件 净反应: Zn(s) +2AgCl(s) →2Ag(s) +ZnCl 2 例如有电池 - - 2 - ( )2AgCl(s) 2e 2Ag(s) 2Cl ( )Zn(s) Zn 2e + + → + − → + + 总反应: 2Ag(s) ZnCl Zn(s) 2AgCl(s) + 2 → + 作为电解池 - - 2 - 2Ag(s) 2Cl 2AgCl(s) 2e Zn 2e Zn(s) + → + 阴极: + + → 阳极: 作为原电池 Zn(s)|ZnSO4 ||HCl|AgCl(s) | Ag(s)

可逆电极的类型 (①)第一类电极 金属与其阳离子组成的电极 氢电极 〔氧电极 卤素电极 汞齐电极 (2)第二类电极 金属-难溶盐及其阴离子组成的电极 金属氧化物电极 (3)第三类电极 氧化-还原电极 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 可逆电极的类型 金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 汞齐电极 金属-难溶盐及其阴离子组成的电极 金属-氧化物电极 氧化-还原电极 ⑴第一类电极 ⑵第二类电极 ⑶第三类电极

第一类电极及其反应 电极 电极反应 M(a)M(s) M(a+tze→M(S) H (aH(p),Pt 2Ht(a+)+2e→H2(p) OH-(a.)H2(p),Pt 2H0+2e→H2(p)+20H(a.) H(a+)02(p),Pt 02p)+4Ht(a+)+4e→2H20 OH(a)O2(p),Pt 02(p)+2H20+4e→40H(a.) CI (a)Cl2(p),Pt Cl2(p)t2e→2C(a) Na'(a Na(Hg)(a) Na(a)+nHg+eNa(Hg),(a) 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 第一类电极及其反应 Na+ (a+ )|Na(Hg)(a) Na+ (a+ )+nHg+e- →Na(Hg)n (a) 电极 电极反应 Mz+ (a+ )|M(s) Mz+ (a+ )+ze - →M(s) H+ (a+ )|H2 (p),Pt 2H+ (a+ )+2e- →H2 (p) OH- (a- )|H2 (p),Pt 2H2O+2e- →H2 (p)+2OH- (a- ) H+ (a+ )|O2 (p),Pt O2 (p)+4H+ (a+ )+4e- →2H2O OH- (a- )|O2 (p),Pt O2 (p)+2H2O+4e- →4OH- (a- ) Cl- (a- )|Cl2 (p),Pt Cl2 (p)+2e- →2Cl- (a- )

第二类电极及其反应 电极 电极反应 CI(a)AgCI(s)Ag(s) AgCl(s)+eAg(s)+CI(a.) OH-(a)Ag2OAg(s) Ag2O(s)+H2O+2 e →2Ag(s)+20H(a) H(a)Ag2O(s)Ag(s) Ag20+2Ht(a+)+2e →2Ag(S)+H20 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 第二类电极及其反应 电极 电极反应 Cl- (a- )|AgCl(s)|Ag(s) AgCl(s)+e- →Ag(s)+Cl- (a- ) OH- (a- )|Ag2O|Ag(s) Ag2O(s)+H2O+2 e- →2Ag(s)+2OH- (a- ) H+ (a+ )|Ag2O(s)|Ag(s) Ag2O+2H+ (a+ )+2e- →2Ag(s)+H2O

第三类电极及其反应 电极 电极反应 Fe3+(a),Fe2+(a2)Pt Fe3+(a1)te→Fe2+(a2) Cu2(a),Cu(a2)Pt Cu2+(a1te→Cut(a2) Sn4(a),Sn2+(a2)Pt Sn4+(a1)+2e→Sn2+(a2) 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 第三类电极及其反应 电极 电极反应 Fe3+(a1 ), Fe2+(a2 )|Pt Fe3+(a1 )+e- →Fe2+(a2 ) Cu2+(a1 ), Cu+ (a2 )|Pt Cu2+(a1 )+e- →Cu+ (a2 ) Sn4+(a1 ), Sn2+(a2 )|Pt Sn4+(a1 )+2e- →Sn2+(a2 )
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程电子教案(PPT教学课件)第06章 电解质溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第05章 化学平衡.ppt
- 《物理化学》课程电子教案(PPT教学课件)第08章 电解与极化作用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第12章 胶体与大分子溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第11章 界面现象.ppt
- 《物理化学》课程电子教案(PPT教学课件)第10章 化学动力学基础(二).ppt
- 《物理化学》课程电子教案(PPT教学课件)第09章 化学动力学基础(一).ppt
- 《物理化学》课程复习题(无答案).doc
- 《物理化学》课程教学资源(各章授课教案).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验。专业类).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验,基础类).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅲ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅱ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅰ).doc
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定铁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定邻菲咯啉铁配合物的组成.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备及含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)紫外分光光度法测定苯酚的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)磺基水杨酸与Fe3 离子配合物稳定常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)人血清总胆固醇含量的测定.ppt
- 《物理化学》课程电子教案(PPT教学课件)第04章 相平衡.ppt
- 《物理化学》课程电子教案(PPT教学课件)第03章 溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第01章 热力学第一定律及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第02章 热力学第二定律.ppt
- 《物理化学》课程电子教案(PPT教学课件)第00章 绪论.ppt
- 《生物化学》课程教学大纲 Biochemistry(上册).doc
- 《生物化学》课程教学大纲 Biochemistry(下册).doc
- 《生物化学》课程作业试题库(含参考答案).doc
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(3/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(1/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十七章 激素.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(2/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十五章 核酸的研究方法.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十四章 核酸的理化性质.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(4/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(3/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十章 酶动力学(酶促反应动力学).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(2/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第九章 酶学通论.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(1/4).ppt
