《生物化学》课程教学课件(PPT讲稿)第九章 酶学通论
第八章酶学通论 Product (release
第八章 酶学通论

酶, enzyme 希腊语原意: in yeast 生命体内催化化学反应的物质 细胞中大部分球蛋白为酶
酶, enzyme 希腊语原意: in yeast 生命体内催化化学反应的物质 细胞中大部分球蛋白为酶

一、酶学研究史 19世纪中叶对发酵本质的探讨: 1857年Pasteur认为发酵分几个阶段进行,每一 步都有特定的酶参与,但酶只在活体细胞中才能起 作用。发酵是酵母细胞活动的结果。 1897年Buchner兄弟用酵母提取液实现发酵,证 明了酶可以离开细胞起作用。 酶的名称 1878年 Khne提出enzyme一词:“在酵母中” 1898年 Duclaux提出用后缀“ase”表示酶
19世纪中叶对发酵本质的探讨: 1857年 Pasteur认为发酵分几个阶段进行, 每一 步都有特定的酶参与, 但酶只在活体细胞中才能起 作用。发酵是酵母细胞活动的结果。 1897年 Büchner兄弟用酵母提取液实现发酵,证 明了酶可以离开细胞起作用。 酶的名称 1878年 Kühne提出enzyme一词:“在酵母中”。 1898年 Duclaux提出用后缀“ase”表示酶。 一、酶学研究史

酶学研究史 酶促动力学 1894年 Fisher提出酶与底物作用的“锁钥”学说 1913年 Michaelis和Menton米氏方程建立。 关于酶的化学本质的认识: 1833年Payen和Persoz从麦芽的水抽提物中用 酒精沉淀得到一种热不稳定物质,可使淀粉水解成 可溶性糖。 1926年Sumner首次从刀豆中得到脲酶结晶,并证 明其化学本质是蛋白质。 I982年Thomas R Cech,从四膜虫发现rRNA的自身 催化作用,并提出了核酶(ribozyme)的概念。 限制性内切酶的发现 1970年Restriction enzyme的发现→基因工程
酶促动力学 1894年 Fisher提出酶与底物作用的“锁钥”学说 1913年 Michaelis 和 Menton米氏方程建立。 关于酶的化学本质的认识: 1833年 Payen 和 Persoz从麦芽的水抽提物中用 酒精沉淀得到一种热不稳定物质,可使淀粉水解成 可溶性糖。 1926年 Sumner首次从刀豆中得到脲酶结晶,并证 明其化学本质是蛋白质。 1982年 Thomas R Cech从四膜虫发现rRNA的自身 催化作用,并提出了核酶(ribozyme)的概念。 限制性内切酶的发现 1970年 Restriction enzyme的发现→基因工程。 酶学研究史

二、酶是生物催化剂 ◆酶是一种催化剂 1.进行热力学上允许进行的反应; 2.缩短化学反应平衡到达的时间,而不改变反应 的平衡点; 3.用量少而催化效率高;
二、酶是生物催化剂 ◆ 酶是一种催化剂 1.进行热力学上允许进行的反应; 2.缩短化学反应平衡到达的时间,而不改变反应 的平衡点; 3.用量少而催化效率高;
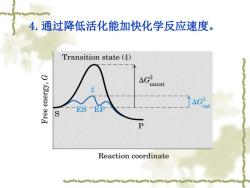
4.通过降低活化能加快化学反应速度。 Transition state ( 'K8.I9ue 4G¥ uncat cat P Reaction coordinate
4.通过降低活化能加快化学反应速度

例2H202→2H20+02 反应 活化能 非催化反应 75.24kJ/mo1 钯催化反应 48.9kJ/mo1 H202酶催化 8.36kJ/mol
例 2H2 O2 → 2H2 O + O2 反 应 活化能 非催化反应 75.24kJ/mol 钯催化反应 48.9kJ/mol H2 O2酶催化 8.36kJ/mol

,酶是特殊的催化剂 (1)高的催化效率 以摩尔为单位进行比较,酶的催化效率比化学催化1 剂高107~1013倍,比非催化反应高108~1020倍。 例2H202→2H20+02 1mo1eH202酶 能催化5×10mo1eH20,2的分解 1mole Fe3+ 只能催化6×10-4mo1eH202的分解
(1)高的催化效率 以摩尔为单位进行比较,酶的催化效率比化学催化 剂高107~1013倍,比非催化反应高108~1020倍。 例 2H2 O2→2H2 O+O2 1mole H2 O2酶 能催化 5×106mole H2 O2的分解 1mole Fe3+ 只能催化6×10-4mole H2 O2的分解 ◆ 酶是特殊的催化剂

酶与一般催化剂催化效率的比较 底物 催化剂 反应温度 反应速度常数 尿素 H+ 62 7.4×10-7 脲酶 21 5.0×106 过氧化氢 Fe 2+ 22 56 过氧化氢酶 22 3.5×107 通常要高出一般催化剂催化活性的107-1013倍
酶与一般催化剂催化效率的比较 底物 催化剂 反应温度 反应速度常数 尿素 H + 62 7.4 10-7 脲酶 21 5.0 106 过氧化氢 Fe 2+ 22 56 过氧化氢酶 22 3.5 107 通常要高出一般催化剂催化活性的107 -1013倍

转换数(turnover number,keat):每秒钟或每分 钟,每个酶分子转换底物的分子数,或每秒钟或每 分钟每摩尔酶转换底物的摩尔数。 Table 8-7 Turnover numbers*(kcat)of some enzymes Enzyme Substrate kcat(s-1) Catalase H2O2 40,000,000 Carbonic anhydrase HCO3 400,000 Acetylcholinesterase Acetylcholine 140,000 B-Lactamase Benzylpenicillin 2,000 Fumarase Fumarate 800 RecA protein (ATPase) ATP 0.4 *Number of substrate molecules transformed per second per molecule of enzyme
转换数(turnover number,kcat): 每秒钟或每分 钟,每个酶分子转换底物的分子数,或每秒钟或每 分钟每摩尔酶转换底物的摩尔数
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(2/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十章 酶动力学(酶促反应动力学).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(3/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(4/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十四章 核酸的理化性质.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十五章 核酸的研究方法.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(2/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十七章 激素.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(1/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(3/3).ppt
- 《生物化学》课程作业试题库(含参考答案).doc
- 《生物化学》课程教学大纲 Biochemistry(下册).doc
- 《生物化学》课程教学大纲 Biochemistry(上册).doc
- 《物理化学》课程电子教案(PPT教学课件)第00章 绪论.ppt
- 《物理化学》课程电子教案(PPT教学课件)第02章 热力学第二定律.ppt
- 《物理化学》课程电子教案(PPT教学课件)第01章 热力学第一定律及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第03章 溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第04章 相平衡.ppt
- 《物理化学》课程电子教案(PPT教学课件)第07章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第06章 电解质溶液.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(1/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第八章 蛋白质的性质和分离纯化 Properties and Purification of Protein(蛋白质分离纯化及含量测定).ppt
- 《生物化学》课程教学课件(PPT讲稿)第八章 蛋白质的性质和分离纯化 Properties and Purification of Protein(蛋白质的性质).ppt
- 《生物化学》课程教学课件(PPT讲稿)第七章 蛋白质结构与功能的关系.ppt
- 《生物化学》课程教学课件(PPT讲稿)第五章 蛋白质共价结构.ppt
- 《生物化学》课程教学课件(PPT讲稿)第六章 蛋白质的三维结构(2/2).ppt
- 《生物化学》课程教学课件(PPT讲稿)第六章 蛋白质的三维结构(1/2).ppt
- 《生物化学》课程教学课件(PPT讲稿)第四章 氨基酸(amino acid).ppt
- 《生物化学》课程教学课件(PPT讲稿)第三章 脂生物化学 Lipid Biochemistry.ppt
- 《生物化学》课程教学课件(PPT讲稿)第一章 绪论——发展中的生物化学.ppt
- 《生物化学》课程教学课件(PPT讲稿)第二章 糖和糖生物化学.ppt
- 石河子大学:《化学学科教学论》课程授课教案(2015).doc
- 《化学学科教学论》课程教学大纲 Theory of Chemistry Education.doc
- 石河子大学:《化学学科教学论》课程授课(2014,任课教师:高敬芝).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2010-2011期末(试题).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2011-2012期末(试题).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2009-2010期末(答案).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2009-2010期末(试题).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2010-2011期末(答案).doc
- 石河子大学:《化学学科教学论》课程教学资源(试题库)2011-2012期末(答案).doc
