《物理化学》课程电子教案(PPT教学课件)第05章 化学平衡
物理化学电子教案一第五章 化书平钳 范霍夫平鼾箱 D+eE±F+gG P'D PE P'E P'G 4上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 物理化学电子教案—第五章

第五章化学平衡 5.1化学平的条件和反应的亲和势 5.2化学反应的平衡常数和等温方程式 5.3平衡常数与化学方程式的关系 5.4复相化学平衡 5.5平衡常数的测定和平衡转化率的计算 5.6标准生成Gibbs自由能 5.7温度、压力对化学平衡的影响 5.8反应的耦合 5.9辅导答疑 4上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 第五章 化学平衡 5.1 化学平衡的条件和反应的亲和势 5.2 化学反应的平衡常数和等温方程式 5.3 平衡常数与化学方程式的关系 5.4 复相化学平衡 5.5 平衡常数的测定和平衡转化率的计算 5.6 标准生成Gibbs自由能 5.7 温度、压力对化学平衡的影响 5.8 反应的耦合 5.9 辅导答疑

5.1化学平衡的条件和反应的亲和势 化学反应体系 8热力学基本方程 8化学反应的方向与限度 为什么化学反应通常不能进行到底 化学反应亲和势 4上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 5.1 化学平衡的条件和反应的亲和势 化学反应体系 热力学基本方程 化学反应的方向与限度 为什么化学反应通常不能进行到底 化学反应亲和势

化学反应体系 化学反应体系:封闭的单相体系,不作非膨胀 功,发生了一个化学反应,设为: dD+eE+.→fR+gG+. 各物质的变化量必须满足: 0=∑YB B 根据反应进度的定义,可以得到: d5= dne dnB Veds VB 上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 化学反应体系 化学反应体系: 封闭的单相体系,不作非膨胀 功,发生了一个化学反应,设为: d e f g D E F G + + → + + B B 0 B = 各物质的变化量必须满足: B d B d n = d d nB B = 根据反应进度的定义,可以得到:

热力学基本方程 dG=-SdT+dp+∑4dne 等温、等压条件下, (dG,p=∑Adns=∑4ed5 (dng vads) 0,24m (a) 当5=1mol时: (△,Gnzp=∑yg4e (b) B 4上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 热力学基本方程 = − + + B dG SdT Vdp B dnB , B B B B B B ( )d d d G n T p = = B B (d d ) n = 等温、等压条件下, , B B B ( ) (a) T p G = 当 = 1 mol 时: r m , B B B (b) ( ) = G T p

热力学基本方程 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势4保持不变。 公式(a)表示有限体系中发生微小的变化; 公式(b)表示在大量的体系中发生了反应进度等 于1mol的变化。这时各物质的浓度基本不变,化学势 也保持不变。 4上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 热力学基本方程 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变。 公式(a)表示有限体系中发生微小的变化; 公式(b)表示在大量的体系中发生了反应进度等 于1 mol的变化。这时各物质的浓度基本不变,化学势 也保持不变

化学反应的方向与限度 用或(aG.h判断都是等效的。 (A,Gm)r,p0 反应自发地向左进行,不可能自发 向右进行 (A:Gm)T.p =0 反应达到平衡 上一 内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 化学反应的方向与限度 用 , B r m , 判断都是等效的。 B ( ) , ( ) T p B T p G G 或 r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行,不可能自发 向右进行 r m , ( ) 0 G T p = 反应达到平衡

化学反应的方向与限度 用(G判断,这相当于G~5图上曲线的斜率, 因为是微小变化,反应进度处于0~1mol之间。 反应自发向右进 行,趋向平衡 反应自发向左进 。0 行,趋向平衡 密,=0反应达到平衡 体象的吉布斯自由能和的关系 上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 化学反应的方向与限度 用 判断,这相当于 图上曲线的斜率, 因为是微小变化,反应进度处于0~1 mol之间。 T p G , ( ) G ~ , ( ) 0 T p G 反应自发向右进 行,趋向平衡 , ( ) 0 T p G 反应自发向左进 行,趋向平衡 , ( ) 0 T p G = 反应达到平衡
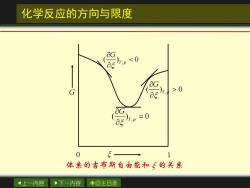
化学反应的方向与限度 G >0 0 5 1 体系的吉布斯自由能和飞的关系 上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 化学反应的方向与限度 , ( ) 0 T p G , ( ) 0 T p G = , ( ) 0 T p G 0 1 G

为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一体系的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合吉布斯自由能的缘故。 上一内容 下一内容 ◇回主目录
上一内容 下一内容 回主目录 为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一体系的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合吉布斯自由能的缘故
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程电子教案(PPT教学课件)第08章 电解与极化作用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第12章 胶体与大分子溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第11章 界面现象.ppt
- 《物理化学》课程电子教案(PPT教学课件)第10章 化学动力学基础(二).ppt
- 《物理化学》课程电子教案(PPT教学课件)第09章 化学动力学基础(一).ppt
- 《物理化学》课程复习题(无答案).doc
- 《物理化学》课程教学资源(各章授课教案).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验。专业类).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验,基础类).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅲ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅱ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅰ).doc
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定铁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定邻菲咯啉铁配合物的组成.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备及含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)紫外分光光度法测定苯酚的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)磺基水杨酸与Fe3 离子配合物稳定常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)人血清总胆固醇含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)阿司匹林含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)酸碱标准溶液的比较和标定.ppt
- 《物理化学》课程电子教案(PPT教学课件)第06章 电解质溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第07章 可逆电池的电动势及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第04章 相平衡.ppt
- 《物理化学》课程电子教案(PPT教学课件)第03章 溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第01章 热力学第一定律及其应用.ppt
- 《物理化学》课程电子教案(PPT教学课件)第02章 热力学第二定律.ppt
- 《物理化学》课程电子教案(PPT教学课件)第00章 绪论.ppt
- 《生物化学》课程教学大纲 Biochemistry(上册).doc
- 《生物化学》课程教学大纲 Biochemistry(下册).doc
- 《生物化学》课程作业试题库(含参考答案).doc
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(3/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(1/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十七章 激素.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十二章 维生素与辅酶(2/3).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十五章 核酸的研究方法.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十四章 核酸的理化性质.ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(4/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(3/4).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十章 酶动力学(酶促反应动力学).ppt
- 《生物化学》课程教学课件(PPT讲稿)第十一章 酶的作用机制和调节(2/4).ppt
