《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)配合物的生成和性质

配位化合物的生成和性质 实验目的 1、掌握配合物的生成及其与简单化合物和复 盐的区别。 2、了解测定反应速率,并计算反应级数、反应 速率常数
配位化合物的生成和性质 一、实验目的 1、掌握配合物的生成及其与简单化合物和复 盐的区别。 2、了解测定反应速率,并计算反应级数、反应 速率常数

配位化合物的生成和性质 二、实验原理 配位化合物是由阳离子(或中性原子)与一定数目的 中性分子和(或)阴离子以配位键结合形成的化合物, 如[CuNH3)4lSO4、K3Fe(CN)6J等。 如[CuNH3)4lSO4、K3IFe(CN6等
配位化合物的生成和性质 二、实验原理 配位化合物是由阳离子(或中性原子)与一定数目的 中性分子和(或)阴离子以配位键结合形成的化合物, 如[Cu(NH3 )4 ]SO4、K3 [Fe(CN)6 ]等。 如[Cu(NH3 )4 ]SO4、K3 [Fe(CN)6 ]等

配位化合物的生成和性质 实验原理 大多数配合物在水溶液中完全电离产生配离子,配 离子是配合物的核心部分,它在水溶液中存在离解 平衡,如Ag+2NH3=[AgNH3)2,其平衡常数称 为该配离子的稳定常数(K稳),如上述平衡中的K稳 可表示为: K稳 [Ag(NH3)2] =1.1×10 [Ag*][NH,]
配位化合物的生成和性质 二、实验原理 大多数配合物在水溶液中完全电离产生配离子,配 离子是配合物的核心部分,它在水溶液中存在离解 平衡,如Ag+ + 2NH3 = [Ag(NH3 )2 ] + ,其平衡常数称 为该配离子的稳定常数(K稳),如上述平衡中的K稳 可表示为: 7 2 3 3 2 1.1 10 [ ] [ ] [ ( ) ] = = + + Ag NH Ag NH K稳

配位化合物的生成和性质 二、实验原理 配离子的K稳越大,则该配离子越稳定。对于配体数相 同、空间结构类似的配离子,可由其相应的K稳值比 较它们的相对稳定性。配位平衡的移动,符合化学平 衡移动的基本原理一吕·查德里(Le Chatelier)原理
配位化合物的生成和性质 二、实验原理 配离子的K稳越大,则该配离子越稳定。对于配体数相 同、空间结构类似的配离子,可由其相应的K稳值比 较它们的相对稳定性。配位平衡的移动,符合化学平 衡移动的基本原理—吕·查德里(Le Chatelier)原理
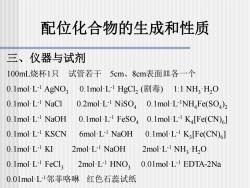
配位化合物的生成和性质 三、仪器与试剂 100mL烧杯1只 试管若干5cm、8cm表面皿各一个 0.1moL1AgNO30.1 mol L-1 HgCl2(剧毒) )1:1 NH2HO 0.1mol L-1 NaCl 0.2mol-L-1 NiSO 0.1mol-L-NH Fe(SO)2 0.1molL-NaOH 0.1mol-L-FeSO 0.1mol-L-K[Fe(CN)] 0.1molL-1 KSCN 6molL-1 NaOH 0.1mol-L-1 K[Fe(CN)] 0.1molL-1 KI 2molL-1 NaOH 2mol L-1 NH HO 0.1mol-L-1 FeCl 2mol L-1 HNO,0.01mol L-1 EDTA-2Na 0.01molL1邻菲咯啉红色石蕊试纸
三、仪器与试剂 100mL烧杯1只 试管若干 5cm、8cm表面皿各一个 0.1mol·L-1 AgNO3 0.1mol·L-1 HgCl2 (剧毒) 1:1 NH3·H2O 0.1mol·L-1 NaCl 0.2mol·L-1 NiSO4 0.1mol·L-1NH4 Fe(SO4 ) 2 0.1mol·L-1 NaOH 0.1mol·L-1 FeSO4 0.1mol·L-1 K4 [Fe(CN)6 ] 0.1mol·L-1 KSCN 6mol·L-1 NaOH 0.1mol·L-1 K3 [Fe(CN)6 ] 0.1mol·L-1 KI 2mol·L-1 NaOH 2mol·L-1 NH3·H2O 0.1mol·L-1 FeCl3 2mol·L-1 HNO3 0.01mol·L-1 EDTA-2Na 0.01mol·L-1邻菲咯啉 红色石蕊试纸 配位化合物的生成和性质

配位化合物的生成和性质 四、实验步骤 1、配离子的生成 ()在试管中加入0.1moL1HgCL2(剧毒)溶液1滴。 边振摇边逐滴加入0.1moL1K至桔红色沉淀消失, 观察并记录现象。(方程式:Hg2++2=Hg2↓, HgL+2F=[HgI2)
配位化合物的生成和性质 四、实验步骤 1、配离子的生成 (1) 在试管中加入0.1mol·L-1 HgCl2 (剧毒)溶液1滴。 边振摇边逐滴加入0.1mol·L-1 KI至桔红色沉淀消失, 观察并记录现象。( 方程式:Hg2+ + 2I- = HgI2 ↓, HgI2+ 2I- =[HgI4 ] 2- )

配位化合物的生成和性质 四、实验步骤 1、配离子的生成 (2)在两支试管中各加入0.2moL1NiS0,溶液10 滴,向其中一支试管中滴加0.1moL1NaOH2滴, 观察现象,写出方程式;在另一支试管中缓慢逐滴 加入1:1氨水,边滴加边振摇,观察现象,注意沉 淀的生成与溶解方程式:N2++2NHL3H,O= Ni(OH2(浅绿)+2OH+4H20,Ni(OHD2+ 4NH3H,0=[NiNH3)42+(蓝紫)+2OH+4H20)
配位化合物的生成和性质 四、实验步骤 1、配离子的生成 (2) 在两支试管中各加入0.2mol·L-1 NiSO4溶液10 滴,向其中一支试管中滴加0.1mol·L-1 NaOH 2滴, 观察现象,写出方程式;在另一支试管中缓慢逐滴 加入1:1氨水,边滴加边振摇,观察现象,注意沉 淀的生成与溶解(方程式:Ni2+ + 2NH3·H2O = Ni(OH)2 ↓(浅绿) +2OH- +4H2O, Ni(OH)2 + 4NH3·H2O =[Ni(NH3 ) 4 ] 2+ (蓝紫)+ 2OH- + 4H2O )

配位化合物的生成和性质 四、实验步骤 2、配合物与简单化合物和复盐的区别 1)取三支试管,分别加入0.1moL1K3Fe(CN)6小 NH4Fe(SO4)2和FeCl3溶液各10滴,再向每支试管加入 0.1moL1KSCN2滴。观察溶液颜色变化,写出方程 式并简要解释
配位化合物的生成和性质 四、实验步骤 2、配合物与简单化合物和复盐的区别 (1)取三支试管,分别加入0.1mol·L-1 K3 [Fe(CN)6 ]、 NH4Fe(SO4 ) 2和FeCl3溶液各10滴,再向每支试管加入 0.1mol·L-1KSCN 2滴。观察溶液颜色变化,写出方程 式并简要解释

配位化合物的生成和性质 四、实验步骤 2、配合物与简单化合物和复盐的区别 (2)取0.1molL-NH4Fe(S04)2溶液10滴置于一试管中, 加入2滴0.1moL1BaCL,溶液,观察现象,写出反应方 程式。另取NH4Fe(SO4)2溶液1mL置于直径为8cm的表 面皿内,再加入6moL1NaOH溶液2mL,迅速用一个 内表面贴有润湿红色石蕊试纸、直径为5cm的表面皿 盖上,置于水浴上加热此法称为“气室法”,主要用 于检验溶液中的NH)。观察现象并解释之
配位化合物的生成和性质 四、实验步骤 2、配合物与简单化合物和复盐的区别 (2)取0.1mol·L-1NH4Fe(SO4 ) 2溶液10滴置于一试管中, 加入2滴0.1mol·L-1BaCl2溶液,观察现象,写出反应方 程式。另取NH4Fe(SO4 ) 2溶液1mL置于直径为8cm的表 面皿内,再加入6mol·L-1NaOH溶液2mL,迅速用一个 内表面贴有润湿红色石蕊试纸、直径为5cm的表面皿 盖上,置于水浴上加热(此法称为“气室法”,主要用 于检验溶液中的NH4 + )。观察现象并解释之

配位化合物的生成和性质 四、实验步骤 3、配位平衡的移动 (1)取一支试管加入15滴0.1molL1AgNO3溶液,滴加 2moL1NH3H,O至生成的沉淀溶解,再多加10滴氨 水,得[AgNH3)2]溶液。将其分盛在两支试管中。向 其中一支试管加0.1moL1NaCI溶液1~2滴;向另一支 试管加0.1moL1K溶液1~2滴。观察现象,并予简要 解释
配位化合物的生成和性质 四、实验步骤 3、配位平衡的移动 (1)取一支试管加入15滴0.1mol·L-1AgNO3溶液,滴加 2mol·L-1NH3·H2O至生成的沉淀溶解,再多加10滴氨 水,得[Ag(NH3 ) 2 + ]溶液。将其分盛在两支试管中。向 其中一支试管加0.1mol·L-1NaCl溶液1~2滴;向另一支 试管加0.1mol·L-1KI溶液1~2滴。观察现象,并予简要 解释
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)荧光分析法测定硫酸奎尼丁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)缓冲溶液的性质.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)维生素测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)碳酸钠含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)硫酸亚铁铵的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)电位滴定在酸碱滴定中的应用.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水的硬度测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水样中氟含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化铅溶度积的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化钠的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氧化还原与电化学.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)弱酸电离度和电离常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)双氧水含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)化学反应速度.ppt
- 《无机化学》课程PPT教学课件(药学专业)第七章 原子结构.pptx
- 《无机化学》课程PPT教学课件(药学专业)第八章 分子结构.pptx
- 《无机化学》课程PPT教学课件(药学专业)绪论(重庆医科大学:赵华).ppt
- 《无机化学》课程PPT教学课件(药学专业)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(药学专业)第二章 化学反应方向.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)酸碱标准溶液的比较和标定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)阿司匹林含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)人血清总胆固醇含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)磺基水杨酸与Fe3 离子配合物稳定常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)紫外分光光度法测定苯酚的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备及含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定邻菲咯啉铁配合物的组成.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)分光光度法测定铁的含量.ppt
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅰ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅱ).doc
- 《物理化学》课程教学大纲 Physical Chemistry(Ⅲ).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验,基础类).doc
- 《物理化学》课程教学大纲 Physical Chemistry Experiments(物理化学实验。专业类).doc
- 《物理化学》课程教学资源(各章授课教案).doc
- 《物理化学》课程复习题(无答案).doc
- 《物理化学》课程电子教案(PPT教学课件)第09章 化学动力学基础(一).ppt
- 《物理化学》课程电子教案(PPT教学课件)第10章 化学动力学基础(二).ppt
- 《物理化学》课程电子教案(PPT教学课件)第11章 界面现象.ppt
- 《物理化学》课程电子教案(PPT教学课件)第12章 胶体与大分子溶液.ppt
- 《物理化学》课程电子教案(PPT教学课件)第08章 电解与极化作用.ppt
