《无机化学》课程PPT教学课件(药学专业)第八章 分子结构

第八章分子结构 分子是保持物质性质的最小微粒,是参 与化学反应的基本单元。 ■ 分子内部直接相邻原子间强的相互作用 称为化学键(chemical bond). 三种类型:离子键、共价键、金属键 分子中原子在空间的排布,即分子的几 何构型。 1
1 第八章 分子结构 ◼ 分子是保持物质性质的最小微粒,是参 与化学反应的基本单元。 ◼ 分子内部直接相邻原子间强的相互作用 称为化学键(chemical bond)。 ◼ 三种类型:离子键、共价键、金属键 ◼ 分子中原子在空间的排布,即分子的几 何构型

第一节离子键(ionic bond) 一、离子键的特点 正负离子通过静电作用而形成的化学键 离子键的本质是库仑静电作用力 f=q+q-/r2 V=-qtq/4π8o1 q、q为离子所带电荷,r为离子间距离。 离子键强度是用晶格能来描述的
2 第一节 离子键(ionic bond) 一、离子键的特点 正负离子通过静电作用而形成的化学键 离子键的本质是库仑静电作用力 f = q + q - /r 2 V = - q + q - /4o r q + 、q - 为离子所带电荷, r为离子间距离。 离子键强度是用晶格能来描述的

2. 离子键的特点:既无方向性,也无饱和性 离子化合物是由正负离子通过离子键相互交 替连结而成的晶体结构。 3. 离子键的离子性与元素的电负性差有关。 两元素的电负性差△x判断键的性质 二、离子键的强度与玻恩-哈伯(Borm-Haber) 循环 1.晶格能U:相互远离的气态正离子和负离子结 合成1mol离子晶体时所释放的能量,或1mol离子 晶体解离成自由气态离子时所吸收的能量的绝对 值。 3
3 2. 离子键的特点:既无方向性, 也无饱和性 离子化合物是由正负离子通过离子键相互交 替连结而成的晶体结构。 3. 离子键的离子性与元素的电负性差有关。 两元素的电负性差 x判断键的性质 二、离子键的强度与玻恩- 哈伯 (Born - Haber) 循环 1. 晶格能U: 相互远离的气态正离子和负离子结 合成1mol离子晶体时所释放的能量,或1mol离子 晶体解离成自由气态离子时所吸收的能量的绝对 值

玻恩-哈伯(Borm-Haber)循环 o+g-空,adhm ↓S ↓U 2 Na(g) +Cl(g)->Na"(g)+Cl(g) 4Hm=S+1/2D+I+(A)+←U刃 U=-AHm+S+1/2D+1-A 4
4 玻恩- 哈伯 (Born - Haber)循环 ( ) ( ) ( ) ( ) 2 1 ( ) ( ) 2 1 ( ) ( ) 2 N a g C l g N a g C l g S D U N a s C l g NaCl s I A f Hm + − + − + ⎯⎯⎯→ + + ⎯⎯⎯→ fH m = S + 1/2D + I + (-A) +(-U) U = - fH m + S + 1/2D +I – A
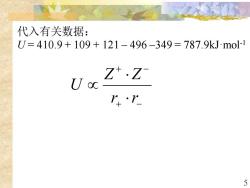
代入有关数据: =410.9+109+121-496-349=787.9kJmo1 Z·Z U oc r+·1 5
5 代入有关数据: U = 410.9 + 109 + 121 – 496 –349 = 787.9kJ·mol-1 + − + − r r Z Z U

3.晶格能的应用: 1.可以比较离子键的强度和晶体的稳定性。 晶格能越大,晶体的熔点越高。 P163页表8-1 2.由于离子化合物中存在一定的共价成分,实 验晶格能往往比理论计算值大,实验值比计 算值大的越多,说明化合物中存在更多的共 价成分。(P165,离子极化现象) 6
6 3.晶格能的应用: 1. 可以比较离子键的强度和晶体的稳定性。 晶格能越大,晶体的熔点越高。 P163页 表8-1 2. 由于离子化合物中存在一定的共价成分,实 验晶格能往往比理论计算值大,实验值比计 算值大的越多,说明化合物中存在更多的共 价成分。(P165,离子极化现象)

三、离子的特征: 1.离子的电荷:原子在形成离子化合物过程中,失 去或得到的电子数.正离子最高电荷+4(Th4+、Ce4+、 Sn4+),负离子最高-3(P043、AsO43-)。 2.离子的电子构型 简单负离子一般最外层具有稳定的8电子构型。 正离子:2电子构型Lit Be2+ 8电子构型Na+K+Ca2+ 18电子构型:s2pd10,d区离子Cu+、Ag、Zn2+、 Cd2+、Hg2+ 18+2电子构型:s2pd1(n+1)s2,p区,3~5主族Pb2+、 Sn2+、Bi3+ 9-17电子构型:Fe2+、Fe3+、Cr3+、Mn2+(过渡金 属离子) 7
7 三、离子的特征: 1. 离子的电荷:原子在形成离子化合物过程中,失 去或得到的电子数.正离子最高电荷+4(Th4+ 、Ce4+ 、 Sn4+),负离子最高-3(PO4 3-、AsO4 3-)。 2. 离子的电子构型 简单负离子一般最外层具有稳定的8电子构型。 正离子:2电子构型 Li+ Be2+ 8电子构型 Na+ K+ Ca2+ 18电子构型:s 2p 6d 10 ,d区离子 Cu+ 、 Ag+ 、 Zn2+ 、 Cd2+ 、 Hg2+ 18+2电子构型 : s 2p 6d 10(n+1)s2 , p区,3~5主族Pb2+ 、 Sn2+ 、 Bi3+ 9-17电子构型 :Fe2+ 、Fe3+ 、 Cr3+ 、 Mn2+(过渡金 属离子)

3.离子半径: (1)离子半径:根据晶体中相邻正负离子间的核间 距(d测出的。d=r++r(有效离子半径) 离子半径变化规律: 表8-2 p164 具有同一电子结构的正负离子中,负离子半径 一般比正离子半径大。ra+=102pm,rp.= 133pm 同一元素不同价态的正离子,电荷数越少的离 子半径越大。rF2+>rF3+ 8
8 3. 离子半径: (1) 离子半径:根据晶体中相邻正负离子间的核间 距(d)测出的。d = r+ + r- (有效离子半径) • 离子半径变化规律: 表8-2 p164 具有同一电子结构的正负离子中,负离子半径 一般比正离子半径大。rNa+= 102pm, rF-= 133pm 同一元素不同价态的正离子,电荷数越少的离 子半径越大。rFe2+> rFe3+

同一主族,从上到下,电荷数相同的离子半径 依次增大。 同一周期主族元素正离子半径随离子电荷数增 大而依次减小。ra+>rMg2+>rA3+ 周期表中,每个元素与其邻近的右下角或左 上 角元素离子半径接近。即对角线规则。 TLit≈IMg2+;TSc3t≈rZr4+;[Nat≈TCa2+ 9
9 同一主族,从上到下,电荷数相同的离子半径 依次增大。 同一周期主族元素正离子半径随离子电荷数增 大而依次减小。rNa+ > rMg2+ > rAl3+ 周期表中,每个元素与其邻近的右下角或左 上 角元素离子半径接近。即对角线规则。 rLi+ rMg2+ ; rSc3+ rZr4+ ; rNa+ rCa2+
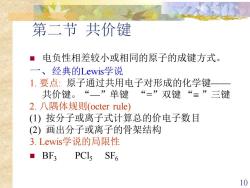
第二节共价键 ■ 电负性相差较小或相同的原子的成键方式。 一、经典的Lewis学说 1.要点:原子通过共用电子对形成的化学键 共价键。“一”单键 “=”双键“=”三键 2.八隅体规则(octer rule) (1)按分子或离子式计算总的价电子数目 (2)画出分子或离子的骨架结构 3.Lewis学说的局限性 ■BF3 PCIs SF 10
10 第二节 共价键 ◼ 电负性相差较小或相同的原子的成键方式。 一、经典的Lewis学说 1. 要点: 原子通过共用电子对形成的化学键—— 共价键。“—”单键 “ =”双键 “ ”三键 2. 八隅体规则(octer rule) (1) 按分子或离子式计算总的价电子数目 (2) 画出分子或离子的骨架结构 3. Lewis学说的局限性 ◼ BF3 PCl5 SF6
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(药学专业)绪论(重庆医科大学:赵华).ppt
- 《无机化学》课程PPT教学课件(药学专业)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(药学专业)第二章 化学反应方向.ppt
- 《无机化学》课程PPT教学课件(药学专业)第三章 化学反应的速率.ppt
- 《无机化学》课程PPT教学课件(药学专业)第四章 化学平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第五章 酸碱平衡及难溶电解质的沉淀——溶解平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第六章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十二章 p区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第九章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十一章 ds区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十章_s区元素性质.ppt
- 《无机化学》课程PPT教学课件(药学专业,实验讲稿,重庆医科大学:赵华).ppt
- 《无机化学》课程作业习题(无答案)化学平衡.doc
- 《无机化学》课程作业习题(无答案)化学反应速率.doc
- 《无机化学》课程作业习题(无答案)氧化还原.doc
- 《无机化学》课程作业习题(无答案)酸碱平衡.doc
- 《无机化学》课程作业习题(无答案)原子结构.doc
- 《无机化学》课程作业习题(无答案)难容电解质的沉淀溶解平衡.doc
- 《无机化学》课程作业习题(无答案)配位化合物.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题1.doc
- 《无机化学》课程PPT教学课件(药学专业)第七章 原子结构.pptx
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)化学反应速度.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)双氧水含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)弱酸电离度和电离常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氧化还原与电化学.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化钠的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化铅溶度积的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水样中氟含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水的硬度测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)电位滴定在酸碱滴定中的应用.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)硫酸亚铁铵的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)碳酸钠含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)维生素测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)缓冲溶液的性质.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)荧光分析法测定硫酸奎尼丁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)配合物的生成和性质.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)酸碱标准溶液的比较和标定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)阿司匹林含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)人血清总胆固醇含量的测定.ppt
