《无机化学》课程PPT教学课件(药学专业)第三章 化学反应的速率

第三章化学反应的速率
第三章 化学反应的速率

内容提要 化学反应速率的表示方法 反应机理 化学反应速率理论简介 化学反应速率的影响因素
内容提要 化学反应速率的表示方法 反应机理 化学反应速率理论简介 化学反应速率的影响因素
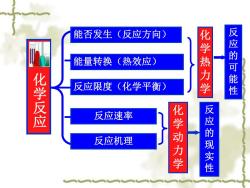
能否发生(反应方向) 能量转换(热效应) 化学热力学 反应的可能性 化学反应 反应限度(化学平衡)》 反应速率 反应机理 化学动力学 反应的现实性
化学反应 能否发生(反应方向) 能量转换(热效应) 反应限度(化学平衡) 反应速率 反应机理 化学热力学 化学动力学 反应的可能性 反应的现实性

快如爆炸反应,中和反应。 反应速率 慢 金属的锈蚀,食品的腐烂, 文物的老化等。 研究的目的:控制反应速率,使其按我们希望 的速率进行。 化学动力学研究的是反应进行的 速率,并根据研究反应速率提供的信 息探讨反应机理,即研究反应的快慢 和反应进行的途径
研究的目的:控制反应速率,使其按我们希望 的速率进行。 反应速率 快 如爆炸反应,中和反应。 慢 金属的锈蚀,食品的腐烂, 文物的老化等。 化学动力学研究的是反应进行的 速率, 并根据研究反应速率提供的信 息探讨反应机理,即研究反应的快慢 和反应进行的途径

第一节化学反应速率的表示 化学反应速率(rate of reaction) 化学反应速率:一定条件下单位时间内某化学反应 的反应物转变为生成物的速率。 用单位时间内反应物浓度的减少或生成物浓度的增 加来表示,而且习惯取正值。浓度单位通常用mo1L1, 时间单位视反应快慢,可分别用秒(s)、分(min)或小时 (h)等表示。这样,化学反应速率的单位可为mo1L1s1、 mol.L-1.min-1 mol.L-1.h-1
第一节 化学反应速率的表示 一、化学反应速率(rate of reaction) 化学反应速率:一定条件下单位时间内某化学反应 的反应物转变为生成物的速率。 用单位时间内反应物浓度的减少或生成物浓度的增 加来表示,而且习惯取正值。浓度单位通常用mol·L-1, 时间单位视反应快慢,可分别用秒(s)、分(min)或小时 (h)等表示。这样,化学反应速率的单位可为mol·L-1·s-1 、 mol·L-1·min-1 、mol·L-1·h-1

反应 2N205→4N02+02 开始浓度/(moL) 2.10 0 0 100秒浓度/(moL1) 1.95 0.30 0.075 300秒浓度/moL) 1.70 0.80 0.20 700秒浓度moL) 1.31 1.58 0.395 ,0=-c20=- (1.95-2.10)moL1 100s =1.5×10-3moL1s-1 随着反应的 (N20)- Ac,0)=. 1.70-1.95)moL1 (300-100s 进行,速率 逐渐减小 =1.25×10-3moL1s-1 △cN2Os) N205)3=-7 (1.31-1.70)moL1 (700-300)s =9.75×104molL1s-1
反 应 2N2O5 → 4NO2 + O2 开始浓度/(mol·L-1) 2.10 0 0 100秒浓度/(mol·L-1) 1.95 0.30 0.075 300秒浓度/(mol·L-1) 1.70 0.80 0.20 700秒浓度/(mol·L-1) 1.31 1.58 0.395 υ(N2O5)1= - = - ∆c(N2O5) (1.95-2.10)mol·L-1 ∆t 100s =1.5×10-3mol·L-1·s -1 υ(N2O5)2= - = - ∆c(N2O5) (1.70-1.95)mol·L-1 ∆t (300-100)s =1.25×10 -3mol·L-1·s -1 υ(N2O5)3= - = - ∆c(N2O5) (1.31-1.70)mol·L-1 ∆t (700-300)s =9.75×10-4mol·L-1·s -1 随着反应的 进 行 , 速 率 逐渐减小
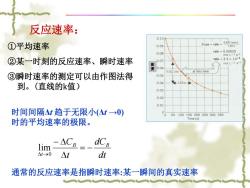
反应速率: 0.10 ①平均速率 0.09 Slope-rate0027 mol/L 110s 0.08 rate=0.00025 mol L-1 s-1 ②某一时刻的反应速率、瞬时速率 0.07 rate=2.5×10-4 molL-1s】 度0.06 0.027mo at this time ③瞬时速率的测定可以由作图法得 0.05 到。(直线的k值) 0.04 4110s 0.03 0.02 0.01 时间间隔△t趋于无限小(公t0) 0 0 50100150200250300350 时的平均速率的极限。 Time (s) lim △CB dCB △1→0 △t dt 通常的反应速率是指瞬时速率:某一瞬间的真实速率
反应速率: ①平均速率 ②某一时刻的反应速率、瞬时速率 ③瞬时速率的测定可以由作图法得 到。(直线的k值) dt dC t CB B t 0 lim 时间间隔Δt 趋于无限小(Δt →0) 时的平均速率的极限。 通常的反应速率是指瞬时速率:某一瞬间的真实速率 浓 度

例如,在给定条件下,合成氨反应: N2 3H2 一→ 2NH3 起始浓度/molL1 2.0 3.0 0 2s末浓度/mo1L-1 1.8 2.4 0.4 该反应平均速率若根据不同物质的浓度变化可分别表示为: N2)=-4 cN22=-1.8-2.0)mo1.L =0.1mol.L1.s △t (2-0)s (H2)=- △c(H2) =-(2.4-3.0)mol.L -=0.3mol.L1.s1 △t (2-0)s (NH)= △c(NH3)_(0.4-0)mol.L -=0.2mol,L1.s1 △t (2-0)s 用反应中的任何物质表示反应速率,数值上明显不同, 但反应的问题的实质是一样的
例如,在给定条件下,合成氨反应: N2 + 3H2 ─→ 2NH3 起始浓度/mol·L -1 2.0 3.0 0 2s末浓度/mo1·L-1 1.8 2.4 0.4 该反应平均速率若根据不同物质的浓度变化可分别表示为: 用反应中的任何物质表示反应速率,数值上明显不同, 但反应的问题的实质是一样的

显然,不同物质表示的反应速率的数值是不同的 在这里用三种物质表示的速率之比是1:3:2,它们之间 的比值为反应方程式中相应物质分子式前的系数比。 V N2 V NH3 0.1mol.L.s 3 2 对于一般反应: aA dD gG hH 反应速率: VD Va= a d g
显然,不同物质表示的反应速率的数值是不同的 在这里用三种物质表示的速率之比是1:3:2,它们之间 的比值为反应方程式中相应物质分子式前的系数比。 1 1 0.1 1 3 2 2 2 3 mol L s N H NH a d g h A D G H

第二节反应机理 反应历程(反应机理reaction mechanism): 一个化学反应所经历的途径或具体步骤。 基元反应(elementary reaction):一个化学反应 中,反应物分子一步直接生成产物分子 NO2+CO=NO+CO2 非基元反应:由两个或两个以上的基元反应组 成的化学反应,也叫总反应(overall reaction)。 A2+B=A2B 第一步 A22A (快反应) 第二步 2A+BA2B (慢反应) 限速步骤:非基元反应中反应速率最慢的一步 叫做速率限速步骤(rate-limiting step)
反应历程(反应机理 reaction mechanism): 一个化学反应所经历的途径或具体步骤。 基元反应(elementary reaction):一个化学反应 中,反应物分子一步直接生成产物分子 NO2+CO=NO+CO2 非基元反应: 由两个或两个以上的基元反应组 成的化学反应,也叫总反应(overall reaction)。 A2+B=A2B 第一步 A2 2A (快反应) 第二步 2A+B A2B (慢反应) 限速步骤:非基元反应中反应速率最慢的一步 叫做速率限速步骤(rate-limiting step) 第二节 反应机理
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(药学专业)第四章 化学平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第五章 酸碱平衡及难溶电解质的沉淀——溶解平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第六章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十二章 p区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第九章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十一章 ds区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十章_s区元素性质.ppt
- 《无机化学》课程PPT教学课件(药学专业,实验讲稿,重庆医科大学:赵华).ppt
- 《无机化学》课程作业习题(无答案)化学平衡.doc
- 《无机化学》课程作业习题(无答案)化学反应速率.doc
- 《无机化学》课程作业习题(无答案)氧化还原.doc
- 《无机化学》课程作业习题(无答案)酸碱平衡.doc
- 《无机化学》课程作业习题(无答案)原子结构.doc
- 《无机化学》课程作业习题(无答案)难容电解质的沉淀溶解平衡.doc
- 《无机化学》课程作业习题(无答案)配位化合物.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题1.doc
- 《无机化学》课程作业习题(无答案)分子结构.doc
- 《无机化学》课程作业习题(无答案)非金属元素.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题2.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题3.doc
- 《无机化学》课程PPT教学课件(药学专业)第二章 化学反应方向.ppt
- 《无机化学》课程PPT教学课件(药学专业)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(药学专业)绪论(重庆医科大学:赵华).ppt
- 《无机化学》课程PPT教学课件(药学专业)第八章 分子结构.pptx
- 《无机化学》课程PPT教学课件(药学专业)第七章 原子结构.pptx
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)化学反应速度.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)双氧水含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)弱酸电离度和电离常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氧化还原与电化学.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化钠的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化铅溶度积的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水样中氟含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水的硬度测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)电位滴定在酸碱滴定中的应用.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)硫酸亚铁铵的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)碳酸钠含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)维生素测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)缓冲溶液的性质.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)荧光分析法测定硫酸奎尼丁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备.ppt
