《无机化学》课程PPT教学课件(药学专业)第九章 配位化合物

第九章配位化合物 Coordination Compounds
第九章 配位化合物 Coordination Compounds
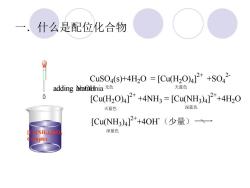
什么是配位化合物 CuS04(sH4H20=[Cu(H20)4]2++S042 adding Anmbnia无色 天蓝色 0 [Cu(H2O)42++4NH3=[CuNH3)4]2+4H2O 天蓝色 深蓝色 [CuNH3)4]2+4OH(少量)一 深蓝色 nplex
一.什么是配位化合物 CuSO4 Solution adding NaOH Cu(OH)2 Precipitation adding ammonia [Cu(NH3 )4 ]SO4 Complex CuSO4 (s)+4H2O = [Cu(H2O)4 ] 2+ +SO4 2- [Cu(H2O)4 ] 2+ +4NH3 = [Cu(NH3 )4 ] 2+ +4H2O [Cu(NH3 )4 ] 2+ +4OH -(少量) 无色 天蓝色 深蓝色 天蓝色 深蓝色

[Cu(NH3)4]2+是由1个Cu2+离子和4个NH3分子以配 位键形成的复杂离子,它在水中只能部分地解离 出Cu2+和NH3,绝大多数仍以复杂离子的形式一 [CuNH3)4]2+一存在。 ● 配合物是以具有接受电子对的离子或原子(统称 中心原子)为中心,与一组可以给出电子对的离 子或分子(统称配体),以一定的空间排列方式 在中心原子周围所组成的质点(配离子或配分子) 为特征的化合物
⚫ [Cu(NH3 )4 ] 2+是由1个Cu2+离子和4个NH3分子以配 位键形成的复杂离子,它在水中只能部分地解离 出Cu2+和NH3,绝大多数仍以复杂离子的形式— [Cu(NH3 )4 ] 2+—存在。 ⚫ 配合物是以具有接受电子对的离子或原子(统称 中心原子)为中心,与一组可以给出电子对的离 子或分子(统称配体),以一定的空间排列方式 在中心原子周围所组成的质点(配离子或配分子) 为特征的化合物

带正电荷的配离子称为配阳离子 [CuNH3)4]2+、[AgNH3)2] 带负电荷的配离子称为配阴离子 [HgL4]2、[Fe(NCS)4] 含有配离子的化合物和配位分子统称为配合物。 配合物可以是 酸: H[Cu(CN)2] 碱: [Cu(NH3)4J(OH)2 盐: [Cu(NH3)4]SO4 也可以是电中性的配位分子 INi(CO)4] 习惯上把配离子也称为配合物 [Cu(NH3)4]2+
带正电荷的配离子称为配阳离子 [Cu(NH3 )4 ] 2+ 、[Ag(NH3 )2 ] + 带负电荷的配离子称为配阴离子 [HgI4 ] 2-、[Fe(NCS)4 ] - 含有配离子的化合物和配位分子统称为配合物。 配合物可以是 酸: H[Cu(CN)2 ] 碱: [Cu(NH3 )4 ](OH)2 盐: [Cu(NH3 )4 ]SO4 也可以是电中性的配位分子 [Ni(CO)4 ] 习惯上把配离子也称为配合物 [Cu(NH3 )4 ] 2+

第一节配合物的组成、命名和异构现象 一、配合物的组成 1. 配合物的内层(inner sphere)和外层(outer sphere) ● 大多数配合物由配离子与带相反电荷的离子组成: [AgNH3)2](OH)2、Na2[HgL4]、K[Fe(NCS)4]、 [Pt(NH3)2Cl2] 配离子是配合物的特征部分,由中心原子(离子) 和配体组成,称为配合物的内层。通常把内层写 在方括号之内,配合物中与配离子带相反电荷的 离子称为配合物的外层。 电中性的配位分子只有内层,没有外层
第一节 配合物的组成、命名和异构现象 一、配合物的组成 1. 配合物的内层(inner sphere)和外层(outer sphere) ⚫ 大多数配合物由配离子与带相反电荷的离子组成: [Ag(NH3 )2 ](OH)2、 Na2 [HgI4 ]、K[Fe(NCS)4 ]、 [Pt(NH3 )2Cl2 ] • 配离子是配合物的特征部分,由中心原子(离子) 和配体组成,称为配合物的内层。通常把内层写 在方括号之内,配合物中与配离子带相反电荷的 离子称为配合物的外层。 • 电中性的配位分子只有内层,没有外层

第一节配合物的组成、命名和异构现象 [Cu (NH3)4]SO4 中心原子 配体 外层 内层 配合物
第一节 配合物的组成、命名和异构现象 [Cu (NH3 )4 ] SO4 中心原子 配体 外层 内层 配合物

第一节配位化合物的基本概念 2. 中心原子(central atom) 配合物中接受孤对电子的阳离子或原子统称为 中心原子。 中心原子一般是金属离子,大多为过渡元素, 特别是第ⅧB族元素以及相邻近的一些副族元素。 某些副族元素的原子和高氧化值非金属元素的 原子也是较常见的中心原子,如 Ni(CO)4]中的Ni(O) [Sif6]2-中的Si(V)
第一节 配位化合物的基本概念 2. 中心原子(central atom) • 配合物中接受孤对电子的阳离子或原子统称为 中心原子。 • 中心原子一般是金属离子,大多为过渡元素, 特别是第ⅧB族元素以及相邻近的一些副族元素。 某些副族元素的原子和高氧化值非金属元素的 原子也是较常见的中心原子,如 [Ni(CO)4 ]中的Ni(0) [SiF6 ] 2-中的Si(Ⅳ)
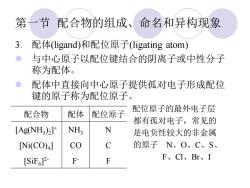
第一节配合物的组成、命名和异构现象 3. 配体(ligand)和配位原子(ligating atom) 与中心原子以配位键结合的阴离子或中性分子 称为配体。 配体中直接向中心原子提供孤对电子形成配位 键的原子称为配位原子。 配位原子的最外电子层 配合物 配体 配位原子 都有孤对电子,常见的 [Ag(NH3)2] NH3 N 是电负性较大的非金属 [Ni(CO)4] CO C 的原子N、O、C、S、 [Si证6]2 F F F、CI、Br、I
第一节 配合物的组成、命名和异构现象 3. 配体(ligand)和配位原子(ligating atom) ⚫ 与中心原子以配位键结合的阴离子或中性分子 称为配体。 ⚫ 配体中直接向中心原子提供孤对电子形成配位 键的原子称为配位原子。 配位原子的最外电子层 都有孤对电子,常见的 是电负性较大的非金属 的原子 N、O、C、S、 F、Cl、Br、I 配合物 配体 配位原子 [Ag(NH3 )2 ] + NH3 N [Ni(CO)4 ] CO C [SiF6 ] 2- F - F

第一节配合物的组成、命名和异构现象 单齿配体和多齿配体 单齿配体(monodentate ligand):只含有一个 配位原子的配体称为单齿配体。如 NH3、HO、CN、F、CI 其配位原子分别为 N、O、C、F、CI 少数配体虽有两个配位原子,由于两个配位 原子靠得太近,只能选择其中一个与中心原 子成键,故仍属单齿配体,称为两可配体: 如 CN-、NC、NO2、 ONO、SCN、NCS
第一节 配合物的组成、命名和异构现象 • 单齿配体和多齿配体 ➢ 单齿配体(monodentate ligand):只含有一个 配位原子的配体称为单齿配体。如 NH3、H2O、CN-、F -、Cl- 其配位原子分别为 N、O、C、F、Cl • 少数配体虽有两个配位原子,由于两个配位 原子靠得太近,只能选择其中一个与中心原 子成键,故仍属单齿配体,称为两可配体: 如 CN-、 NC-、 NO2 -、 ONO-、SCN-、NCS-

第一节配合物的组成、命名和异构现象 多齿配体(multidentate ligand):含有两个或两个 以上配位原子的配体称为多齿配体。如 ·双齿配体:乙二胺(en) H2N-CH2-CH2-NH2 三齿配体:二亚乙基三胺(DEN) H,NCH,CH2 NHCH,CH2 NH2
第一节 配合物的组成、命名和异构现象 ➢ 多齿配体(multidentate ligand):含有两个或两个 以上配位原子的配体称为多齿配体。如 • 双齿配体:乙二胺(en) H2N-CH2 -CH2 -NH2 • 三齿配体:二亚乙基三胺(DEN) H2NCH2CH2 NHCH2CH2 NH2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(药学专业)第十一章 ds区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十章_s区元素性质.ppt
- 《无机化学》课程PPT教学课件(药学专业,实验讲稿,重庆医科大学:赵华).ppt
- 《无机化学》课程作业习题(无答案)化学平衡.doc
- 《无机化学》课程作业习题(无答案)化学反应速率.doc
- 《无机化学》课程作业习题(无答案)氧化还原.doc
- 《无机化学》课程作业习题(无答案)酸碱平衡.doc
- 《无机化学》课程作业习题(无答案)原子结构.doc
- 《无机化学》课程作业习题(无答案)难容电解质的沉淀溶解平衡.doc
- 《无机化学》课程作业习题(无答案)配位化合物.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题1.doc
- 《无机化学》课程作业习题(无答案)分子结构.doc
- 《无机化学》课程作业习题(无答案)非金属元素.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题2.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题3.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题4.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题5.doc
- 《无机化学》课程作业习题(无答案)化学热力学初步.doc
- 《无机化学》课程作业习题(无答案)溶液.doc
- 重庆医科大学:《无机化学》课程实验教学指导(药学专业,共二十四个实验).doc
- 《无机化学》课程PPT教学课件(药学专业)第十二章 p区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第六章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(药学专业)第五章 酸碱平衡及难溶电解质的沉淀——溶解平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第四章 化学平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第三章 化学反应的速率.ppt
- 《无机化学》课程PPT教学课件(药学专业)第二章 化学反应方向.ppt
- 《无机化学》课程PPT教学课件(药学专业)第一章 溶液.ppt
- 《无机化学》课程PPT教学课件(药学专业)绪论(重庆医科大学:赵华).ppt
- 《无机化学》课程PPT教学课件(药学专业)第八章 分子结构.pptx
- 《无机化学》课程PPT教学课件(药学专业)第七章 原子结构.pptx
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)化学反应速度.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)双氧水含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)弱酸电离度和电离常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氧化还原与电化学.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化钠的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化铅溶度积的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水样中氟含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水的硬度测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)电位滴定在酸碱滴定中的应用.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)硫酸亚铁铵的制备.ppt
