《无机化学》课程PPT教学课件(药学专业)第一章 溶液

第一章溶液 教学目的与要求 ·了解溶液的概念 ■掌握溶液浓度的各种表示法,并能熟练地进 行有关浓度的计算 ■ 掌握稀溶液的依数性及其应用 理解离子的活度 理解溶液离子强度的计算及其与活度的关系 重点:稀溶液的依数性及其应用 难点:依数性、离子的活度
第一章 溶 液 教学目的与要求 ◼ 了解溶液的概念 ◼ 掌握溶液浓度的各种表示法,并能熟练地进 行有关浓度的计算 ◼ 掌握稀溶液的依数性及其应用 ◼ 理解离子的活度 ◼ 理解溶液离子强度的计算及其与活度的关系 重点:稀溶液的依数性及其应用 难点:依数性、离子的活度

第一章溶液 第一节溶解 第二节 溶液的浓度 第三节 溶液的依数性 第四节 电解质溶液
第一章 溶 液 第一节 溶解 第二节 溶液的浓度 第三节 溶液的依数性 第四节 电解质溶液

分散系:粗分散系、胶体分散系、分子分散系(气、液、固) 分散相、分散介质 溶液(solution):一种物质以分子、原子或离子状态分 散于另一种物质中所构成的均匀而又 稳定的分散体系(分子分散系)。 溶剂(solvent):在液态溶液中的液体组分 溶质(solute):溶解在液体中的气体或固体 浓度(concentration):溶液中溶剂和溶质的相对含量
分散系:粗分散系、胶体分散系、分子分散系(气、液、固) 分散相、分散介质 溶液(solution):一种物质以分子、原子或离子状态分 散于另一种物质中所构成的均匀而又 稳定的分散体系(分子分散系)。 溶剂(solvent):在液态溶液中的液体组分 溶质(solute):溶解在液体中的气体或固体 浓度(concentration):溶液中溶剂和溶质的相对含量

第一节溶解 溶解不只是简单的物理过程。常伴随能量、体 积的变化,有时也有颜色改变。 一、溶解和水合作用 分子溶液,离子溶液 NaCI(s)+H2O(1)=Na(aq)+Cl(aq) 水合作用hydration):正负离子吸引水分子中的 氧和氢原子,每个离子都被水分子包围的现象。 溶解实际包括两个过程:一是溶质被分散,吸热、体 积增大;二是溶剂化(solvation),放热、体积减小
第一节 溶 解 溶解不只是简单的物理过程。常伴随能量、体 积的变化,有时也有颜色改变。 一、溶解和水合作用 分子溶液,离子溶液 NaCl(s) + H2O(l) = Na+ (aq) + Cl- (aq) 水合作用(hydration):正负离子吸引水分子中的 氧和氢原子,每个离子都被水分子包围的现象。 溶解实际包括两个过程:一是溶质被分散,吸热、体 积增大;二是溶剂化(solvation),放热、体积减小
二、溶解度和相似相溶 饱和溶液(saturated solution):已溶解的溶质与其未 溶解的部分稳定共存 溶解度(solubility):饱和溶液中溶剂和溶质的相对含量 中学里介绍过把某温度 易溶>10 下100克水里某物质溶解 0 可溶1-10 的最大克数叫溶解度.习 微溶0.1-1 惯上按溶解度大小,把 溶液分为: 难溶<0.1
二、溶解度和相似相溶 饱和溶液(saturated solution):已溶解的溶质与其未 溶解的部分稳定共存 溶解度(solubility) :饱和溶液中溶剂和溶质的相对含量 中学里介绍过把某温度 下100克水里某物质溶解 的最大克数叫溶解度.习 惯上按溶解度大小,把 溶液分为: 易溶 >10 可溶 1-10 微溶 0.1-1 难溶 <0.1

相似相溶原理 the principle of similitude between solute and solvent “相似相溶”原理,即非极性物质可以溶解在非极性溶剂中 (例如碘溶于四氯化碳中),极性物质和离子型晶体易溶于极性 溶剂(如水)中。主要表现在: a.溶质分子于溶剂分子的结构越相似,相互溶解越容易; .溶质分子的分子间作用力与溶剂分子间作用力越相似,越易 互溶
相似相溶原理 (the principle of similitude between solute and solvent) “相似相溶”原理,即非极性物质可以溶解在非极性溶剂中 (例如碘溶于四氯化碳中),极性物质和离子型晶体易溶于极性 溶剂(如水)中。主要表现在: a. 溶质分子于溶剂分子的结构越相似,相互溶解越容易; b.溶质分子的分子间作用力与溶剂分子间作用力越相似,越易 互溶

第二节溶液的浓度 (The concentration of solution) >广义的浓度定义是溶液中的溶质和溶剂的相对含量
第二节 溶液的浓度 (The concentration of solution) ➢ 广义的浓度定义是溶液中的溶质和溶剂的相对含量
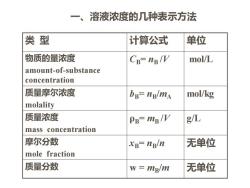
一、溶液浓度的几种表示方法 类型 计算公式 单位 物质的量浓度 CB=nB/V mol/L amount-of-substance concentration 质量摩尔浓度 bB-ng/mA mol/kg molality 质量浓度 PB=mg/V g/L mass concentration 摩尔分数 xB=ng/n 无单位 mole fraction 质量分数 w=mglm 无单位
类 型 计算公式 单位 物质的量浓度 amount-of-substance concentration CB= nB /V mol/L 质量摩尔浓度 molality bB= nB/mA mol/kg 质量浓度 mass concentration ρB= mB /V g/L 摩尔分数 mole fraction xB= nB/n 无单位 质量分数 w = mB/m 无单位 一、溶液浓度的几种表示方法

注意事项 1。质量浓度与溶液的比重(密度)。 2。质量分数与质量百分浓度((98%的疏酸)》 3。体积百分浓度(体积分数)。 4。质量-体积百分浓度 二.各种浓度之间的换算。如p7表1-1
注意事项 1。质量浓度与溶液的比重(密度)。 2。质量分数与质量百分浓度(98%的硫酸) 3。体积百分浓度(体积分数)。 4。质量-体积百分浓度 二. 各种浓度之间的换算。如:p7表1-1

例 将7.00g结晶草酸H2C20,2H0)溶30g永币, 求草酸的质量摩尔浓度和摩尔分数x(H2C2O4)。 解 MH2C2042H2O)=126gmo1,而MH2C204)= 90.0gmo1,故7.00g结晶草酸中草酸的质量为 (H2C204)= 7.00g×90.0gmol =5.00g 溶液中水的质量为126g·mo m(H20)=93.0g+(7.00-5.00)g=95.0g b(H,C,O4)= 5.00g 1000g 90.0gmo'×95.0g1kg =0.585mol-kg x(H,C,04)= 5.00g/90.0g·mo1 =0.0104 5.00g/90.0gmor)+(95.0g/18.0gmo1) 例2. P8 习题1(20)
例 将7.00g结晶草酸(H2C2O4·2H2O)溶于93.0g水中, 求草酸的质量摩尔浓度和摩尔分数x(H2C2O4 )。 解 M(H2C2O4·2H2O)= 126g·mol-1 ,而M(H2C2O4 )= 90.0 g·mol-1 , 故7.00g结晶草酸中草酸的质量为 5.00g 126g mol 7.00g 90.0g mol (H C O ) -1 -1 2 2 4 = m = 溶液中水的质量为 m (H2O)=93.0g+(7.00 -5.00)g=95.0g 0.0104 ) ( ( ) ( ) 0.585 = + = = = (5.00g/90.0g mol 95.0g/18.0g mol ) 5.00g/90.0g mol x H C O mol k g 1kg 1000g 90.0g mol 95.0g 5.00g b H C O -1 -1 -1 2 2 4 -1 2 2 4 -1 例2. P8 习题1(20)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机化学》课程PPT教学课件(药学专业)第二章 化学反应方向.ppt
- 《无机化学》课程PPT教学课件(药学专业)第三章 化学反应的速率.ppt
- 《无机化学》课程PPT教学课件(药学专业)第四章 化学平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第五章 酸碱平衡及难溶电解质的沉淀——溶解平衡.ppt
- 《无机化学》课程PPT教学课件(药学专业)第六章 氧化还原.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十二章 p区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第九章 配位化合物.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十一章 ds区元素.ppt
- 《无机化学》课程PPT教学课件(药学专业)第十章_s区元素性质.ppt
- 《无机化学》课程PPT教学课件(药学专业,实验讲稿,重庆医科大学:赵华).ppt
- 《无机化学》课程作业习题(无答案)化学平衡.doc
- 《无机化学》课程作业习题(无答案)化学反应速率.doc
- 《无机化学》课程作业习题(无答案)氧化还原.doc
- 《无机化学》课程作业习题(无答案)酸碱平衡.doc
- 《无机化学》课程作业习题(无答案)原子结构.doc
- 《无机化学》课程作业习题(无答案)难容电解质的沉淀溶解平衡.doc
- 《无机化学》课程作业习题(无答案)配位化合物.doc
- 《无机化学》课程作业习题(无答案)无机化学综合练习题1.doc
- 《无机化学》课程作业习题(无答案)分子结构.doc
- 《无机化学》课程作业习题(无答案)非金属元素.doc
- 《无机化学》课程PPT教学课件(药学专业)绪论(重庆医科大学:赵华).ppt
- 《无机化学》课程PPT教学课件(药学专业)第八章 分子结构.pptx
- 《无机化学》课程PPT教学课件(药学专业)第七章 原子结构.pptx
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)化学反应速度.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)双氧水含量测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)弱酸电离度和电离常数测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氧化还原与电化学.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化钠的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)氯化铅溶度积的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水样中氟含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)水的硬度测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)电位滴定在酸碱滴定中的应用.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)硫酸亚铁铵的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)碳酸钠含量的测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)维生素测定.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)缓冲溶液的性质.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)荧光分析法测定硫酸奎尼丁的含量.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)葡萄糖酸锌的制备.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)配合物的生成和性质.ppt
- 《无机化学》课程PPT教学课件(医学及相关专业,实验讲稿)酸碱标准溶液的比较和标定.ppt
