哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第8章 原子结构和元素周期律

第五节元素性质的周期性 第四节元素周期表 第三节多电子原子结构 第二节氢原子结构 第一节微观粒子的特征 周期律 第八章原子结构和元素
第八章原子结构和元素 周期律 第一节微观粒子的特征 第二节氢原子结构 第三节多电子原子结构 第四节元素周期表 第五节元素性质的周期性

第一节 微观粒子的特征 一、氢原子光谱和Bohr理论 二、电子的波粒二象性和不确定原理
第一节 微观粒子的特征 一、氢原子光谱和 Bohr 理论 二、电子的波粒二象性和不确定原理

、 氢原子光谱和Bohr理论 19世纪,物理学家Cr00kS等人在研究稀薄 气体放电现象时发现了电子。1897年,Thomson 测定出电子的荷质比(e/m)为1.76×1011Ckg1 实验表明,电子的荷质比是一个常数,它与电极 材料或放电管中气体的性质无关。 1909年,Millikan通过油滴实验测得电子的 电荷为1.6×1019C。根据电子的荷质比,求得电 子的质量为9.11×10-31kg。后来,科学家们还采 用了紫外光照射物质、加热金属丝、放射性元素 放出B射线等方法产生电子。测定结果表明,各 种来源的电子的电荷和质量均相同,电子普遍存 在于原子之中
一、氢原子光谱和 Bohr 理论 19世纪,物理学家 Crookes 等人在研究稀薄 气体放电现象时发现了电子。1897年, 测定出电子的荷质比(e/me)为 1.76×1011 C·kg-1 。 实验表明,电子的荷质比是一个常数,它与电极 材料或放电管中气体的性质无关。 1909 年,Millikan 通过油滴实验测得电子的 电荷为1.6×10-19C。根据电子的荷质比,求得电 子的质量为9.11×10-31kg。后来,科学家们还采 用了紫外光照射物质、加热金属丝、放射性元素 放出β射线等方法产生电子。测定结果表明,各 种来源的电子的电荷和质量均相同,电子普遍存 在于原子之中。 Thomson

原子是电中性的,原子中除了带负电的电子 外,必然还有带正电的部分。电子和正电部分在 小小的原子空间中是如何分布的? l911年,Rutherford.用一束高速运动的u粒 子(He2+)流轰击一块10-610-7m厚的金箔。 发现绝大多数的α粒子几乎不受阻拦地直线通过, 约万分之一的仪粒子的运动方向发生偏转,极个 别的α粒子甚至被反弹回来
原子是电中性的,原子中除了带负电的电子 外,必然还有带正电的部分。电子和正电部分在 小小的原子空间中是如何分布的? 1911年,Rutherford用一束高速运动的α粒 子(He2+)流轰击一块10-6~10-7 m 厚的金箔。 发现绝大多数的α粒子几乎不受阻拦地直线通过, 约万分之一的α粒子的运动方向发生偏转,极个 别的α粒子甚至被反弹回来

Rutherford在u粒子散射实验的基础上,提 出了行星式原子轨道模型。他认为:原子像一个 行星系,其中心有一个体积很小却几乎集中了原 子全部质量的带正电荷的原子核,而带负电荷的 电子在核外空间绕核高速运动,就像行星围绕着 太阳运动一样
Rutherford 在α粒子散射实验的基础上,提 出了行星式原子轨道模型。他认为:原子像一个 行星系,其中心有一个体积很小却几乎集中了原 子全部质量的带正电荷的原子核,而带负电荷的 电子在核外空间绕核高速运动,就像行星围绕着 太阳运动一样

(一)氢原子光谱 人们肉眼能观察到的可见光的波长范围是 400~760nm。当一束白光通过石英棱镜时,形 成红、橙、黄、绿、青、蓝、紫等没有明显分 界线的彩色带状光谱,这种带状光谱称为连续 光谱
(一)氢原子光谱 人们肉眼能观察到的可见光的波长范围是 400~760nm。当一束白光通过石英棱镜时,形 成红、橙、黄、绿、青、蓝、紫等没有明显分 界线的彩色带状光谱,这种带状光谱称为连续 光谱

气态原子被火花、电弧或其他方法激发产生 的光,经棱镜分光后,得到不连续的线状光谱, 这种线状光谱称为原子光谱。 氢原子光谱是最简单的原子光谱。在抽成真 空的光电管中充入稀薄纯氢气,并通过高压放电, 所放出的光经棱镜分光后形成按波长次序排列的 不连续的线状光谱。氢原子光谱在可见光区有4 条比较明显的谱线,分别用H,HB,Hy,H表 示
气态原子被火花、电弧或其他方法激发产生 的光,经棱镜分光后,得到不连续的线状光谱, 这种线状光谱称为原子光谱。 氢原子光谱是最简单的原子光谱。在抽成真 空的光电管中充入稀薄纯氢气,并通过高压放电 所放出的光经棱镜分光后形成按波长次序排列的 不连续的线状光谱。氢原子光谱在可见光区有 条比较明显的谱线,分别用 Hα,Hβ,Hγ,Hδ表 示。 , 4
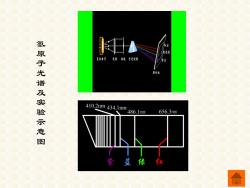
氢原子光谱及实验示意图 相 410.2nm434.1nm 486.1nm 656.3nm 紫蓝绿
氢原子光谱及实验示意图

1913年,瑞典物理学家Rudberg总结出适用 氢原子光谱的谱线频率的通式: O=R 1n2 在某一瞬间一个氢原子只能产生一条谱线, 实验中之所以能同时观察到全部谱线,是由于很 多个氢原子受到激发,跃迁到高能级后又返回低 能级的结果
1913年,瑞典物理学家 Rudberg 总结出适用 氢原子光谱的谱线频率的通式: 在某一瞬间一个氢原子只能产生一条谱线, 实验中之所以能同时观察到全部谱线,是由于很 多个氢原子受到激发,跃迁到高能级后又返回低 能级的结果。 2 2 1 2 1 1 R ( ) n n = −

(二)Bohr理论 1913年,丹麦青年物理学家Bohr提出了 新的原子结构模型。其要点如下: (1)电子只能在某些特定的圆形轨道上绕 核运动,在这些轨道上运动的电子既不放出能 量,也不吸收能量。 (2)电子在不同轨道上运动时,其能量是 不同的。在离核越远的轨道上,能量越高;在 离核越近的轨道上,能量越低。轨道的这些不 同的能量状态称为能级,其中能量最低的状态 称为基态,其余能量高于基态的状态称为激发 态。原子轨道的能量是量子化的,氢原子轨道 的能量为: E,3.6
(二)Bohr 理论 1913 年,丹麦青年物理学家 Bohr 提出了 新的原子结构模型。其要点如下: (1)电子只能在某些特定的圆形轨道上绕 核运动,在这些轨道上运动的电子既不放出能 量,也不吸收能量。 (2)电子在不同轨道上运动时,其能量是 不同的。在离核越远的轨道上,能量越高;在 离核越近的轨道上,能量越低。轨道的这些不 同的能量状态称为能级,其中能量最低的状态 称为基态,其余能量高于基态的状态称为激发 态。原子轨道的能量是量子化的,氢原子轨道 的能量为: 2 13.6 E n eV n − =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第7章 氧化还原反应和电极电势.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第6章 难溶强电解质的沉淀——溶解平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第5章 酸碱解离平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第4章 化学反应速率.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第3章 化学平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第1章 溶液与胶体分散系.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十六章 氨基酸 AMINO ACID.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十五章 脂类 LIPID.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十四章 糖类 SACCHARIDE.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十三章 杂环化合物 Heterocyclic Compound.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十二章 胺 Amine.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十一章 羧酸衍生物 Derivatives of Carboxylic Acid.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十章 羧酸和取代羧酸 Carboxylic Acid and Substituted Carboxylic Acid.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第九章 醛、酮和醌.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第六章 卤代烃 Halohydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第五章 芳香烃 Aromatic hydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第四章 烯烃和炔烃 Alkene and Alkyne.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第三章 对映异构.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃和环烷烃 Alkane and Cycloalkane.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第一章 有机化学基础知识 organic chemistry.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第9章 分子结构(主讲:徐春祥).ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第10章 配位化合物.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第11章 定量分析中的误差与有效数字.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第12章 滴定分析法.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第13章 吸光光度法.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第一章 有机化合物的结构与性质(主讲:李侃社、蔡会武).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第二章 烷烃(Alkanes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第三章 烯烃(alkenes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第四章 炔烃、二烯烃、红外光谱.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第五章 脂环烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第六章 单环芳烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第七章 多环芳烃与非苯芳烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十章 醇和醚.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十一章 酚和醌.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十二章 醛和酮.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十三章 羧酸及其衍生物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十六章 重氮化合物和偶氮化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十八章 碳水化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第二十章 有机合成.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第一章 绪论(负责人:车振明).ppt
