哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第4章 化学反应速率

第五节催化剂对化学反应速率的影响 第四节温度对化学反应速率的影响 第三节浓度对化学反应速率的影响 第二节化学反应速率理论简介 第一节化学反应速率及其表示方法 第四章化学反应速率
第一节化学反应速率及其表示方法 第二节化学反应速率理论简介 第三节浓度对化学反应速率的影响 第四节温度对化学反应速率的影响 第五节 第四章化学反应速率 催化剂对化学反应速率的影响

第一节化学反应速率及其表示方法 一、转化速率 二、反应速率 三、消耗速率和生成速率
第一节 化学反应速率及其表示方法 一、转化速率 二、反应速率 三、消耗速率和生成速率

一、转化速率 转化速率定义为: der dg dt 根据反应进度的定义有: d 1 dnB dt vB dt 转化速率与B的选择无关,但与化学反应 方程式的写法有关
一、转化速率 转化速率定义为: 根据反应进度的定义有: 转化速率与 B 的选择无关,但与化学反应 方程式的写法有关。 B B d 1 d d d n t v t = = . def d dt

二、反应速率 对于等容反应,通常用单位体积的转化速率描述 化学反应的快慢,并称之为反应速率。 v= 专=1dnBP )1 dcB VB dt VB dt 对于化学反应: aA(aq)+bB(aq)->yY(aq)+zZ(aq) 反应速率可表示为: v= 1 dcA=1 den1 dcy=1 dcz a dt b dty dt z dt 对于气相反应,常用气体的分压力代替浓度: 1 dpB Va dt
二、反应速率 化学反应的快慢,并称之为反应速率。 对于气相反应,常用气体的分压力代替浓度: 对于等容反应,通常用单位体积的转化速率描述 B B B B 1 d( / ) 1 d d d n V c V v t v t v = = = a b y z A(aq)+ B(aq) Y(aq)+ Z(aq) ⎯⎯→ 1 d 1 d 1 d 1 d A B Y Z = = = d d d d c c c c a t b t y t z t v = − − B B 1 d d p v t v = 对于化学反应: 反应速率可表示为:

三、消耗速率和生成速率 消耗速率定义为反应物A的浓度随时间的 变化率: v defdc dt 生成速率定义为产物乙的浓度随时间的变 化率: v der de dt 反应速率、消耗速率与生成速率的关系为: u=-"4=业 VA VZ
三、消耗速率和生成速率 消耗速率定义为反应物 A 的浓度随时间的 变化率: 生成速率定义为产物 Z 的浓度随时间的变 化率: 反应速率、消耗速率与生成速率的关系为: d A d c t v − def A Z A Z = v v − = v v v Z Z d d c t v def A

第二节化学反应速率理论 一、碰撞理论 二、过渡状态理论
第二节 化学反应速率理论 一、碰撞理论 二、过渡状态理论

一、碰撞理论 碰撞理论认为:化学反应的实质是原子的 重新组合,在组合过程中,必须破坏反应物分 子中的化学键,才能形成产物分子中的化学键。 而旧化学键的断裂和新化学键的形成,是通过 反应物分子间的相互碰撞来实现的。在反应物 分子的无数次碰撞中,只有极少数的碰撞才能 发生化学反应。这种能够发生化学反应的碰撞 称为有效碰撞。能够发生有效碰撞的分子称为 活化分子,它比普通分子具有更高的能量
一、碰撞理论 碰撞理论认为:化学反应的实质是原子的 重新组合,在组合过程中,必须破坏反应物分 子中的化学键,才能形成产物分子中的化学键。 而旧化学键的断裂和新化学键的形成,是通过 反应物分子间的相互碰撞来实现的。在反应物 分子的无数次碰撞中,只有极少数的碰撞才能 发生化学反应。这种能够发生化学反应的碰撞 称为有效碰撞。能够发生有效碰撞的分子称为 活化分子,它比普通分子具有更高的能量
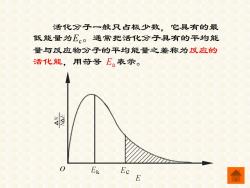
活化分子一般只占极少数,它具有的最 低能量为E。通常把活化分子具有的平均能 量与反应物分子的平均能量之差称为反应的 活化能,用符号E。表示。 Ek Ec E
活化分子一般只占极少数,它具有的最 低能量为Ec。通常把活化分子具有的平均能 量与反应物分子的平均能量之差称为反应的 活化能,用符号 Ea表示

在一定温度下,反应的活化能越大,活化 分子的分子分数越小,活化分子越少,有效碰 撞次数就越少,因此化学反应速率越慢;反应 的活化能越小,活化分子的分子分数越大,活 化分子越多,有效碰撞次数就越多,化学反应 速率越快。除了要考虑反应物分子间的碰撞频 率和反应物的活化能外,还要考虑碰撞时分子 的空间取向。活化分子要发生有效碰撞,它们 彼此间的取向必须适当
在一定温度下,反应的活化能越大,活化 分子的分子分数越小,活化分子越少,有效碰 撞次数就越少,因此化学反应速率越慢;反应 的活化能越小,活化分子的分子分数越大,活 化分子越多,有效碰撞次数就越多,化学反应 速率越快。除了要考虑反应物分子间的碰撞频 率和反应物的活化能外,还要考虑碰撞时分子 的空间取向。活化分子要发生有效碰撞,它们 彼此间的取向必须适当

⊙0 ⊙0 N O 0 ⊙ ON 分子的“有效”碰撞与“天效” 碰撞
分子的 “有效”碰撞与 “无效” 碰撞
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第3章 化学平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第1章 溶液与胶体分散系.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十六章 氨基酸 AMINO ACID.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十五章 脂类 LIPID.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十四章 糖类 SACCHARIDE.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十三章 杂环化合物 Heterocyclic Compound.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十二章 胺 Amine.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十一章 羧酸衍生物 Derivatives of Carboxylic Acid.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十章 羧酸和取代羧酸 Carboxylic Acid and Substituted Carboxylic Acid.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第九章 醛、酮和醌.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第六章 卤代烃 Halohydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第五章 芳香烃 Aromatic hydrocarbon.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第四章 烯烃和炔烃 Alkene and Alkyne.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第三章 对映异构.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第二章 烷烃和环烷烃 Alkane and Cycloalkane.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第一章 有机化学基础知识 organic chemistry.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十七章 ds区元素.ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十六章 d区元素(二).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十五章 d区元素(一).ppt
- 哈尔滨医科大学:《无机化学》课程教学资源(PPT课件)第十四章 p区元素(二).ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第5章 酸碱解离平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第6章 难溶强电解质的沉淀——溶解平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第7章 氧化还原反应和电极电势.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第8章 原子结构和元素周期律.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第9章 分子结构(主讲:徐春祥).ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第10章 配位化合物.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第11章 定量分析中的误差与有效数字.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第12章 滴定分析法.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第13章 吸光光度法.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第一章 有机化合物的结构与性质(主讲:李侃社、蔡会武).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第二章 烷烃(Alkanes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第三章 烯烃(alkenes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第四章 炔烃、二烯烃、红外光谱.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第五章 脂环烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第六章 单环芳烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第七章 多环芳烃与非苯芳烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十章 醇和醚.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十一章 酚和醌.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十二章 醛和酮.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十三章 羧酸及其衍生物.ppt
