西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十章 醇和醚

第十章 2 醇和醚 ·学习要求: 。1. 掌握醇、醚的分类及其命名法。 2. 掌握氢键对熔点、沸点、水溶性、红外吸收峰位移 等物理性质的影响。 3.掌握醇、醚的化学性质、碳正离子的重排。 ● 4.理解醇和醚的结构特点。 5.理解B一消除E1、E2历程,消除反应的立体化学特 征。 6.理解E1与SN1,E2与SN2之间的竞争及影响因素。 7.了解醇、醚的制备方法。 8.了解甲醇、乙醇、乙二醇和丙三醇的制法和用途。 9.了解硫醇、硫醚的制法和用途。 10.了解乙醚、环氧乙烷的性质和用途。 11.了解一般冠醚及相转移催化剂。 作业1:P2441,2,3,4,5,6,7,8,9,11,12,13,14, 17,18,20,21,22,25,28
第十章 醇和醚 • 学习要求: • 1.掌握醇、醚的分类及其命名法。 2.掌握氢键对熔点、沸点、水溶性、红外吸收峰位移 等物理性质的影响。 3.掌握醇、醚的化学性质、碳正离子的重排。 • 4.理解醇和醚的结构特点。 5.理解β—消除 E1、E2历程,消除反应的立体化学特 征。 6.理解E1与SN1,E2与SN2之间的竞争及影响因素。 7.了解醇、醚的制备方法。 8.了解甲醇、乙醇、乙二醇和丙三醇的制法和用途。 9. 了解硫醇、硫醚的制法和用途。 10. 了解乙醚、环氧乙烷的性质和用途。 11. 了解一般冠醚及相转移催化剂。 作业1: P244 1,2,3,4,5,6,7,8,9,11,12,13,14, 17,18,20,21,22,25,28
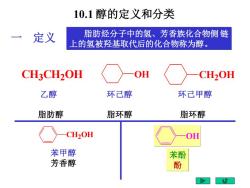
10.1醇的定义和分类 定义 脂肪烃分子中的氢、芳香族化合物侧链 上的氢被羟基取代后的化合物称为醇。 CH3CH2OH OH CH2OH 乙醇 环己醇 环己甲醇 脂肪醇 脂环醇 脂环醇 CH2OH 苯甲醇 苯酚 芳香醇 酚
脂肪烃分子中的氢、芳香族化合物侧 链 上的氢被羟基取代后的化合物称为醇。 乙醇 环己醇 环己甲醇 脂肪醇 脂环醇 脂环醇 CH3 CH2OH OH CH2OH CH2OH OH 苯甲醇 芳香醇 苯酚 酚 10.1 醇的定义和分类 一 定义

二 分类 CH3CH2CH2CH2OH 一 级醇(伯醇) CH2=CH-OHCH3CHO CH3CH2CHOH 烯醇 元 二级醇(仲醇) CH3 CH3 RCH-C-OH ==RCH2C-R 醇 CH3COH 三级醇(叔醇) R CH3 烯醇 R OH -H0 R 二 C=0 R OH R 元 HOCH2CH2OH 乙二醇 OH 醇 -H20 RCH RCHO OH 三元醇 HOCH2 CHCH2OH丙三醇(甘油) OH -H20 O RCOOH OH H
二 分类 三 元 醇 二 元 醇 一 元 醇 CH3CH2CH2CH2OH CH3CH2CHOH CH3 一级醇(伯醇) 二级醇(仲醇) 三级醇(叔醇) CH2=CH-OH CH3CHO RCH=C-OH RCH2 -C-R' R' O HOCH2CH2OH C R R' OH OH -H2O C R R' O RCH OH OH RCHO -H2O HOCH2CHCH2OH OH C OH OH OH R -H2O RCOOH 乙二醇 丙三醇(甘油) 烯醇 烯醇 CH3COH CH3 CH3

10.2醇的命名 一衍生物命名法(看作甲醇的衍生物) CH3 (CH3)CHCHOH 甲基异丙基甲醇 二普通命名法(烷基的习惯名称+醇) CH3 (CH3)CHOH CH3CH2CHOH 异丙醇 二级丁醇
10.2 醇的命名 一 衍生物命名法(看作甲醇的衍生物) 二 普通命名法(烷基的习惯名称+醇) CH3 (CH3 )2CHOH 甲基异丙基甲醇 CH3 (CH3 )2CHCHOH 异丙醇 二级丁醇 CH3CH2CHOH
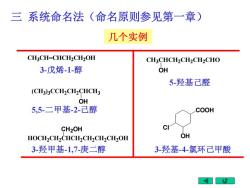
三系统命名法(命名原则参见第一章) 几个实例 CH3CH=CHCH2CH2OH CH3CHCH2CH2CH2CHO 3-戊烯-1-醇 OH 5-羟基己醛 (CH3)3CCH2CH2CHCH3 OH 5,5-二甲基-2-己醇 COOH CH2OH HOCH2CH2CHCH2CH2CH2CH2OH OH 3-羟甲基-1,7-庚二醇 3羟基-4-氯环己甲酸
三 系统命名法(命名原则参见第一章) (CH3 )3CCH2CH2CHCH3 OH CH3CH=CHCH2CH2OH CH2OH HOCH2CH2CHCH2CH2CH2CH2OH CH3CHCH2CH2CH2CHO OH COOH OH Cl 3-戊烯-1-醇 5,5-二甲基-2-己醇 3-羟甲基-1,7-庚二醇 5-羟基己醛 3-羟基-4-氯环己甲酸 几个实例

10.3醇的结构特点 大部分醇的羟基与s即3杂化的碳原子相连。烯 醇中的羟基与s即杂化的碳原子相连。 2根据甲醇分子的键长、键角分析,醇羟基中 的氧是sp3杂化。 3 醇的偶极矩在2D左右。甲醇的偶极矩为 u=1.71D。 一般地说,相邻两个碳上最大的两个基团处 于对交叉最稳定,但当这两个基团可能以氢 键缔合时,则这两个基团处于邻交叉成为优 势构象
10.3 醇的结构特点 1 大部分醇的羟基与sp3杂化的碳原子相连。烯 醇中的羟基与sp2杂化的碳原子相连。 2 根据甲醇分子的键长、键角分析,醇羟基中 的氧是sp3杂化。 3 醇的偶极矩在2D左右。甲醇的偶极矩为 u=1.71D。 4 一般地说,相邻两个碳上最大的两个基团处 于对交叉最稳定,但当这两个基团可能以氢 键缔合时,则这两个基团处于邻交叉成为优 势构象

第10.4醇的物理性质、光谱特征 物理性质 醇分子之间能形成氢键。 固态,缔合较为牢固。液态,形成氢键和氢键的解离 均存在。气态或在非极性溶剂的稀溶液中,醇分子可以单 独存在。 由于醇分子之间能形成氢键,沸点较相应分子量的烷 烃高。 由于醇分子与水分子之间能形成氢键,三个碳的醇和 叔丁醇能与水混溶。 二光谱特征(参见第八章)
第10.4 醇的物理性质、光谱特征 醇分子之间能形成氢键。 固态,缔合较为牢固。液态,形成氢键和氢键的解离 均存在。气态或在非极性溶剂的稀溶液中,醇分子可以单 独存在。 由于醇分子之间能形成氢键,沸点较相应分子量的烷 烃高。 由于醇分子与水分子之间能形成氢键,三个碳的醇和 叔丁醇能与水混溶。 一 物理性质 二 光谱特征(参见第八章)
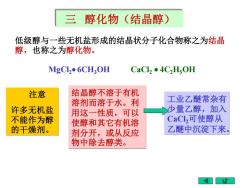
三醇化物 (结晶醇) 低级醇与一些无机盐形成的结晶状分子化合物称之为结晶 醇,也称之为醇化物。 MgCl2●6CH30H CaCl2●4C2HsOH 注意 结晶醇不溶于有机 溶剂而溶于水。利 工业乙醚常杂有 许多无机盐 用这一性质,可以 少量乙醇,加入 不能作为醇 使醇和其它有机溶 CaCl,可使醇从 的干燥剂。 剂分开,或从反应 乙醚中沉淀下来。 物中除去醇类
三 醇化物(结晶醇) 低级醇与一些无机盐形成的结晶状分子化合物称之为结晶 醇,也称之为醇化物。 MgCl2• 6CH3OH CaCl2 • 4C2H5OH 注意 许多无机盐 不能作为醇 的干燥剂。 结晶醇不溶于有机 溶剂而溶于水。利 用这一性质,可以 使醇和其它有机溶 剂分开,或从反应 物中除去醇类。 工业乙醚常杂有 少量乙醇,加入 CaCl2可使醇从 乙醚中沉淀下来

10.5醇的反应 一醇反应性的总分析 二醇羟基中氢的反应 三碳氧键的断裂,羟基被卤原子取代 四成酯反应 五氧化反应 六脱氢反应 七多元醇的特殊反应
一 醇反应性的总分析 二 醇羟基中氢的反应 三 碳氧键的断裂,羟基被卤原子取代 四 成酯反应 五 氧化反应 六 脱氢反应 七 多元醇的特殊反应 10.5 醇的反应
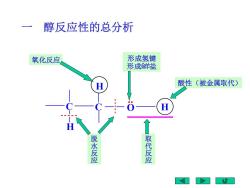
醇反应性的总分析 氧化反应 形成氢键 形成金詳盐 酸性(被金属取代) 脱水反应 取代反应
一 醇反应性的总分析 C C O H H H 氧化反应 取 代 反 应 脱 水 反 应 酸性(被金属取代) 形成氢键 形成金羊盐
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第七章 多环芳烃与非苯芳烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第六章 单环芳烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第五章 脂环烃.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第四章 炔烃、二烯烃、红外光谱.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第三章 烯烃(alkenes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第二章 烷烃(Alkanes).ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第一章 有机化合物的结构与性质(主讲:李侃社、蔡会武).ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第13章 吸光光度法.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第12章 滴定分析法.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第11章 定量分析中的误差与有效数字.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第10章 配位化合物.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第9章 分子结构(主讲:徐春祥).ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第8章 原子结构和元素周期律.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第7章 氧化还原反应和电极电势.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第6章 难溶强电解质的沉淀——溶解平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第5章 酸碱解离平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第4章 化学反应速率.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第3章 化学平衡.ppt
- 哈尔滨医科大学:《基础化学》课程教学课件(PPT讲稿)第1章 溶液与胶体分散系.ppt
- 哈尔滨医科大学:《有机化学》课程教学资源(PPT课件)第十六章 氨基酸 AMINO ACID.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十一章 酚和醌.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十二章 醛和酮.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十三章 羧酸及其衍生物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十六章 重氮化合物和偶氮化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第十八章 碳水化合物.ppt
- 西安科技大学:《有机化学》课程电子教案(PPT教学课件)第二十章 有机合成.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第一章 绪论(负责人:车振明).ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第二章 糖的化学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第三章 蛋白质.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第四章 核酸的化学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第五章 维生素与辅酶.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第六章 酶学.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第七章 脂类化学与生物膜.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第八章 代谢总论与生物氧化.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第九章 糖代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十章 脂类代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十一章 蛋白质降解及氨基酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十二章 核酸的降解和核苷酸代谢.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十三章 核酸与蛋白质的生物合成及基因工程.ppt
- 西华大学:《生物化学》课程教学资源(PPT课件)第十四章 细胞代谢和基因表达的调控.ppt
