兰州交通大学:《有机化学》课程授课教案(打印版)第七章 多环芳烃和非苯芳烃
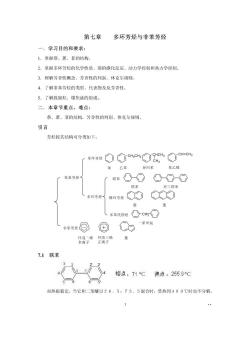
第七章多环芳烃与非苯芳烃 一,学习目的和要求: 1.掌握茶、蒽、菲的结构 2.掌握多环芳烃的化学性质、萘的碳化反应、动力学控制和热力学控制 3.理解芳香性概念、芳香性的判别、休克尔规则。 4.了解非苯芳烃的类型、代表物及反芳香性。 5.了解致癌烃、煤焦油的组成 二,本章节重点、难点: 萘、煎、菲的结构,芳香性的判别、休克尔规则。 引言 芳烃按其结构可分类如下: 「单环芳经①cc8ic今cHno 苯乙苯 异内苯 乙烯 苯系芳烃 联柴①①⊙-OO 联苯 对三联苯 多环芳经了 群OCO (多养代联经①cH○ 华回国Q力*甲 质终子“我导奶黄 7.1联苯 登 垮点,71℃沸点,2559C 对热很稳定,当它和二苯醚以26,5:73,5混合时,受热到400℃时也不分解
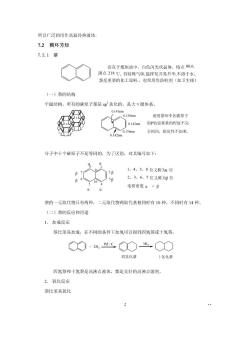
所以广泛的用作高温传热液体 7.2稠环芳烃 7.2.1装 存在于煤焦油中,白色闪光状晶体,熔点80.6, 沸点218℃,有特殊气味能挥发并易丹华,不溶于水 萘是重要的化工原料。也常用作防蛀剂(如卫生球 (一)萘的结构 平面结构,所有的碳原子都是5p杂化的,是大键体系。 0.l41nm136m 说明禁环中各碳原了 Q.142m的P轨道重叠的程度不完 全相同,稳定性不如米 分子中十个碳原子不是等同的,为了区别,对其编号如下: 1、4、5、8位又称知位 B 6 2、3、6、7位又称为邻位 aa 电荷密度a>B 茶的一元取代物只有两种,二元取代物两取代基相同时有10种,不同时有14种。 (二)萘的反应和用途 1.加成反应 萘比苯易加成,在不同的条件下加氢可以得到四氢萘或十氢萘。 ◇+HC◇出○ 四氢化恭 氢化恭 四氢萘和十氢萘是高沸点液体,都是良好的高沸点溶剂。 2.氧化反应 萘比苯易氧化
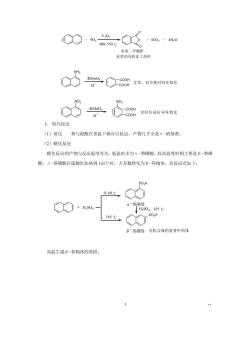
邻苯二甲酸肝 亚要的有机化工原料 c5m= 含间位基时异环氧化 3.取代反应 (1)消化与混酸在常温下就可以反应,产物几乎全是“-硝基 (2)磺化反应 磺化反应的产物与反应温度有关。低温时多为α一茶磺酸,较高温度时则主要是B-茶磷 酸,a-蒸磺酸在疏酸里加热到165℃时,大多数转化为B-异构体。其反应式如下: 0-60℃ +0,- 165℃ Bˉ类磺酸有机台成的重要中间体 高温生成B一异构体的原因: 3

S0H-位没稳定,被认为 是空间斥力的结果 斥力大 斥力小 速度控制产物 E大) 平视产物 为什么磺化反应随着温度不同生成的产物不一样呢?这里就有一个速度控制和平衡控 制的问题。 由于的的4-位比B-位活泼,在低温下,反应活性不是很强的时候,α位优先反应 生成α-萘碳酸,这种利用反应速度来控制主要产物的结果叫做速度控制.以前我们讨论苯 环的定位基效应大多是速度控制产物, 当温度升高,逆反应速度加快,产物由平衡控制:同时由于温度升高,对反应活化能 较高的B取代的反应速度也加快,加速了B取代产物的生成,当加热到160℃时,大部分☑ 异构体转变成B异构体,反应达到了平衡,所以,B萘磺酸是平衡控制产物. 两种竞争反应进程曲线图如下: +H,S0 B-茶磺酸 从曲线上我们看到,B茶磺酸比α茶磺酸更稳定,为什么呢? 8an α位活泼,反应快,但位阻大,不稳定,容易脱去:
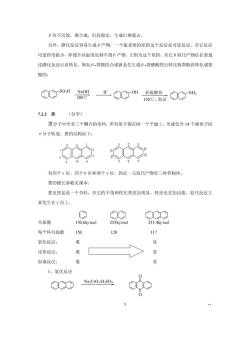
B位不活泼,难生成,但较稳定,生成后难脱去。 另外,磺化反应容易生成B产物,一个很重要的原因这个反应是可逆反应。其它反应 可逆程度很小,即使升高温度也得不到B产物。正因为这个原因,其它B取代产物往往要通 过磷化反应后再转化。例如B,茶胺的合成就是先生成B茶磺酸然后转化称萘酚再转化成茶 胺的: o州架O"0 7.22葱(自学) 蒽分子中含有三个稠合的苯环,所有原子都在同一个平面上,形成包含14个碳原子的 x分子轨道。的结构如下: 有四个a位、四个B位和两个Y位,因此一元取代产物有三种异构体 慈的键长参敌见课本, 慈虽然是是一个芳烃,但它的不饱和性比装更加明显,性质也更加活泼,取代反应主 要发生在Y位上 共振能 150.6kj/mol 255kj/mol 351.4kj/mol 每个环共振能 117 氧化反应: 难 易 还原反应: 易 加成反应: 1、氧化反应 C Na2CrO:/H:SO4
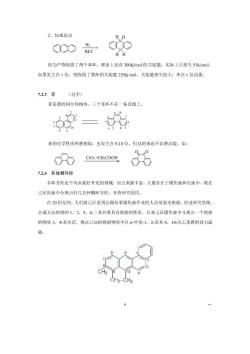
2、加成反应 ∞ H Pd/C HH 因为产物保留了两个苯环,理论上还有300kj/mol的共振能,实际上只损失51k/mol 如果发生在:位,则保留了禁环的共振能255kj/mol,共振能损失较大,所以Y位活泼。 7.2.3菲 (自学) 菲是蒽的同分异构体,三个苯环不在一条直线上 菲的化学性质和蒽相似,也发生在9,10位,但总的来说不如蒽活泼。如: cfo CrOx+CHCOOH 6 724其他稠环烃 多环芳烃是个尚未很好开发的领域,而且来源丰富,大量存在于煤焦油和石油中。现在 己从焦油中分离出好几百种稠环芳烃,有待研究利用· 在20世纪初,人们就已注意到长期从事煤焦油作业的人员易患皮肤癌。经过研究发现, 合成方法制得的1,2,5,6二苯并蕊具有致癌的性质,后来又从煤焦油中分离出一个致癌 的物质3,4苯并花。现在已知的致癌物质中以6甲基1,2-苯并5,10-次乙基慈的效力最 强

7.3非苯系芳烃 一、休克尔规则 一百多年前,凯库勒就预见到,除苯之外,可能存在其它具有芳香性的环状共轭多烯烃 为了解决这个问题,化学家们作了许多努力,但用共价键理论没有很好的解决这个问题。 1931年,休克尔(E.Huck)用简单的分子轨道计算了单环多烯烃的电子能级,从 而提出了一个判断芳香性体系的规则,称为休克尔规则。 休完尔提出,单环多烯烃要有芳香性,必须满足三个条件 ()成环原子共平面或接近于平面,平面扭转不大于0.1m (2)环状闭合共轭体系: (3)环上m电子数为n+2(0、1、2、3…) 符合上述三个条件的环状化合物,就有芳香性,这就是休克尔想则, 例如 ⊙ ◇ 6红电于 不含苯环,具有芳香性,”电子数为+2,即符合休克尔规则的环状多烯烃,我们称 之为非苯系芳烃。 二、非苯芳烃 1.具有芳香性的离子 (1)环成二烯负离子 X H又HNa苯 88 H N2 成环C共平面】无 成环C共平面 π电子=4 π电子=6n=1 有性 非环状闭合共轭」性 环状闭合共轭 (2)环庚三烯正离子
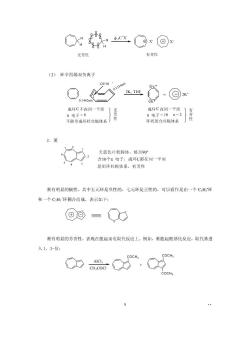
无芳性 有芳性 (3)环辛四烯双负离子 2646 4 0 2K.THF 8-@ 成环C不在同一平面 } 成环C在同一平而 。由子=8 无芳性 不能形成环状共体系 环状闭合共轭体系 天蓝色片状固体,培点90 》2 含10个元电子,成环C都在同一平面 是闭环共轭体系,有芳性 英有明显的极性,其中五元环是负性的,七元环是正性的,可以看作是由一个CH环 和一个CH,环稠合而成,表示如下: ⑧回={ Q 英有明显的芳香性,表现在能起亲电取代反应上。例如,萸能起酰基化反应,取代基进 入1,3-位 COCH
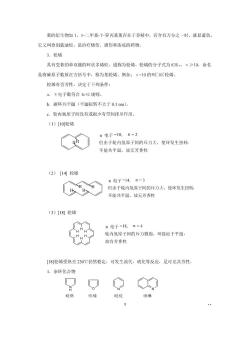
奠的衍生物如1,十二甲基7-异丙基英存在于香精中,若含有万分之一时,就显蓝色, 它又叫愈创蓝油烃,是治疗烧伤、烫伤和冻疮的药物。 3.轮烯 具有交替的单双键的环状多烯烃,通称为轮烯。轮烯的分子式为(C,x≥10,命名 是将碳原子数成在方括号中,称为某轮烯。例如:飞=10的叫[10]轮烯。 轮烯有否芳性,决定于下列条件: a,电子数符合n+2规则。 b.碳环共平面(平面扭转不大于0.1nm). 心.轮内氢原子间没有或很少有空间排斥作用。 (1)[10轮烯 元电子=10,n=2 但由于轮内氢原子间的斥力大,使环发生扭转 不能共平面,故无芳香性 (2)[14轮烯 电子-14,n-3 H 但由于轮内氢原子间的斥力大,使环发生扭转 不能共平面,故无芳香性 (3)[18]轮烯 π电子-l8,n=4 轮内氢原子间的斥力微弱,环接近于平面, 故有芳香性 [18]轮烯受热至230℃仍然稳定,可发生溴代,硝化等反应,足可见其芳性。 1.杂环化合物 呋喃 吡院 哇啉 0

上述杂环化合物都符合休克尔规则,故都有芳性。应该指出,应用休克尔规则判断出 来的芳香烃,不能用经典的芳香性概念去理解,特别是对于大环体系。如果还想用它们的化 学行为去判断(例如硝化反应),那是不可行的。在这种情况下,则是根据分子的磁性变化 来决定的,例如(以苯为例),把苯分子的电子云看成是一种环状电流(π电子云也确实 在运动),当外加磁场H作用于这个闭合环流时,便产生一个方向与H相反的感应磁场, 从而表现出苯分子有一定的反磁磁化率数值,对于不同的大环π体系,可以测定它的反磁磁 化率大小,用这个方法来确定分子是否具有芳香性。 环辛四烯这类非芳香性体系,分子不在共平面上,不能形成闭合环流,当然就不会产生 感应磁场,也就测不出反磁磁化率。 通过上述讨论可知,对芳香性的概念,要想下一个准确无误的定义是不容易的,即使用 休克尔规则,也做不到这一点,更何况芳香化学的理论还在不断发展,在近代的研究成果中, 诸如环状体系,分子共平面性这些芳香性的组成要素也受到了冲击,这反映了科学道路是无 止境的,任何理论都是相对的,我们一定要用辩证唯物主义的观点区看待事物,用发展的眼 光去看待科学,活学活用前人的理论才不至于犯教条主义、形而上学的错误,才能学好有机 化学。 作业:P11,2,3,4,5,6,7 o
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《有机化学》课程授课教案(打印版)第六章 单环芳烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第五章 脂环烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第四章 炔烃、二烯烃、红外光谱.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第三章 烯烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第二章 烷烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第一章 有机化合物的结构和性质.pdf
- 兰州交通大学:《有机化学》课程教学大纲 Organic Chemistry(打印版,负责人:柴兰琴).pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)环境化学授课教案 Environmental Chemistry.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)土壤中重金属的迁移和转化.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)污染物质的生物转化.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第四章 土壤环境化学 第一节 土壤的组成与性质.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第三章 水环境化学.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第一章 绪论 Environmental Chemistry.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)实验二 土壤对铜离子的吸附.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)理论教学大纲 Environmental Chemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 07 & 08 alkenes and alkynes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 02-Sp Brief Introduction and Nomenclature of OCs.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 02 Polar covalent Bonds acids and Bases.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 01 Structure and Bonding(主讲:王俊儒).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 00 Introduction to the course.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第八章 立体化学.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第九章 卤代烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十章 醇和醚.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十一章 酚和醌.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十二章 醛和酮、核磁共振谱.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十三章 羧酸及其衍生物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十五章 硝基化合物和胺.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十四章 β- 二羰基化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十七章 杂环化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十八章 碳水化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十六章 重氮化合物和偶氮化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第二十章 元素有机化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十九章 氨基酸、蛋白质、核酸.pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第二章 烷烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第三章 烯烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第四章 炔烃、二烯烃、红外光谱(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第五章 脂环烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第六章 单环芳烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第七章 多环芳烃和非苯芳烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第八章 立体化学(含参考答案).pdf
