兰州交通大学:《有机化学》课程授课教案(打印版)第四章 炔烃、二烯烃、红外光谱

有机化学教案 第四章 第四章炔烃二烯烃红外光谱 学习目的和要求 炔烃部分 上,掌握炔烃的异构和命名方法。 2.掌握炔烃的结构 3。掌握炔烃的物理性质 4.掌握块烃的化学性质包括加成反应、三CHH反应、碳负离子、酸性、氧化反应、聚 合反应。 5。了解重要的炔烃—乙炔。 二烯烃部分 1.掌握共轭二烯的结构和共轭效应 2.掌握共轭二烯烃的反应包括1,1-加成和1,2加成,双烯合成、聚合反应。 3.掌握丁二烯的分子结构 4。了解天然橡胶和合成橡胶。 红外光谱部分 1.了解电磁波的概念。 2.了解红外光谱的原理 3.了解红外光谱、光谱在有机物结构测定中的应用。 s. 本章节重点、难点 炔烃的结构、炔烃的化学性质包括加成反应、叁键的反应、碳负离子、酸性、氧化反应、 聚合反应、共轭二烯的结构和共轭效应、共轭二烯烃的反应包括1,4加成和1,2加成 双烯合成、聚合反应、红外光谱在有机物结构测定中的应用。 二.教学内容 (一)炔烃 炔烃和二烯烃都是通式为Cm2-2的不饱和烃,炔烃是分子中含有-C=C-的不饱和烃, 二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构不同,性质各异

4.1炔烃的异构与命名 (1)炔烯的命名与烯烃相似,只需将“烯”改为“炔”即可,例如: CHCH2C=CH CH3-CH-CECCH3 CHEC-CHEC-CH2- CH3 1-丁炔 甲基2丁炔 乙炔基 2丙炔基 (2)烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双健的最长碳铣为主链 (2)主链的编号遵循链中双、三键位次最低系列原则. (3)通常使双键具有最小的位次。 H,C=CH-CH2-C三CHCH3-CH=CH-C三CH 1-戊烯-4炔 3-戊烯-1-炔(不叫2-戊烯-4-炔》 CH3 TCH2一C≡CH (CHCH,CH),CHC=CCH 1-甲基-2-(2-丙炔基)-环己烯 1丁基-2-庚炔 4.2炔烃的结构 最简单的炔烃是乙块,现代物理方法证明,乙块分子是一个线型分子,分之中四个原了 排在一条直线上: 0.106nm0.12nm 180° 杂化轨道理论认为乙炔分子中碳原子成键时采用了SP杂化方式, 即杂化轨道的形成过程如下: 口版发 田条化 团 条化后形吸即条化道(合见s和12P限分.里甲不未条化尚P轨道两

有机化学教案 第四章】 个s即杂化轨道成180布,两个未杂化的P轨道互相垂直,且都垂直于s即杂化轨道轴所在 的直线,如下所示: 三键的形成过程如下:两个碳原子各用一个$即杂化轨道以“头碰头”方式重叠形成碳碳 0键:每个碳原子余下的一个即杂化道分别与其它原子或基团结合形成一个。单键;这样 而形成的三个▣键均处同一直线上,两个碳原子各剩余两个未参与杂化的轨道,并垂直于 该平面,且互相平行,从而侧面重叠形以“肩并肩”方式成两个π键。所以碳碳叁键相当于 由一个碳碳。键和两个碳碳π键组成,元电子云呈水桶形分布。 H 乙块的中子云 乙烯分子的成健情况 4.3炔烃的物理性质 乙炔的物理性质与烷烃、烯烃相似,比对应的烯烃高10-20°C,比重比对应的烯烃稻大. 在水里的溶解度也比烷和烯烃大些。 4.4炔烃的化学性质 4.4.1三键碳上氢原子的微弱酸性 三键碳上的氢原子具有微弱酸性(Ka25),可被金属取代,生成炔化物。因为,=C-H 键是sps键,其电负性Csp>Hs(电负性Csp=3.29,H2.2),因而显极性,具有微弱的酸 性。 2AgNO3+2NH4OH Ag-C=C-Ag+2NHaNO3+2H2O H-C=C-H- 乙热银(白色) 2Cu2CI2+2NHOH -Cu-C=C-Cu+2NHaCI+2H2O 乙炔亚渊(棕红色)

生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃,此反应可以推 测炔烃的结构,可用于鉴定末端炔烃和链中炔烃。 但要注意的是干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。所以,实验完 毕,应立即加盐酸将炔化物用酸分解,以免发生危险 Ag-C=C-Ag 2Ag 2C +364KJ/mol Ag-C=C-Ag 2HC1 H-C=C-H 2AgCl 乙炔和C=C-H在液态氨中与氨基钠作用生成炔化钠. 2 H-C CH+2NaNh蓝态氢H-C=CNa附·NH R-C=C-H+NaNH NH5()R-C GNd.NH 炔化钠是重要的有机合成中间体,可用来合成炔烃的同系物。例如 CHCH-C=CNa CH.CH-CH-Br CH,CC=CCH,CCH+NaBr(卤代烃 般用伯卤代烃)。 4.4.2加成反应 (1)催化加氢 R-C=C-R'+H2 NI R-CH-CHRHN R-CHCHR 催化氢化常用的催化剂为Pt,P,Ni,但一般难控制在烯烃阶段。 使用林德拉(Lindlar)催化剂,可使炔烃只加一分子氢而停留在烯烃阶段。且得顺 式烯烃。 R-C=CR+片nr雀化R
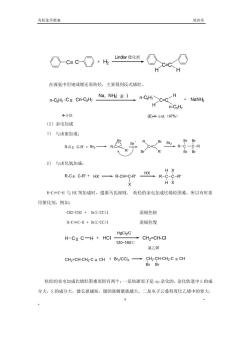
有机化学教案 第四章 -c=c-O+h①c④ H 在液氨中用钠或锂还原炔烃,主要得到反式烯烃。 n-CaH7-C Cn-CgHz_ Na,NM液)n-CH>C-CH+NaNH H n-CgH7 4辛炔 (E4辛烯(97%) (2)亲电加成 )与卤素加成: RCR+B2→R&e=c2R-e R R 2)与卤化氢加成: H× R-C=C-H与Ⅸ等加成时,遵循马氏规则。块烃的亲电加成比烯烃困难,所以有时要 用催化剂。例如: CH2-CH2+Br2/CC14 溴褪色快 H-C=C-H Br2/CC14 溴褪色慢 H-C=C-H+HCI Hocluc -CH2=CH-CI 120-180℃ 氯乙烯 炔烃的亲电加成比烯烃困难原因有两个:一是炔碳原子是sp杂化的,杂化轨道中$的成 分大,$的成分大,键长就越短,健的离解能就越大。二是电子云叠程度比乙烯中的要大, 5

比双键难于极化。 3)水化反应 在炔烃加水的反应中,先生成一个很不稳定的烯醇,烯醇很快转变为稳定的羰基化合物 (酮式结构)。烯醇和装基化合物是同分异构体,这种异构现象称为酮醇互变异构 C=COH --c0 烯醇式(不稳定) 酮式(稳定) HC=CH+HO H HSa -100℃ mg-on ond HOH 其他炔烃水化时,则生成酮。例如: CHC=CH+HzO Hs0. H2SOa fCHg-C=CH→CH-C-CH, OH eem·na=8o 91% (3)HCN、EtOH、CH.COOH等的亲核加成反应: 6Cu+g6c12-g1C-0-CN丙烯氧 Ciya 乙烯基乙醚 +mZ湖 4.4.3氧化反应 与高锰酸钾的反应如下:

有机化学教案 第四章】 gcaE+ 反应后高锰酸钾溶液颜色褪去,这个反应可用作定性鉴定。叁键比双键难于 氧化,双键和叁键同时存在时,双健首先被氧化。 CE=C(CH2)CH-C(C3)2CC-(CH2)7-0+CH3g-CH3 醛 酮0 4.4.4聚合反应 炔烃能起聚合反应,它一般不聚合成高聚物,在不同的催化剂作用下,发生不同的 低聚反应,二聚、三聚、四聚 28C=0Gc1空m0-0-6=HK2拼Z株0=C日 CuCl-NHIC1 CH2=C-C=C-CH-2二乙烯基乙快 H 苯 产量不高,副产物多 HC=(【aH 人H CH=CH HC=cai@m2— CH 环辛四烯 CH-CH CH

4.5重要的炔烃一一乙炔 乙烯的工业制法主要有电石法和由烃类裂解法两种方法,方程式如下: Ca0+3℃电炉 Eg十g四 CaC2 2H20-Ca(0H)2 HC=CH 24郑新化0=+3知 或电弧法 乙炔易溶于丙酮,为了运输和使用的安全,通常把乙块在1,2Pa下压入盛满丙酮浸 润饱和的多孔性物质(如硅藻土、软木屑、或石棉)的钢瓶中。乙炔是易爆炸的物质,高压 的乙炔,液态或固态的乙炔受到敲打或碰击时容易爆炸,乙炔的丙酮溶液是安全的,故把它 溶于丙酮中可避免爆炸的危险。 乙炔有多种用途,可以转化成多种工业原料和许多单体,例如可以合成氯丁橡胶: 20=3器t-c▣1→电@ 乙炳基乙炔 (二)二烯烃 分子中含有两个碳碳双键的烃类化合物称为二烯烃。根据两个双键的相对位置可把二烯 烃分为三类: 累积二烯烃 -C-C-C- 二烯烃了 共轭二烯烃 -C=CH-CH=CH- (孤立二烯烃-C=CH(C2)nCC-n≥1 孤立二烯烃的性质和单烯烃相似,累积二烯烃的数量少且实际应用的也不多,共轭二烯 烃有不同于共轭二婚烃的一些特性,在理论和实际应用上都很重要,我们学习的重点是共轭 二烯烃。二烯烃的命名和烯烃的命名一样称为某几烯,同时要标出双键的位置,例如:
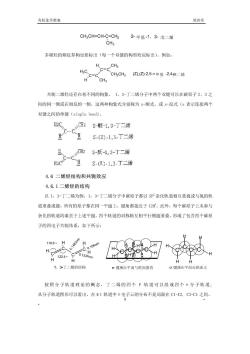
有机化学教案 第四章 CHgCH=CH-C=CH2 2甲基-1,3-戊二烯 CHa 多烯烃的顺反异构也要标出(每一个双键的构型均应标出)。例如: (.(2)2.5-=甲基-2,4二烯 共轭二烯烃还存在着不同的构象,1,3-丁二烯分子中两个双键可以在碳原子2、3之 间的同一侧或在相反的一侧,这两种构象式分别称为$-顺式,或s一反式(s表示连接两个 双键之间的单键(single bond)。 C S.(Z)-1,3.丁二烯 CH2 S-反1,3-丁二烯 c-c H2C SE)-1,3丁二 4.6二烯烃结构和共轭效应 4.6.1二烯烃的结构 以1,3-丁二烯为例,1,3丁二烯分子中碳原子都以SP杂化轨道相互重叠或与氢的轨 道重叠成键,所有的原子都在同一平面上,键角都接近于120。此外,每个碳原子上未参与 杂化的轨道均垂直于上述平面,四个轨道的对称轴互相平行侧面重叠,形成了包含四个碳原 子的四电子共轭体系,如下所示: 198。HH H合 1224.C HH自自 H 1,3丁二烯的结构 T键所在平向与纸前垂直 。谜所在平而在纸向上 按照分子轨道理论的概念,丁二烯的四个P轨道可以组成四个玉分子轨道 从分子轨道图形可以看出,在中1轨道中电子云的分布不是局限在C1-C2,C3-C4之间
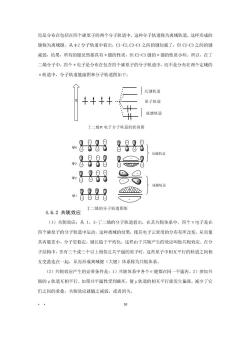
而是分布在包括在四个碳原子的两个分子轨道中,这种分子轨道称为离域轨道,这样形成的 键称为离域键。从2分子轨道中看出,C1-C2,C3C4之间的键加强了,但C2C3之间的键 减弱,结果,所有的键虽然都具有π键的性质,但C2-C3键的x键的性质小些。所以,在丁 二婚分子中,四个”电子是分布在包含四个碳原子的分子轨道中,而不是分布在两个定域的 x轨道中,分子轨道能级图和分子轨道图如下: 反建轨道 原子轨道 成键轨道 丁二烯电子分子轨道的能级图 8888 8888 反键轨道 8888 LLIF 8-888 ⊙⊙ D 888-8 4.6.2共轭效应 丁二烯的分子轨道图形 (1)共轭效应:从1,3-丁二烯的分子轨道看出,在其共轭体系中,四个n电子是在 四个碳原子的分子轨道中运动,这种离域的结果,使其电子云密度的分布有所改变,从而使 其内能更小,分子更稳定,键长趋于平均化,这样由于共轭产生的效应叫做共轭效应。在分 子结构中,含有三个或三个以上相邻且共平面的原了时,这些原子中相互平行的轨道之间相 互交盖连在一起,从而形成离域键(大键)体系称为共轭体系。 (2)共轭效应产生的必要条件是:1)共轭体系中各个0键都在同一平面内。2)参加共 轭的p轨道互相平行。如果共平面性受到破坏,使卫轨道的相互平行就发生偏离,减少了它 们之间的重叠,共辄效应就随之减弱,或者消失
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《有机化学》课程授课教案(打印版)第三章 烯烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第二章 烷烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第一章 有机化合物的结构和性质.pdf
- 兰州交通大学:《有机化学》课程教学大纲 Organic Chemistry(打印版,负责人:柴兰琴).pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)环境化学授课教案 Environmental Chemistry.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)土壤中重金属的迁移和转化.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)污染物质的生物转化.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第四章 土壤环境化学 第一节 土壤的组成与性质.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第三章 水环境化学.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第一章 绪论 Environmental Chemistry.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)实验二 土壤对铜离子的吸附.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)理论教学大纲 Environmental Chemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 07 & 08 alkenes and alkynes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 02-Sp Brief Introduction and Nomenclature of OCs.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 02 Polar covalent Bonds acids and Bases.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 01 Structure and Bonding(主讲:王俊儒).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 00 Introduction to the course.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2018)McMurry OCB 3Ed Chapter 00 Introduction to the course(主讲:王俊儒).ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2017)McMurry OCB 3Ed Chapter 12 Organohalides Nucleophilic Substitutions and Eliminations.ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2017)McMurry OCB 3Ed Chapter 09 aromatic compounds.ppt
- 兰州交通大学:《有机化学》课程授课教案(打印版)第五章 脂环烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第六章 单环芳烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第七章 多环芳烃和非苯芳烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第八章 立体化学.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第九章 卤代烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十章 醇和醚.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十一章 酚和醌.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十二章 醛和酮、核磁共振谱.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十三章 羧酸及其衍生物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十五章 硝基化合物和胺.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十四章 β- 二羰基化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十七章 杂环化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十八章 碳水化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十六章 重氮化合物和偶氮化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第二十章 元素有机化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十九章 氨基酸、蛋白质、核酸.pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第二章 烷烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第三章 烯烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第四章 炔烃、二烯烃、红外光谱(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第五章 脂环烃(含参考答案).pdf
