兰州交通大学:《有机化学》课程授课教案(打印版)第二章 烷烃

有机化学教案 第二章 第二章烷烃 学习目的和要求: 1.掌握烷烃的同系列、同分异构和构造异构。 2.掌握烷烃的命名法、常见基团的名称。 3.掌握烷烃的结构,包括碳正四面体的概念、s即3杂化和σ键。 1.掌握烷烃的构象及构象的表示方法。 5.掌握烷烃的物理性质。 6。学握烷烃的化学性质(稳定性、裂解、氧化及取代反应、各种氢的相对活泼性)。 7.掌握烷烃光卤代反应历程。 8.掌握甲烷氯代反应过程中的能量变化,包括过菠态理论、反应热、活化能。 9.掌握一般烷烃的卤代反应历程。 10.了解烷烃的来源。 二.本章节重点、难点 烷烃的同系列、同分异构和构造异构、烷烃的命名法、烷烃的结构、烷烃的构象及构象 的表示方法、烷烃的物理性质、烷烃的化学性质、烃光卤代反应历程、甲浣氯代反应过程中 的能量变化。 三.教学内容 分子中只有C、H两种元素的有机化合物叫做烃,烃可以分为以下几类: 「烷烃 开链烃(脂肪烃) 烯烃、二烯烃 炔烃 环状烃(脂环烃) 脂环烃 芳香烃 烷烃是分之中的碳除以碳碳单键相连外,碳的其他价键都为氢原子所饱和的烃叫做烷烃。 也叫做饱和烃。 1

2.1烷烃的同系列及同分异构现象 2.1.1烷烃的同系列 最简单的烷烃是甲烷,依次为乙烷、丙烷、丁烷、戊烷等,它们的分子式、构造式 分别为: 分子式 构造式 构造简式 甲烷 H C 乙烷 C.H CH.CHs 丙烷 CH.CH.CH 丁烷 C.He HHHH CHCH.CHCH, 从上述结构式可以看出,链状烷烃的组成都是相差一个或几个C(亚甲基)而连成碳 链,碳链的两端各连一个氢原子。所以烷烃的通式为Cm2+2。 这种结构和化学性质相似,组成上相差一个或多个CH的一系列化合物称为同系列. 同系列中的化合物互称为同系物。 由于同系列中同系物的结构和性质相似,其物理性质也随着分之中碳原子数目的增加而 呈规律性变化,所以掌握了同系列中几个典型的有代表性的成员的化学性质,就可推知同系 列中其他成员的一般化学性质。在应用同系列概念时,除了注意同系物的共性外,还要注意 它们的个性,要根据分子结构上的差异来理解性质上的异同。 2.2.2烷烃的同分异构现象 1.同分异构现象 甲、乙、丙烷只有一种结构,无同分异构现象,从丁烷开始有同分异构现象,同分异构 2

有机化学教案 第二章 体可以通过主链延长法和主链缩短法推导出来,下面通过主链延长法导出丁烷的所有同分异 构体: 正丁烷 HHH 知到中何碳CH间 H HH (沸点-0.5℃) H-C -H 异丁烷 (沸点-10.2) 由两种丁烷两各异构体通过主链延长法导出三种戊烷的同分异构体: CHg-CH-CH-CH-CH厂 到达指CH包CH,CH,CH,CH,C片正戊烷bp36,1C CHs-CH2CH-CH戊烷b.p28℃ CH3 加到链端CH间了 CH-CH-CH-CHCH CH3 加到中间碳CH何 cH一9 -CH3新戊烷b.p9.5C 上述这种分子式相同而构造式不同的化合物称为同分异构体,这种现象称为构造异构现 象。 构造异构现象是有机化学中普追存在的异构现象的一种,这种异构是由于碳链的构造不 同而形成的,故又称为碳链异构,随若碳原子数目的增多,异构体的数目也增多。 2.3.3伯、仲、叔、季碳原子 在烃分之中,按照碳原子与所边碳原子的不同,可分为四类: 仅与一个碳相连的碳原子叫做伯碳原子(或一级碳原子,用1”表示) 与两个碳相连的碳原子叫做仲碳原子(或二级碳原子,用2”表示) 与三个碳相连的碳原子叫做叔碳原子(或三级碳原子,用3”表示) 与四个碳相连的碳原子叫做季碳原子(或四级碳原子,用4°表示) 3 例如 3

与伯、仲、叔碳原子相连的氢原子,分别称为伯、仲、叔氢原子,不同类型的氢原子的 反应性能有一定的差别。 2.2烷烃的命名 烷烃常用的命名法有普通命名法和系统命名法 2.2.1普通命名法 根据分子中碳原子数的多少目称为“某烷”,碳原子数十个以内的依次用甲、乙、丙、丁、 戊…癸表示,十以上的用汉字数字表示碳原子数,用正、异、新表示同分异构体。例如: CHg-CH2-CHz-CHz-CHg Cr-CH-CHCH CI-c CHa 正戊烷 异戊烷 新戊烷 普通命名法简单方便,但只能适用于构造比较简单的烷烃。对于比较复杂的烷烃必须使 用系统命名法。 2.2.2烷是 烷基是烷烃分之中去掉一个氢原子而剩下的原子团称为烷基。 烷基 名称 通常符号 CH- 甲基 CH.CH- 乙基 Et CHCH-CH- 丙基 a-Pr CH.CH- 异丙基 i-Pr CH3CH2CH2CH2- 正丁基 n-Bu CHCHCH=- 异丁基 i-Bu CH. CHCH.CH 仲丁基 s-Bu CH

有机化学教案 第二章 CH3-c 叔丁基 t-Bu CH3 烷基的通式为C2n+l,通常用R表示,此外还有“亚”某基,“次”某基,如亚甲基 为CH,次甲基为CH。 2.2.3系统命名法(IUPAC命名法) 目前有机化合物最常用的命名法是国际纯粹和应用化学联合会(IUP⅓C)制定的有机化合 物的系统命名方法,我国现用系统合名法是根据IPC规定的原则,再结合我国汉字的特点 而制定的。 烷烃系统命名法规则如下 (1)选择主链:选择含碳原子数目最多的碳链作为主,支链作为取代基,分之中有两 条以上等长碳链时,则选择支链多的一条为主链, 例如: CHCHCH-CH+CHCH CH-CH--CH -CH-CH-CH-CH 选拼错误 CHa CH2 CH选择正确 CH3 CHs 选拼正确 记出C拼情深 (2)碳原子的编号: 1)从最接近取代基的一端开始,将主链碳原子用1、2、3编号 123456编号正确 c-C-c- 4C21编号正确 6 C 21编号错误 2)从碳链任何一端开始,第一个支链的位置都相同时,则从较简单的一端开始编号。 例如:1234567编号正确 CH3-CH2-CH-CH2-CH-CH2-CH3 CH3CH2-CH31编号错误

3)若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系 列编号最小(最低系列原则)为原则, 12345678 编号正确 例如:CHCH-CH-CH-CH:-CH-CH-CH CH1编号错误 (3)烷烃的名称 1)将支链(取代基)写在主链名称的前面 2)取代基按“次序规则”,位置优先的基团优先放在最后写出。 烷基的大小次序:甲基<乙基<丙基<丁基<戊基<已基<异戊基<异丁基<异丙基。 3)相同基闭合并写出,位置用2,3…标出,取代基数目用二,三…标出 4)表示位置的数字间要用“,”隔开,位次和取代基名称之间要用“一”隔开。 例如: CH,CH-CHCH--CH-一CHCH at.Gt.C C1 (C) 2,3,7,-三甲基-5-乙基辛烷 2.3烷烃的结构 2.3.1碳原子的四面体构型 构型是指具有一定构造的分子中原子在空间的排列状况,烷烃分之中碳原子为正四面体 构型。甲烷分之中,碳原子位于正四面体构的中心,四个氢原子在四面体的四个顶点上, 四个C-H键长都为0.109画,所有建角∠H-C-H都是109.5°,甲烷的正四面体构型如下图 所示。 H/0.109n
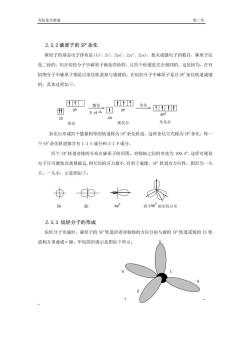
有机化学教案 第二章」 2.3.2碳原子的SP杂化 碳原子的基态电子挂布是(1s、2s2、2px、2py、2pz),按未成键电子的数目,碳原子应 是二价的,但在烷烃分子中碳原子确是四价的,且四个价键是完全相同的,这是因为,在有 机物分子中碳原子都是以杂化轨道参与成键的,在烷烃分子中碳原子是以$P杂化轨道成键 的,具体过程如下: 口微发 田2P 西化四 光吸△2P SPJ 29 25 基态 激发态 杂化态 杂化后形成四个能量相等的轨道称为SP杂化轨道,这种杂化方式称为SP杂化,每 个SP杂化轨道都含有1/4S成分和3/4P成分. 四个SP轨道对称的分布在碳原子的四周,对称轴之间的夹角为109.5°,这样可使价 电子尽可能彼此离得最远,相互间的斥力最小,有利于成键。$P轨道有方向性,图形为一头 大,一头小,示意图如下 2s 四个5即3的空分布 2.3.3烷烃分子的形成 烷经分子形成时,碳原子的SP轨道沿着对称轴的方向分别与碳的SP轨道或氢的1S轨 道相互重叠成。键。甲烷的形成示意图如下所示:

象甲烷分子中C与H之间的化学键是·键,象这种成键电子云沿健轴方向呈圆柱形对称 重叠而形成的键叫做。键,0键有如下几个的特点: (1)电子云沿键轴呈圆柱形对称分布。 (2)可自由旋转而不影响电子云重叠的程度。 (3)结合的较牢固。其中C-H键,键能15.3KJ/aol:C-C键,键能35.6KJ/mol 2.3.4其它烷烃的构型 1)碳原子都是以$P杂化轨道与其他原子形成。键,碳原子都为正四面体结构 2)C-C键长均为0.15nm,C-H键长为0.109mm,键角都接近于109.5”. 3)碳链一般是曲折地排布在空间,在品体时碳链排列整齐,呈锯齿状,在气、液态时 呈多种曲折排列形式(因。键能自由旋转所致),例如正己烷的碳链在空间的分布为: 2、4烷烃的构象 构象:分子通过单键的旋转而引起的分之中各原子在空间的不同挂列方式称为构象 2.41乙烷的构象 理论上讲,乙烷分之中碳碳单键的自由旋转可以产生无数种构象,但极限构象只有两种, 即交叉式和重叠式。构象通常用透视式或纽曼(Newman)投影式表示如下: 透视式 纽曼(Newman).投形式 重叠式

有机化学教案 第二章 交叉式构象为乙烷的优势构象交叉式构象中原子间的斥力小,能量最低。重叠式比交叉 式的能垒(扭转能)高12.5永J/ol,单键旋转的能垒一般为1242K1./mol,在室温时,乙烷 分之中的C-C健能迅速的旋转,因此不能分离出乙烷的某一构象。在低温时,交叉式增加。 (如乙烷在-170℃时,基本上是交叉式),如下所示 能最 交叉式 旋转角度 重叠式 2.4.2正丁烷的构象 以正丁烷的C2C3键的旋转来讨论丁烷的构象,固定C2,把C3旋转一圈来看丁烷的构 象情况。 在转动时,每次转60°,直到360°复原可得到四种典型构象 对位交义式部分重叠式邻位交义式 金重叠式 四种典型构象与能量的关系见如下图所示: 9

能量 旋转角度 对位交叉式 邻位交叉式 全重叠式 部分重叠式 其稳定性次序为: 对位交叉式〉邻位交叉式〉部分重叠式〉全重叠式 相对能垒:0 3.3KJ/mo114.6KJ/mo118.425.5KJ/mo1 室温时,对位交叉式约占70%,邻位交叉式占30%,其他两种极少。 2.5烷烃的物理性质 2.5.1状态 C1C4的烷烃为气态,C5C16的烷烃为液态,C17以上的烷烃为固态。 2.52沸点 1)着碳原子数的递增,沸点依次升高。 2)原子数相同时,支链越多,沸点越低。沸点的高低与分子间引力-一范德华引力(包括 静电引力、诱导力和色散力)有关。烃的碳原子数目越多,分子间的力就越大。支链增多时。 使分子间的距离增大,分子间的力减弱,因而沸点降低。直链烷烃的沸点变化规律如下: 10
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 兰州交通大学:《有机化学》课程授课教案(打印版)第一章 有机化合物的结构和性质.pdf
- 兰州交通大学:《有机化学》课程教学大纲 Organic Chemistry(打印版,负责人:柴兰琴).pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)环境化学授课教案 Environmental Chemistry.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)土壤中重金属的迁移和转化.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)污染物质的生物转化.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第四章 土壤环境化学 第一节 土壤的组成与性质.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第三章 水环境化学.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)第一章 绪论 Environmental Chemistry.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)实验二 土壤对铜离子的吸附.pdf
- 运城学院:《环境化学》课程教学资源(教案讲义)理论教学大纲 Environmental Chemistry.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 07 & 08 alkenes and alkynes.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 02-Sp Brief Introduction and Nomenclature of OCs.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 02 Polar covalent Bonds acids and Bases.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 01 Structure and Bonding(主讲:王俊儒).pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程教学课件(2019)McMurry OCB 3Ed Chapter 00 Introduction to the course.pdf
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2018)McMurry OCB 3Ed Chapter 00 Introduction to the course(主讲:王俊儒).ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2017)McMurry OCB 3Ed Chapter 12 Organohalides Nucleophilic Substitutions and Eliminations.ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2017)McMurry OCB 3Ed Chapter 09 aromatic compounds.ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2017)McMurry OCB 3Ed Chapter 06 an overview of organic Reactions.ppt
- 西北农林科技大学:《有机化学 Organic chemistry》课程PPT教学课件(2017)McMurry OCB 3Ed Chapter 05 Stereochemistry at Tetrahedral Centers.pptx
- 兰州交通大学:《有机化学》课程授课教案(打印版)第三章 烯烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第四章 炔烃、二烯烃、红外光谱.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第五章 脂环烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第六章 单环芳烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第七章 多环芳烃和非苯芳烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第八章 立体化学.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第九章 卤代烃.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十章 醇和醚.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十一章 酚和醌.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十二章 醛和酮、核磁共振谱.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十三章 羧酸及其衍生物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十五章 硝基化合物和胺.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十四章 β- 二羰基化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十七章 杂环化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十八章 碳水化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十六章 重氮化合物和偶氮化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第二十章 元素有机化合物.pdf
- 兰州交通大学:《有机化学》课程授课教案(打印版)第十九章 氨基酸、蛋白质、核酸.pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第二章 烷烃(含参考答案).pdf
- 兰州交通大学:《有机化学》课程习题集(打印版)第三章 烯烃(含参考答案).pdf
