《有机化学》课程教学资源(习题指导)第十一章 羧酸和取代羧酸

第十一章酸和取代演酸125 第十一章 羧酸和取代羧酸 一、内容提要 (一)羧酸的结构和命名 骏酸是分子中含有羧基(一C0O州)的类有机化合物,骏基是由基和羟基组成 羧基碳原子是p杂化,深基的π健马与羟基氧上未共用电子对形成云身辄体系,电子 云密度平均化的结果一方面使得氧氢淀的极性增强,从而有利于H的解离,使羧酸表 现出明显的酸性:另方面使得羧基碳正电住降低,不利于发牛亲核反应,不具有盛附 中猴基的一般性质。 羧酸的系统金名法与相似,把“醛”字改为“酸”字即可。骏酸有俗名,俗名是根据 其来源而得的。 (二)羧酸的反应 1.成盐反应 羧酸可与碱或碳酸盐反应,生成羧酸盐 RCOOH +NaOHRCOONa +ILO 羧酸盐酒强的无机酸又可转化为原来的羧酸,此性质可用于羧酸的分离和纯化,也 可用于外消旋骏酸的拆分。 羧酸的酸性与它的结构有关。羧酸的酸性受烃基上取代基的影响,其影响因素有电 性因素(诱导效应、共轭作用)和立体因素等。能使俊酸根负离子稳定的因素可增强羧酸 段性,反之则使酸性成喝 2.俊基中轻基的重代反应 发基中的羟基在一定条件下可以被卤素、酰氧基、烷氧基或氨基取代,形成酰囟、酸 酐、脂或酰胶等羧酸衍生物。 NHRCONH. 羧酸的霍化反应一般是以酰氧断裂方式成酯,反应机理是经历了亲核加成消除的 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

126有机化学学习指号 过程。羧酸和醇的结构对酯化反应难易有影响,影响因素主要是立体因素 3.还原反应 羧基可被四氢铝锂还原生成醇 RCH,OH (2)H,0 4.氢的反应 羧酸在少量红磷或三卤化磷存在下与卤素(C,或Bm,)反应,得a卤代酸 X X 5.脱羧反应 羧基相对较稳定,a碳原子连有吸电子基团(如一NO,、一CN、一C0-等)的羧酸易 脱羧。芳香酸较脂肪酸易脱羧。 6.二元羧酸的受热反应 两个羧基相对位置不同,受热可发生脱羧、脱水或既脱羧又脱水的反应,分别生成 一元羧酸、环状酸酐或少一个碳原子的环酮。 【三】制备 1.羧酸常用的制备方法 氧化法、腈水解法、格氏试剂法和丙二酸酯法。氧化法主要采用醇、醛、芳烃侧链等的 氧化;睛水解法、格氏试剂法均可以卤代烷为原料制得比原料多一个碳原子的羧酸,睛水 解法仅适用于伯卤代烷,当卤代烷分子中存在其它含活性氢基团时不能采用格氏试剂法 制备羧酸:丙二酸酯法用于制备结构较复杂的羧酸。 2.羰基化合物的缩合反应 以醛为原料制备α,B不饱和羧酸。柏琴反应: ACHO(RCHCO)ArCH-CCOOH+RCH.COOM R 克脑文格尔反应: S01GL(ac,思,ai-owc。 (R) (四)取代羧酸 羧酸分子中烃基上的氢原子被其它原子或基团取代的化合物称为取代羧酸。 1.卤代酸 卤代酸用稀碱溶液处理,产物主要取决于卤原子与羧基的相对位置:卤代酸水解 PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
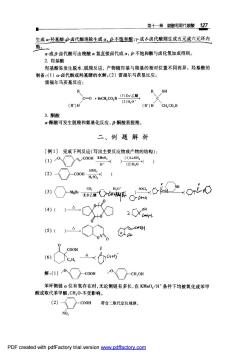
第十一章骏酸和取代羧酸127 生成α羟基酸:B卤代酸消除生成α,B不饱和酸:Y或8肉卤代酸则生成五元或六元环内 酯。 a-或B卤代酸可由羧酸α氢直接卤代或a,B不饱和酸与卤化氢加成得到。 2.羟基酸 羟基酸易发生脱水、脱栽反应,产物随羟基与羧基的相对位置不同而异。羟基酸的 制备:(1)c卤代酸或羟基腈的水解:(2)面福尔马茨基反应。 雷福尔马茨基反应: R C-0+BCH,c0,R22 (2)H,0 (R')H (R')H CH,CO,R 3.酮酸 α酮酸可发生脱羧和氨基化反应,B-酮酸易脱羧。 二、例题解析 [例1】完成下列反应(写出主要反应物或产物的结构): ()0Xc00H 0) 0D"O0 0. 8C nH COOH 解:)0○-c0oH0X-cH,0H 苯环侧链a位有氢存在时,无论侧链有多长,在KMO,/H条件下均被氧化成苯甲 酸或取代苯甲酸,CH,0-不受影响。 (2)c00H 符合二取代定位规律。 NO, PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
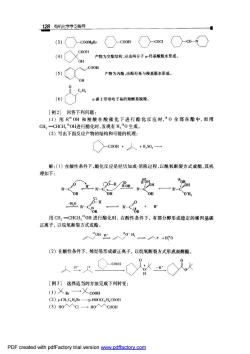
128有机化学学习指导 (3)c○cooH○-a○-0-○ 产物为交酯结构,应由两分子:羟基酸脱水形成 产物为内酯,由酚羟基与羧基脱水形成 9c4 (6) 《碳上带吸电子基的栽酸易脱羧。 [例2]回答下列问题: (I)用RO州和羧酸在酸催化下进行酯化反应时,0全部在酯中,而用 CH2=CHCH2OH进行酯化时,发现有H:0生成。 (2)写出下面反应产物的结构和可能的机理: c00H+人+0,一 解:(1)在酸性条件下,酯化反应是经历加成-消除过程,以酰氧断裂方式成酯,其机 理如下: OH OH H」 HO-R-CIOR 0 一R-cBa+r 用CH,=CHCHOH进行酯化时,在酸性条件下,有部分醇形成稳定的烯丙基碳 正离子,以烷氧断裂方式成酯。 人0州也人0此一人+用0 (2)在酸性条件下,烯烃易形成碳正离子,以烷氧断裂方式形成叔醇酯。 H [例3]选择适当的方法完成下列转变: ()义Br一→义co0m (2)p-CH,C.H,Br-P-HOOCC.H.COOH (3)H0^V入C1H0入入C00H PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

第十一章羧酸和取代羧酸129 (4)入一入√入c00 (5)入c0oH一入入c00H 解:(I)原料是三级卤烃,遇NaCN会发生消除反应,故只能用Grignard试剂法 义无义w册义coa (2)分子中溴不活泼,难与CN~发生亲核取代反应,只能用Crignard试剂法。 (1)c0: H (3)因反应物中有一OH,不能用Grignard试剂法 HO 入CGNH,0'H0 COOH (4)产物增加了一个碳原子,可用Grignard试剂法或腈水解法制备。 11c0 入 过氧化物 (D)R,COOH CN-HO' (5)产物增加了两个碳原子,可利用与环氧乙烷的反应来制备 c00H- )HHB入Br 2),0 H,0'入入√0HKwm0, [例4]化合物(A)在稀碱存在下与丙酮反应生成分子式为C,H,02的化合物 (B),(B)通过碘仿反应生成分子式为C,HO,的化合物(C),(C)经过催化氢化生成 酸(D),化合物(C)、(D)氧化后均生成化合物(E),其分子式为C,H0,(E)用H处 理生成水杨酸,试写出(A)~(E)的结构。 解:要推出本题所提到的结构式,必须熟悉碘仿反应、催化氢化等基本反应和水杨酸 等俗名。()在稀碱存在下与丙酮发生羟醛缩合反应:(B)能发生碘仿反应的事实说明 (B)分子中具有CH,C0一或CH,CH(OH)一的结构:用HⅢ处理(E),醚键断裂得到水杨 酸。水杨酸的结构为o-HOC,H,C0OH,因此,(E)的结构为o-C,H,0C,H,C00H,根据从 (A)到(E)的反应事实可知: 0 CHO C00H A) c) PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

130有机化学学3指号 01 D) (E)「 三、习 题 分甲嵬-4异丙遵-24-无 1.写出分子式为C,H。0,的骏酸的同分异构体,并用系统命名法命名。片-心骏 2用系统命名法命名下列化合物(标明构型): )智420 月cooN 4扬-暖· OH (4) 入 (5人个oou ()5-2 装9+曦聘个并其9州税莲1 3.写出下列化合物的结构武: 一丙酸 一丙聚 (1)反4-羟基环己烷羧酸(优势构象)(2)(2S,3)2羟基3苯基丁酸 (3)(Z,E,E)9,11,13十八碳三烯酸(4)(R)2苯氧基丁酸 4.用化学方法分离下列各组混合物: (1)辛酸,己醛,1-澳丁烷 (2)苯甲酸,对甲酚,苯甲醚 5.将下列各组化合物按酸性由大到小顺序排列,简述其理由 D?6?A()(A)丁酸(B)顺丁烯二酸(C)丁二酸(D)丁炔二酸(E)反丁烯二酸 )>bE767A COOH COOH COOH (2)(A) (B) (c)〔j C7A CH, N (CH) ,L>D3)氯代米乙酸(国)对氯苯乙酸(G)米乙酸(DB苯丙酸 6.回答下列问题: (1)为什么羧酸的沸点及在水中的溶解度较相对分子质量相近的其它有机物高? (2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分 开,为什么? 7.将下列各组化合物按碱性由大到小顺序排列: (1)(A)CH,CH2o-(B)CH,Coo-(C)ONCH,Coo-(D)HOCHCoo (E)HOCH.CH.COO 酸性C>D,BA 待性A>D,c PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

吸怊H7V7P Czp>B 孩性(之D升 第十一章羧酸和取代羧酸131 C00 C00 w®大 8.写出下列反应的主要产物: COOH OH k人@ OH 0 ci n (2)H· (5)d ()2Y00 OH 0H△ (9) H+ 9.下列化合物在加热条件下发生什么反应?写出主要产物。 (1)2苯基2羟基丙酸(2)邻羟基苯乙酸(3)2-环戊酮羧酸 (4)顺B-(邻羟基苯)丙烯酸(5)丁二酸(6)庚二酸 10.用化学方法区别下列各组化合物: (1)乙醇,乙醛,乙酸 (2)水杨酸,2羟基环己烷羧酸 11.指出下列反应式中存在的问题: OH① 0 0 (2) (3)o晋m+o入m答a入a (4)R人HR人a@R人N, O一R人NH/ 12.按由快到慢的次序排列下列醇或酸在酸催化下酯化时的速度: (1)丙醇和(A)苯甲酸:(B)2,4,6三甲基苯甲酸;(C)2,4-二甲基苯甲酸 PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

132有机化学学习指导 (2)CH,CH,OH (A)(CH,),CHCOOH:(B)CH,CH,COOH;(C)(CH3),CCOOH (3)C.H,COOH(A)CH,OH;(B)CH,CHOHCHCH,;(C)CH,CH,CH,OH 13.乳酸加热得两种非对映异构的交酯,它们的结构如何?是否都可拆分? 14.解释下列实验事实: (1)乙酸中也含有CH,C0一基团,但不发生碘仿反应。 (2)下述反应前后构型保持不变: Br OH NaOH HCOON (们化地复是A代数但不生银生发应, 15.在合成2,5-二甲基1,1环戊烷二羧酸(1)时,可得到两个熔点不同的无旋光 性的物质(A)和(B)。加热时,(A)生成两个2,5二甲基环成烷羧酸(I):而(B)只产生 一个,试写出(A)和(B)的结构。 HOOC COOH HCOOH (1) (Ⅱ) 6.给出下列反应中(A)-(F)的结构式。 CHECMGBr. =CH+CH,MgBr一+GH:()+60,一(BL0(C: Hs C COPH 17.完成下列转化(试剂任选): (2)人0H一人c00H (4)一c0H OH 0 COOH (8)人一人oon 18.环丙烷二羧酸有AB,C、D四个异构体。A和B具有旋光性,对热稳定;C和D 均无旋光性,C加热时脱羧而得E,D加热失水而得F。写出A~F的结构。 19.化合物A能溶于水,但不溶于乙醚,元素分析含C,H,0,N。A加热失去一分子水得 化合物B。B与氢氧化钠的水溶液共热,放出一种有气味的气体。残余物酸化后得一不含氨 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

第十一章发酸和取代羧酸133 的酸性物质C。C与氢化铝锂反应的产物用浓硫酸处理,得一气体烯烃D,其分子量为56。 该烯径经臭氧化再还原水解后,分解得一个醛和一个酮。试推出A~D的结构。D(H,=(~% 20.给出与下列各组核磁共振氢谱数据相符的结构 . (1)C,HC0, 81.73(双重饶)3H.84.47(四重峰)1H.811.22(单重峰)1H C M-c- (2)C,H,Br0 0H% 81.08(三重峰)3H,82.07(五重峰)2H,84.23(三重峰)1H,610.97(单峰)1H (3)C,H0 81.27(三重峰)3H,83.36(四重峰)2H,84.13(单峰)2H,810.95(单)1H 21.某化合物分子式为C,H,02,IR谱中1725cm有强吸收,'HNMR谱数据如下:δ 3.53(s,2H),7.21(b,5H)、11.95(8,1H),写出此化合物的结构。 四、参考答案 (一}练习题参考答案 11,1化合物的熔点、沸点的高低与分子间作用力的大小有关。比较苯甲酸、苯甲 醛、苯甲醇形成分子间氢键的能力和强弱。 11.2根据“相似相溶”的规律,比较顺丁烯二酸、反丁烯二酸两分子的极性大小。 1山.3邻氯苯丙炔酸分子中存在场效应 1山.42,6-二羟基苯甲酸电离后生成的酸根负离子可形成两个分子内氢键,比邻羟 基苯甲酸的酸根负离子更稳定。 11.5由醇氧化制醛,副产物是羧酸,可用稀碱水溶液将其除去;由烷基苯氧化制芳 酸,可用碱水溶液使羧酸成盐而与未反应的烷基苯分离,然后再用无机酸使羧酸析出。 11.6(3)>(2)>(4)>(1) 11.7(1)顺式异构体能形成环状酸酐;反式异构体的两个羧基相距较远,不能形成 环状酸酐。 (2)顺式异构体的两个羧基都处于α键时能形成环状酸酐 (3)顺或反式异构体均能形成环状酸酐。 00 11.8 11,9(1)弱酸不能使羧基中的羰基氧质子化,所以弱酸不能催化酯化反应。 (2)高浓度无机酸也可使醇质子化,使醇失去亲核能力而不易发生酯化反应 11.10 COOH COOH COOH COOH (1)H-Br Br-H C:H CH, C.H PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
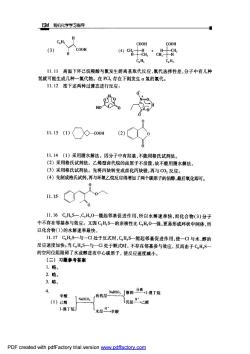
134有机化学学习指导 CH, COOH COOH (3) C.H C.H, 1L.1山高温下环己烷羧酸与氯发生游离基取代反应,氯代选择性差,分子中有几种 氢就可能生成几种一氯代物。在PCl,存在下则发生a氢的氯代。 11,12按下述两种过渡态进行反应: 1.13()0-c0oH ( 11.14(1)采用腈水解法。因分子中有羟基,不能用格氏试剂法。 (2)采用格氏试剂法。乙烯型卤代烷的卤原子不活泼,故不能用猜水解法 (3)采用格氏试剂法。先将丙炔转变成卤化丙炔镁,再与C0反应。 (4)先制成格氏试剂,再与环氧乙烷反应得增加了两个碳原子的伯醇,最后氧化即可! 11.16C,H,S一、CH,0一能起邻基促进作用,所以水解速率快,而化合物(3)分子 中不存在邻基参与效应。又因C,H,S一的亲核性比C,H0一强,更易形成环状中间体,所 以化合物(1)的水解速率最快。 1山.17C,H,S-与一C处于反式时,C,H,S一能起邻基促进作用,使-C1与水,醇的 反应速度加快:当C,H,S一与一C1处于顺式时,不存在邻基参与效应,反而由于C,H,} 的空间位阻阻碍了水或醇进攻中心碳原子,使反应速度诚小。 (二)习题参考答案 1,略。 2路 3.略。 4. 辛酸 (1)己醛 NaHCO, 1溴丁烧」 水层辛酸 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《有机化学》课程教学资源(习题指导)第十章 酚醌.pdf
- 《有机化学》课程教学资源(习题指导)第十二章 羧酸衍生物.pdf
- 《有机化学》课程教学资源(习题指导)第十三章 有机含氮化合物.pdf
- 《有机化学》课程教学资源(习题指导)第十四章 杂环化合物.pdf
- 《有机化学》课程教学资源(习题指导)第十五章 周环反应.pdf
- 《有机化学》课程教学资源(习题指导)第十七章 糖类.pdf
- 《有机化学》课程教学资源(习题指导)第十九章 类脂.pdf
- 《有机化学》课程教学资源(习题指导)第十八章 核酸和辅酶化学.pdf
- 《有机化学》课程教学资源(习题指导)第十六章 氨基酸.pdf
- 重庆医科大学:《有机化学》课程教学实验指导书(共二十五个实验).doc
- 重庆医科大学:《有机化学》课程教学大纲 Organic Chemistry(药学专业、中药学和中药制药).doc
- 重庆医科大学:《有机化学》课程实验教学大纲(药学专业).doc
- 《化学学科教学论》课程教学资源(PPT课件)第二章 中学化学课程教材及教科书.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第三章 中学化学教学的原理与方法.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第一章 导言(石河子大学:毛雁升).ppt
- 《化学学科教学论》课程教学资源(PPT课件)第五章 化学教学设计与实施 5.1 化学教学设计概述 5.2 化学课时教学设计.ppt
- 《化学学科教学论》课程教学资源(PPT课件)说课——说什么、怎么说.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第四章 中学生的化学学习.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第六章 教学技能的实施.ppt
- 《化学学科教学论》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《有机化学》课程教学资源(习题指导)第九章 羰基化合物.pdf
- 《有机化学》课程教学资源(习题指导)第八章 芳 烃.pdf
- 《有机化学》课程教学资源(习题指导)第四章 卤代烷.pdf
- 《有机化学》课程教学资源(习题指导)第七章 炔烃二烯烃.pdf
- 《有机化学》课程教学资源(习题指导)第五章 醇和醚.pdf
- 《有机化学》课程教学资源(习题指导)第六章 烯烃.pdf
- 《有机化学》课程教学资源(习题指导)第一章 绪论.pdf
- 《有机化学》课程教学资源(习题指导)第三章 立体化学.pdf
- 《有机化学》课程教学资源(习题指导)第二章 烷烃.pdf
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十七章 糖类.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十九章 类脂.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十八章 核酸和辅酶化学.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十六章 氨基酸、多肽.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十五章 周环反应.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十四章 杂环化合物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十二章 羧酸衍生物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十三章 有机含氮化合物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第九章 羰基化合物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十一章 羧酸和取代羧酸.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十章 酚醌.doc
