《有机化学》课程教学资源(习题指导)第十二章 羧酸衍生物

138有学学习指写 第十二章 羧酸行生物 一、内容提要 (一】羧酸衍生物的结构和命名 救酸衔生物是指羧酸分子中载基上的羟基被其它原子或原子团所取代而生成的化合 物,因此,其结构与羧酸的结构相似。羧酸衍生物分子中都含有酰基,与酰基相连的卤 素,氧或氮原子的未共用电子对与紫基形®P行瓶,可用通式、共探式表示如下: 1) (2】 由于与发基相连的凶原子,氧或氮原子的电负性不同,Pπ共轭的程度不一样,使得 酸酸衍生物在反应性能上有一定的差异。 酰卤和酰胺是根据分子中所含酰基来命名:酸酐和睛是根据他们水解所得的酸来命 名:酯则是根据水解所得的羧酸和醇来命名的。 (三)羧酸衍生物的反应 1.亲核取代反应 羧酸衍生物中的機基易受亲核试剂进政,发生加成消除反应。 -2一- Nu +L L 0 当u=0.ROH,NH,RH,L=X,0CR,一OR,-Nl() 分别称为水解、醇解,氨解,水解和醇解需在酸或碱徭化下反应。亲核取代反应的反 应活性受分子中电性因素(诱导效应共轭作用)和立体因素的影响,其反应活性为:酷 卤>酸酐>酯>酸胺。 酰卤.酸酐的醇解、氨解又称为酰化反应,酯的醇解又称为酯交换反应 2.与有机金属化合物反应 骏酸衍生物与格氏试剂作用可得酮,酮继续与格氏试剂反应可制得醇,此法常用于 以隆为原料制各醇。 OH PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

第十二章羧酸衍生物139 酰卤与二烃基铜锂、有机辆化物反应可制得酮。 3.还原反应 羧酸衍生物均可被四氢铝娌还原,酰卤、酸酐、酯还原为醇;酰胺、腈还原为胺。 LiAIH4 0 R人X(COR.D8)EAR0H: a 罗森孟德反应使酰氯还原成醛,分子中的硝基、卤素和酯基不受影响:腈还可用催化 氢化法还原:酯可被Na+C,H,OH还原成醇(饱维特勃朗克还原)。 4.酯缩合反应 两分子具α氢的酯在醇钠作用下发生缩合,生成B酮酸酯,称克莱森酯缩合反应, 反应机理与羟醛缩合类似: 2 RCHCOOR(1C,o 0 (2)H0* RCH,CCHCOOR'+R'OH R 不含α氢的酯可与含α氢的酯发生交叉缩合;己或庚二酸酯可发生分子内的缩 合反应生成环状B酮酸酯,称为狄克曼缩合:酯也可与含α氢的翻发生缩合生成B 二酮。 5.酰胺的特性 (1)酸碱性:酰胺一般呈中性;酰亚胺显酸性,能与氢氧化钠(钾)成盐。 (2)霜夫曼降解:生成胺。 (3)脱水反应:生成睛。 (三)羧酸衍生物的制备 1.羧酸衍生物的相互转化 羧酸羧酸衍生物通过亲核取代反应,它们可以相互转化,可用于羧酸衍生物的制 备。 2.贝克曼重排 H R OH RNHR PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
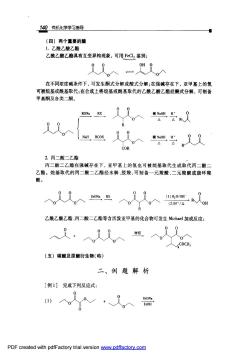
140有机化学学习指导 (四)两个重要的酯 1.乙酰乙酸乙酯 乙酰乙酸乙酯具有互变异构现象,可用FeCl鉴别: 在不同浓度碱条件下,可发生酮式分解或酸式分解;在强碱存在下,亚甲基上的氢 可被烷基或酰基取代:在合成上将烷基或酰基取代的乙酰乙酸乙酯经酮式分解,可制备 甲基酮及各类二翻。 RONa,RX, "g义 COR 2.丙二酸二乙酯 丙二酸二乙酯在强碱存在下,亚甲基上的氢也可被烷基取代生成取代丙二酸 乙酯。烷基取代的丙二酸二乙酯经水解、脱羧,可制备一元羧酸、二元羧酸或脂环费 酸。 乙酰乙酸乙酯、丙二酸二乙酯等含活泼亚甲基的化合物可发生Michael加成反应: (五)碳酸及原酸衍生物(略) 二、例题解析 [例1]完成下列反应式: PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
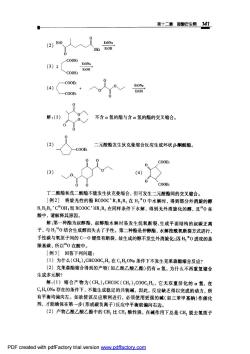
第十二章羧酸衍生物141 (2)B0 人人器 一C00E: (3)2「 COOEL (4) C00E 解:(1)》 0 不含x氢的酯与含α氢的酯的交叉缩合。 2) 二元酸酯发生狄克曼缩合反应生成环状B-酮酸酯。 00 3) 4) 丁二酸酯和成二酸酯不能发生狄克曼缩合,但可发生二元酸酯间的交叉缩合 [例2]将旋光性的酯RC0OCR,R,R,在H,0中水解时,得到部分外消旋的醇 R,R,R,'COH;而RCOOC'HR,R2在同样条件下水解,得到无外消旋化的醇,且0在 酸中,请解释其原因。 解:第一种衝为叔醇酯,叔醇酯水解时易发生烷氧断裂,生成平面结构的叔碳正离 子,与H,0结合生成醇而失去了手性。第二种酯是仲醇酯,水解按酰氧断裂方式进行, 手性碳与氧原子间的C一0键没有断裂,故生成的醇不发生外消旋化;因H,0进攻的是 羰基碳,所以0在酸中。 [例3]回答下列问题: (1)为什么(CH),CHC00C,H,在C,H,0Na条件下不发生克菜森酯缩合反应? (2)克莱森酯缩合得到的产物(如乙酰乙酸乙酯)仍有α氢,为什么不再重复缩合 生成多元酮? 解:(1)缩合产物为(CH),CHCOC(CH),C00C,H,它无双重活化的a氢,在 C,H,Oa存在的条件下,不能生成稳定的共轭碱,因此,反应缺乏得以完成的动力,所 有平衡均偏向左。如欲使该反应顺利进行,必须使用更强的碱(如三苯甲基钠)作催化 剂,才能确保在第一步(形成碳负离子)反应中平衡就偏向右边。 (2)产物乙酰乙酸乙酯中的CH,比CH酸性强,在碱作用下总是CH,脱去氢质子 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

142有机化学学习指导 形成碳负离子,生成的碳负离子因共振而稳定,且位阻较大,故使进一步的酯缩合反应 不可能发生。 [例4]用指定化合物为原料完成下列转化(其它试剂任取): (1)CH,-CH,- H,N入 NH OH (2) (3】 (4)—B (5) (6) 一cH,YoH 解:(1)产物为增加了两个碳原子的二胺,故可将烯烃转变为二卤烃与氰化钠(钾) 反应后得到睛,再还原腈可得产物。 CH-CHe8Nc入CNL入人NH, (2)产物为对称的仲醇,且原料是甲酸酯,直接与格氏试剂反应即可。 人人ee OH (2)H,0· (3)分析产物的结构可知,如在适当位置连上一C00C,H,即变为化合物(A), 可看出在a和b处切断,化合物(A)为两分子丁二酸酯的第合产物。将(A)水解后脱羧 即可得到产物: 0 H (2)H0*/△ PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
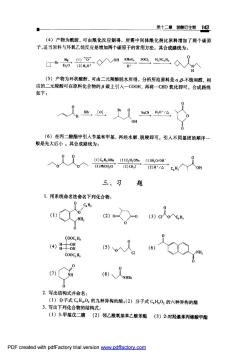
第十二章拨酸生物14S (4)产物为酰胺,可由酰化反应制得。所需中间体酰化剂比原料增加了两个碳原 子,适当原料与环氧乙烷反应是增加两个碳原子的常用方法。其合成路线为: G*080m驰公人> H' (5)产物为环状酸酐,可由二元羧酸脱水所得。分析所给原料是α,B不饱和醛,相 应的二元羧酸可在原料化合物的B碳上引入一COOH,再将一CHO氧化即可。合成路线 如下: (6)在丙二酸酯中引人卡基和甲基,再经水解、脱羧即可。引人不同基团的顺序 般是先大后小。其合成路线为: 27ac,H入Y人oH 三、习题 1.用系统命名法命名下列化合物 COOC.H. (4)8阳 COOCH 2.写出结构式并命名: (1)分子式C,H。02的九种异构的酯:(2)分子式C,H,0的六种异构的酯 3.写出下列化合物的结构式: (1)3-甲基戊二腈(2)邻乙酰氧基苯乙酸苯酯(3)2-对羟基苯丙烯酸甲酯 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
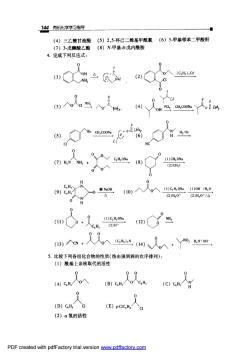
14有机化学学习指号 (4)三乙酸甘袖酯(5)2,5-环己二烯基甲酰氯(6)3甲基邻苯二甲酸酐 (7)3戊酮酸乙酯(8)N甲基-6戊内酰胺 4.完成下列反应式: (7)H,NNH,+ 0八yc4则(8) (1)CH,ONa 0^0 (2)CH1 C.H (9)CH, 入00m (10)入 人0入(1)C,H,0Na(1)0H/H,0 (2)H0·(2)H,0°/△ 0 人人入G人,Yoa 5.比较下列各组化合物的性质(按由强到弱的次序排列): (1)酰基上亲核取代的活性 0 (A)CH人o入 (C)C.H, 0 (D)C.H,cl (E)p-CIC,H.CI (2)a氢的活性 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
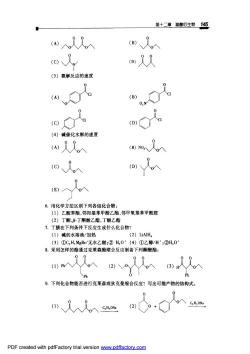
第十二章骏酸行生物145 m又8 (3)氨解反应的速度 0 (B) 0,N 0 ( (4)碱催化水解的速度 (E)入 人 6.用化学方法区别下列各组化合物 (1)乙酸苯酯,邻羟基苯甲酸乙酯,邻甲氧基苯甲酰胺 (2)丁酮,B丁酮酸乙酯,丁酸乙酯 7.丁腈在下列条件下反应生成什么化合物? (1)碱的水溶液/加热 (2)LiAlH. (3)①C,H,MgBr/无水乙醚:②H,0·(4)①乙醇/H‘;②H,0 8。采用怎样的酯通过克菜森酯缩合反应制备下列酮酸酯: (1)P入V (2)0 、(3)人人 Ph Ph 9.下列化合物能否进行克莱森或狄克曼缩合反应?写出可能产物的结构式。 )又人人入心 (2)0+0 PDF created with pdfFactory trial version www.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

146有机化学学习指号 (3)入人o入c4o 10.解释下列实验事实: (1)当N环己基氨基甲酸乙酯与1ml氢氧化钾在甲醇中回馏100小时,得到N环 己基氨基甲酸甲酯,产率为95%,而不产生环己肢。 (2)乙酰氯与1mol的二乙胺作用,只能生成50%产率的N,N-二乙基乙酰胺,如果 用2ml的二乙胺,则产率可接近100% (3)在无碱催化下,(CH,),CHCO0C,H,与H,NOH可颗利地发生亲核取代反应, 而CH2(COOC,H,)2与H,NCONH2的反应则要在强碱C,H,ONa催化下才可进行。 11.解释下述反应机理: 0 0 12.用乙酰乙酸乙酯或丙二酸二乙酯制备下列化合物: COOH )人入 a0 (3) OH (5)人 ph/ 13.用指定化合物为原料完成下列转化(其它试剂任取): o0-w-0 NH, c-c PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com

第十二章羧酸衍生物147 H (8) CH人人。 14.化合物A的分子式为C,H,O,它能与乙醇作用得到两个异构体B和C,B和C 分别与氯化亚砜作用后再与乙醇反应,则两者生成同一化合物D。试推测A,B、C,D的 结构。 15.分子式为C,H,02的异构体A和B都其有水果香味,均不溶于氢氧化钠溶液。 当与氢氧化钠溶液共热后,A生成一种羧酸盐和乙醛:B则除生成甲醇外,其反应液酸 化、蒸馏,所得馏出液显酸性,并能使溴水溷色。推测A和B的结构。 16.化合物A、B的分子式均为C,H,O,其R和'HNMR的数据如下,试推测它们 可能的结构式。 A:R在2900-3000cm、1740cm'(很强)、1240cm'(强)有吸收峰。'H-NMR在 61.25(三重峰,3H)、,62.03(单峰,3H)、64.12(四重峰,2H)有吸收峰。 B:R在2850~3000cm'、1725cm(很强)、1160-1220cm-(强)有吸收峰。1H- NMR在61.29(双重峰,6H),85.13(七重峰,1H)、88.0(单峰,1H)有吸收峰。 17.有一酸性化合物A(C6HO,),经加热得到化合物B(C,H,0,)。B的R在 1820cm1、1755cm有特征吸收,B的H-NMR数据为81.0(双峰,3H),62.1(多重峰, 1H)、62.8(双峰,4H)。写出A、B的结构式。 18.化合物A(C,H,N)的IR在2273cm有吸收蜂,H-NMR数据为6.33(双重峰, 6H)2.82(七重峰,1H),写出A的结构式。 四、参考答案 (一)练习题参考答案 12.】首先蒸除甲醇,放冷,分出有机层(苯甲酸、苯甲酸甲酯),弃水层;有机层再用 碳酸钠水溶液处理,分离,弃水层;有机层水洗、干燥、蒸馏即可。 12.2 乙酰胺能生成分子间氢键,而N,N.二甲基甲酰胺分子间不能生成氢键。 12.3由于3,7二甲基2辛醇乙酸酯中烷氧部分位阻较大,在酸性条件下水解时 部分酯以烷氧断裂方式进行,使生成的醇部分消旋化,所以,光学纯度降低。 12.4与酯的水解机理相似。 12.5酯的碱性水解是亲核加成消除过程,加成是决定反应速率的一步,酯分子中 的电性效应直接影响加成的速率。在p-RC6H,COO中,如一R为吸电子基团,可使带 负电荷的四面体加成中间体稳定而反应速率加快,反之,则使反应速率诚慢。 12.6若醛、酮发生亲核取代反应,离去基团则是氢负离子或烷基负离子,它们都 是最强的碱,难以离去。所以,醛、酮总是发生亲核加成反应。 12.7(1)叔醇酯的酸性醇解按烷氧断裂方式进行。 (2)酯基在强的浓酸作用下生成酰基碳正离子,再与邻位的芳环发生亲电取代反 应。 PDF created with pdfFactory trial version ww.pdffactory.com
PDF created with pdfFactory trial version www.pdffactory.com
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《有机化学》课程教学资源(习题指导)第十三章 有机含氮化合物.pdf
- 《有机化学》课程教学资源(习题指导)第十四章 杂环化合物.pdf
- 《有机化学》课程教学资源(习题指导)第十五章 周环反应.pdf
- 《有机化学》课程教学资源(习题指导)第十七章 糖类.pdf
- 《有机化学》课程教学资源(习题指导)第十九章 类脂.pdf
- 《有机化学》课程教学资源(习题指导)第十八章 核酸和辅酶化学.pdf
- 《有机化学》课程教学资源(习题指导)第十六章 氨基酸.pdf
- 重庆医科大学:《有机化学》课程教学实验指导书(共二十五个实验).doc
- 重庆医科大学:《有机化学》课程教学大纲 Organic Chemistry(药学专业、中药学和中药制药).doc
- 重庆医科大学:《有机化学》课程实验教学大纲(药学专业).doc
- 《化学学科教学论》课程教学资源(PPT课件)第二章 中学化学课程教材及教科书.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第三章 中学化学教学的原理与方法.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第一章 导言(石河子大学:毛雁升).ppt
- 《化学学科教学论》课程教学资源(PPT课件)第五章 化学教学设计与实施 5.1 化学教学设计概述 5.2 化学课时教学设计.ppt
- 《化学学科教学论》课程教学资源(PPT课件)说课——说什么、怎么说.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第四章 中学生的化学学习.ppt
- 《化学学科教学论》课程教学资源(PPT课件)第六章 教学技能的实施.ppt
- 《化学学科教学论》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《化学学科教学论》课程教学课件(PPT讲稿)第一章 化学教育理念.ppt
- 《化学学科教学论》课程教学课件(PPT讲稿)第二章 化学课程.ppt
- 《有机化学》课程教学资源(习题指导)第十章 酚醌.pdf
- 《有机化学》课程教学资源(习题指导)第十一章 羧酸和取代羧酸.pdf
- 《有机化学》课程教学资源(习题指导)第九章 羰基化合物.pdf
- 《有机化学》课程教学资源(习题指导)第八章 芳 烃.pdf
- 《有机化学》课程教学资源(习题指导)第四章 卤代烷.pdf
- 《有机化学》课程教学资源(习题指导)第七章 炔烃二烯烃.pdf
- 《有机化学》课程教学资源(习题指导)第五章 醇和醚.pdf
- 《有机化学》课程教学资源(习题指导)第六章 烯烃.pdf
- 《有机化学》课程教学资源(习题指导)第一章 绪论.pdf
- 《有机化学》课程教学资源(习题指导)第三章 立体化学.pdf
- 《有机化学》课程教学资源(习题指导)第二章 烷烃.pdf
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十七章 糖类.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十九章 类脂.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十八章 核酸和辅酶化学.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十六章 氨基酸、多肽.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十五章 周环反应.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十四章 杂环化合物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十二章 羧酸衍生物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第十三章 有机含氮化合物.doc
- 重庆医科大学:《有机化学》课程授课教案(药学专业)第九章 羰基化合物.doc
