《无机及分析化学》课程教学资源(PPT课件)第二章 化学反应的能量和方向

X热力学基础第二章热化学s2.1热力学基础知识82.2化学反应过程中的热效应82.3化学热力学定律82.4化学反应的方向
第二章 热化学 §2.1 热力学基础知识 §2.2化学反应过程中的热效应 §2.3 化学热力学定律 §2.4 化学反应的方向

x热力学基础基本概念化学反应:1化学反应的方向、限度2.能量变化反应速率3.反应机理4.5.反应的控制化学热力学:应用热力学的基本原理研究化学反应,化学变化过程的能量变化问题
基本概念 化学反应: 1. 化学反应的方向、限度 2. 能量变化 3. 反应速率 4. 反应机理 5. 反应的控制 化学热力学: 应用热力学的基本原理研究化学反应,化学变 化过程的能量变化问题

x热力学基础热力学:主要解决化学反应中的三个问题:①化学反应中能量是如何转化:②化学反应的方向性③反应进行的程度。动力学:机理、反应的现实性和方向性例:热传递:高温一→低温;气体扩散:压力大一→压力小;溶液:浓度大一→浓度小
热力学: 主要解决化学反应中的三个问题: ① 化学反应中能量是如何转化; ② 化学反应的方向性; ③ 反应进行的程度。 动力学: 机理、反应的现实性和方向性 例: 热 传 递: 高温 → 低温; 气体扩散: 压力大→ 压力小; 溶 液: 浓度大 → 浓度小

x热力学基础学习要求化学反应的方向、限度、热力学系统和状态函数速率①术语:*系统、环境和过程①术语:*自发过程*状态变化和状态函数*热和功*自由能*内能*活化能Gibbs方程热力学第一定律2*能量守恒定律4G=4H- T4S*化学反应的炝变和反应热反应速率理论3热力学第二定律*炳化学平衡.*Gibbs自由能
• 热力学系统和状态函数 ① 术语: * 系统、环境和过程 * 状态变化和状态函数 * 热和功 * 内能 ② 热力学第一定律 * 能量守恒定律 * 化学反应的焓变和反应热 ③ 热力学第二定律 * 熵 * Gibbs自由能 学习要求 • 化学反应的方向、限度、 速率 ① 术语: * 自发过程 * 自由能 * 活化能 ② Gibbs方程 ΔG =ΔH - T Δ S ③ 反应速率理论 ④ 化学平衡

x热力学基础第一节热力学基础知识系统和环境系统:作为研究对象的一部分物体,包含一定种类和一定数量的物质开系统J系统封闭系统隔离系统(孤立)
一、 系统和环境 系统:作为研究对象的一部分物体, 包含一定种类和一定数量的物质 第一节 热力学基础知识 敞开系统 封闭系统 隔离系统(孤立) 系统

x热力学基础物质开系统与环境有物质能量交换也有能量交换物质封闭系统与环境有物质交换无能能量量交换物质隔离系统与环境无物质、能量交换能量
敞开系统: 与环境有物质 交换也有能量交换 封闭系统: 与环境有 物质交换无能 量交换 隔离系统: 与环境无物 质、能量交换

X热力学基础环境:系统外与其密切相关的部分或除系统以外的与系统密切相关的部分称为环境
环境: 系统外与其密切相关的部分 或除系统以外的与系统密切相关 的部分称为环境

X热力学基础状态和状态函数1、 状态:一定条件下系统性质的总和2、状态函数:与系统相联系的、描述系统性质的物理量。(p,VT)体系处在一定状态。确定体系状态的宏观性质叫体系的状态函数。特点:(1)状态一定,状态函数一定。(2)状态变化,状态函数也随之而变,且状态函数的变化值只与始态、终态有关,而与变化途径无关。(3)各状态函数之间是相互联系的pV=nRT p、V、T确定了,n也就确定了
二、 状态和状态函数 1、状 态:一定条件下系统性质的总和 2、状态函数:与系统相联系的、描述系统性质 的物理量。(p,V,T)体系处在一定状态。确定体系 状态的宏观性质叫体系的状态函数。 特点:(1)状态一定,状态函数一定。 (2) 状态变化,状态函数也随之而变,且状态 函数的变化值只与始态、终态有关,而与变化途径无关。 ⑶ 各状态函数之间是相互联系的。 pV=nRT p、V、T确定了,n也就确定了

x热力学基础三、过程与途径状态变化的经过称为过程(恒温、恒压、恒容、绝热过程)>完成过程的具体步骤称为途径>状态1一→状态2:途径不同,状态函数改变量相同;>状态一定时,状态函数有一个相应的确定值。始终态一定时,状态函数的改变量就只有一个唯一数值。>等压过程:压力恒定不变△P=O;等容过程:△V=O;等温过程:△T=0
状态变化的经过称为过程 (恒温、恒压、恒容、绝 热过程) ➢ 完成过程的具体步骤称为途径 ➢ 状态1 → 状态2 : 途径不同,状态函数改变量相 同; ➢ 状态一定时,状态函数有一个相应的确定值。始 终态一定时,状态函数的改变量就只有一个唯一数 值。 ➢ 等压过程: 压力恒定不变 ΔP = 0;等容过程: ΔV = 0;等温过程: ΔT = 0 三、过程与途径
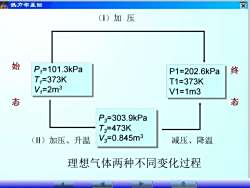
x热力学基础(I)加压始P,=101.3kPa终P1=202.6kPaT,=373KT1=373KV,=2m3V1=1m3中态态P3=303.9kPaT3=473KV3=0.845m3减压、降温(II)加压、升温理想气体两种不同变化过程
P1=101.3kPa T1=373K V1=2m3 P1=202.6kPa T1=373K V1=1m3 P3=303.9kPa T3=473K V3=0.845m3 (II)加压、升温 减压、降温 始 态 终 态 理想气体两种不同变化过程 (I)加 压
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机及分析化学》课程教学资源(PPT课件)第一章 绪论、溶液和胶体(石河子大学:杜志坚).ppt
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2008).doc
- 《无机及分析化学》课程授课教案(2008).pdf
- 《无机及分析化学》课程授课教案(2008).doc
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2009).pdf
- 《无机及分析化学》课程授课教案(2010-2011).doc
- 《无机及分析化学》课程授课教案(2011-2012).doc
- 《无机及分析化学》课程教学大纲(Inorganic and Analytical Chemistry).pdf
- 《动物生物化学》课程教学资源(PPT课件)第一章 绪论 Animal Biochemistry.ppt
- 《动物生物化学》课程教学资源(PPT课件)第四章 核酸的化学结构 Chemical Structure of Nucleic Acid的化学结构 Chemical Structure of Nucleic Acid.ppt
- 《动物生物化学》课程教学资源(PPT课件)第二章 蛋白质的结构和功能 structure and function of protein.ppt
- 《动物生物化学》课程教学资源(PPT课件)第三章 酶 enzyme.ppt
- 《动物生物化学》课程教学资源(PPT课件)第五章 生物氧化 Biological Oxidation.ppt
- 《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢.ppt
- 《动物生物化学》课程教学资源(PPT课件)第八章 氨基酸代谢(含氮小分子物质的代谢 Metabolism of N-including Materials).ppt
- 《动物生物化学》课程教学资源(PPT课件)第七章 脂类代谢 Metabolism of Lipid.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第三章 化学反应速率率和限度.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第四章 物质结构简介.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第六章 分析化学概论.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第七章 酸碱平衡与酸碱滴定.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第八章 沉淀平衡.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第九章 配位化合物与配位滴定 Coordination Compound.ppt
- 《实验化学》课程教学大纲 Experiment chemistry A.doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅰ.doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅱ.doc
- 《实验化学》课程教学课件(教案讲义一).doc
- 《实验化学》课程教学课件(教案讲义二).doc
- 《实验化学》课程教学课件(教案讲义三).doc
- 《实验化学》课程教学课件(教案讲义四).doc
- 《实验化学》课程教学课件(教案讲义五).doc
- 《实验化学》课程教学课件(教案讲义六).doc
- 《实验化学》课程教学课件(PPT讲稿)乙酰乙酸乙酯的制备 Preparation of Ethyl Acetoacetate.ppt
- 《实验化学》课程教学课件(PPT讲稿)氧化还原反应.ppt
- 《实验化学》课程教学课件(PPT讲稿)酸碱标准溶液的配制和比较滴定.ppt
- 《实验化学》课程教学课件(PPT讲稿)水的硬度及钙镁含量的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)玻璃加工和塞子钻孔.ppt
