《无机及分析化学》课程教学资源(PPT课件)第三章 化学反应速率率和限度

5a38化学反应速率和限度ASS2川福AR化学反应速率和限度MChemistry
化学反应速率和限度

区化学反应速率和限度第三章化学反应速率和限度化学反应速率影响化学反应速率的因素化学反应的限度一一一化学平衡
化学反应速率和限度 第三章 化学反应速率和限度 影响化学反应速率的因素 化学反应的限度-化学平衡 化学反应速率

化学反应速率和限度区化学动力学研究化学反应的速率和反应的机理以及温度、压力、催化剂、溶剂和光照等外界因素对反应速率的影响把热力学的反应可能性变为现实性例如:动力学认为:3N.二H,→NH,(g)十需一定的T,p和催化剂221H20.→H,0()点火,?加温或催化剂2
化学反应速率和限度 化学动力学研究化学反应的速率和反 应的机理以及温度、压力、催化剂、溶 剂和光照等外界因素对反应速率的影响, 把热力学的反应可能性变为现实性。 2 2 3 2 2 2 1 3 N H NH (g) 2 2 1 H O H O(l) 2 + → + → 例如: 动力学认为: 需一定的T,p和催化剂 点火,加温或催化剂

区化学反应速率和限度第一节化学反应速率化学反应速率的表示方法一、1平均速率对化学反应,若在等容条件下,单位时间内反应物的减少或生成物的增加AcC单位:mol.L-1.时间+一V=△tt2 -t
化学反应速率和限度 一、化学反应速率的表示方法 第一节 化学反应速率 1 平均速率 对化学反应,若在等容条件下,单位时间内反应 物的减少或生成物的增加 t c t t c c v i = − − = − 2 1 2 1 单位:mol.L-1 .时间

区化学反应速率和限度R = 二([R12 -[Rl)平均速率R[P2]1tz -tiC[Ri][R2][Pi]([P]2 -[Pl)p=t2 -titit2它不能确切反映速率的变化情况,只提供了一个平均值,用处不大
化学反应速率和限度 2 1 2 1 p 2 1 2 1 R ([P] [P] ) ([R] [R] ) t t r t t r − − = − − − = 它不能确切反映速率的变 化情况,只提供了一个平 均值,用处不大
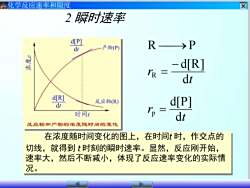
区化学反应速率和限度2瞬时速率d[P]R→>P产物(P)dt茶- d[R]rR =dtd[R]d[P]反应物(R)dtrp=时间dt反应物和产物的浓度随时间的变化在浓度随时间变化的图上,在时间t时,作交点的切线,就得到t时刻的瞬时速率。显然,反应刚开始,速率大,然后不断减小,体现了反应速率变化的实际情况
化学反应速率和限度 2 瞬时速率 在浓度随时间变化的图上,在时间t 时,作交点的 切线,就得到 t 时刻的瞬时速率。显然,反应刚开始, 速率大,然后不断减小,体现了反应速率变化的实际情 况。 t r t r d d[P] d d[R] R P p R = − = ⎯→

区化学反应速率和限度化学反应速率的定义:国家标准规定:对于化学反应:0 = ZgVBB用下式表示以浓度为基础的反应速率:1 dcgU=v dt
化学反应速率和限度 国家标准规定:对于化学反应: 0 =ΣνB B B 用下式表示以浓度为基础的反应速率: d t d c ν 1 B v = 化学反应速率的定义:

区化学反应速率和限度化学反应:aA + bB =gG+ dD化学反应速率为:3)1 dc(G) 1 dc(Ddc(B)AU=ddtbdtdtdtag
化学反应速率和限度 化学反应: aA + bB = gG + dD 化学反应速率为:
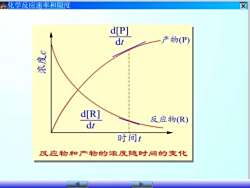
区化学反应速率和限度d[P]产物(P)dtd[R]反应物(R)dt时间#反应物和产物的浓度随时间的变化
化学反应速率和限度

化学反应速率和限度X反应速率:①某一时刻的反应速率、瞬时速率;②平均速率 = V-1(△cp/△t)③用反应中的任何物质表示反应速率,数值上都是一样的:瞬时速率的测定可以由作图法得到
化学反应速率和限度 反应速率: ① 某一时刻的反应速率、瞬时速率; ②平均速率 = B –1 (ΔcB /Δt) ③用反应中的任何物质表示反应速率, 数值上都是一样的; ④ 瞬时速率的测定可以由作图法得到
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《无机及分析化学》课程教学资源(PPT课件)第二章 化学反应的能量和方向.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第一章 绪论、溶液和胶体(石河子大学:杜志坚).ppt
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2008).doc
- 《无机及分析化学》课程授课教案(2008).pdf
- 《无机及分析化学》课程授课教案(2008).doc
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2009-2010).pdf
- 《无机及分析化学》课程授课教案(2009).pdf
- 《无机及分析化学》课程授课教案(2010-2011).doc
- 《无机及分析化学》课程授课教案(2011-2012).doc
- 《无机及分析化学》课程教学大纲(Inorganic and Analytical Chemistry).pdf
- 《动物生物化学》课程教学资源(PPT课件)第一章 绪论 Animal Biochemistry.ppt
- 《动物生物化学》课程教学资源(PPT课件)第四章 核酸的化学结构 Chemical Structure of Nucleic Acid的化学结构 Chemical Structure of Nucleic Acid.ppt
- 《动物生物化学》课程教学资源(PPT课件)第二章 蛋白质的结构和功能 structure and function of protein.ppt
- 《动物生物化学》课程教学资源(PPT课件)第三章 酶 enzyme.ppt
- 《动物生物化学》课程教学资源(PPT课件)第五章 生物氧化 Biological Oxidation.ppt
- 《动物生物化学》课程教学资源(PPT课件)第六章 糖代谢.ppt
- 《动物生物化学》课程教学资源(PPT课件)第八章 氨基酸代谢(含氮小分子物质的代谢 Metabolism of N-including Materials).ppt
- 《无机及分析化学》课程教学资源(PPT课件)第四章 物质结构简介.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第六章 分析化学概论.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第七章 酸碱平衡与酸碱滴定.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第八章 沉淀平衡.ppt
- 《无机及分析化学》课程教学资源(PPT课件)第九章 配位化合物与配位滴定 Coordination Compound.ppt
- 《实验化学》课程教学大纲 Experiment chemistry A.doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅰ.doc
- 《实验化学》课程教学大纲 Experiment chemistry Ⅱ.doc
- 《实验化学》课程教学课件(教案讲义一).doc
- 《实验化学》课程教学课件(教案讲义二).doc
- 《实验化学》课程教学课件(教案讲义三).doc
- 《实验化学》课程教学课件(教案讲义四).doc
- 《实验化学》课程教学课件(教案讲义五).doc
- 《实验化学》课程教学课件(教案讲义六).doc
- 《实验化学》课程教学课件(PPT讲稿)乙酰乙酸乙酯的制备 Preparation of Ethyl Acetoacetate.ppt
- 《实验化学》课程教学课件(PPT讲稿)氧化还原反应.ppt
- 《实验化学》课程教学课件(PPT讲稿)酸碱标准溶液的配制和比较滴定.ppt
- 《实验化学》课程教学课件(PPT讲稿)水的硬度及钙镁含量的测定.ppt
- 《实验化学》课程教学课件(PPT讲稿)玻璃加工和塞子钻孔.ppt
- 《实验化学》课程教学课件(PPT讲稿)配合物的生成和性质.ppt
