中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)04 炔烃和二烯烃

第四章炔烃二烯烃 学习要求 1.掌握炔烃及二烯烃的命名法。 2.掌握炔烃中叁键的结构及SP杂化。 3.掌握炔烃的化学性质:加成反应,炔氢的反应,碳负离子, 酸性,偶合反应。 4.掌握共轭二烯烃的反应:1,4-加成和1,2-加成,离域。 5.掌握烷烃、烯烃和炔烃的鉴别,碳原子sp与sp2、sp3杂化的 比较。 6.理解丁二烯的分子结构。 7.理解速度控制和平衡控制。 8.理解共轭效应及超共轭效应. 10.了解二烯烃的分类。 作业P945,7,10,11,14
第四章 炔烃 二烯烃 • 学习要求 1. 掌握炔烃及二烯烃的命名法。 2. 掌握炔烃中叁键的结构及SP杂化。 3. 掌握炔烃的化学性质:加成反应,炔氢的反应,碳负离子, 酸性,偶合反应。 4. 掌握共轭二烯烃的反应:1,4-加成和1,2-加成,离域。 5. 掌握烷烃、烯烃和炔烃的鉴别,碳原子sp与sp2、sp3杂化的 比较。 6. 理解丁二烯的分子结构。 7. 理解速度控制和平衡控制。 8. 理解共轭效应及超共轭效应。 10.了解二烯烃的分类。 作业 P94 5,7,10,11,14
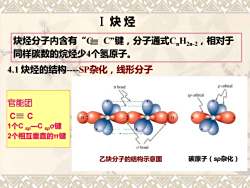
I炔烃 炔烃分子内含有“C三=C”键,分子通式CH2m2,相对于 同样碳数的烷烃少4个氢原子。 4.1炔烃的结构-SP杂化,线形分子 p orbital sp orbital 官能团 C≡C 1个Csp一Cspo键 2个相互垂直的π键 o bond 乙炔分子的结构示意图 碳原子(sp杂化)
Ⅰ 炔 烃 4.1 炔烃的结构-SP杂化,线形分子 炔烃分子内含有“C C”键,分子通式CnH2n-2,相对于 同样碳数的烷烃少4个氢原子。 乙炔分子的结构示意图 碳原子(sp杂化) 官能团 C C 1个C sp—C spσ键 2个相互垂直的π键
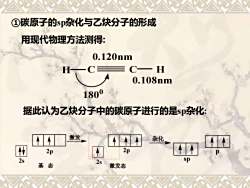
①碳原子的sp杂化与乙炔分子的形成 用现代物理方法测得: 0.120nm H C一 H 0.108nm 1800 据此认为乙炔分子中的碳原子进行的是sp杂化: 激发 杂化 2p 21 2s sp 基 态 激发态
①碳原子的sp杂化与乙炔分子的形成 2s 2p 激发态 2s 2p 激发 基 态 用现代物理方法测得: H C C H 0.120nm 0.108nm 180 0 据此认为乙炔分子中的碳原子进行的是sp杂化: sp p 杂化
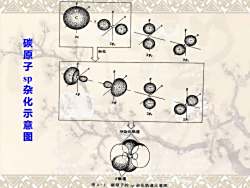
210 碳原子。杂化示意图 22, S伊杂化轨道 图41碳原子的s杂化轨道示意图
碳原子 sp杂化示意图
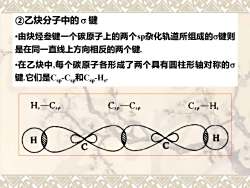
②乙炔分子中的σ键 ·由炔烃叁键一个碳原子上的两个s杂化轨道所组成的σ键则 是在同一直线上方向相反的两个键, ·在乙炔中,每个碳原子各形成了两个具有圆柱形轴对称的σ 键.它们是CSp-CSp和CspH, H,-C. C:-H, H
•由炔烃叁键一个碳原子上的两个sp杂化轨道所组成的键则 是在同一直线上方向相反的两个键. •在乙炔中,每个碳原子各形成了两个具有圆柱形轴对称的 键.它们是Csp-Csp和Csp-Hs . ②乙炔分子中的 键

③乙炔的元键 sp 乙炔的每个碳原子还各有两个相互垂直的 未参加杂化的p轨道,不同碳原子的p轨道又 是相互平行的 一个碳原子的两个轨道和另一个碳原子 p sp 对应的两个p轨道,在侧面交盖形成两个碳 碳π键, 5Dpg键
• 乙炔的每个碳原子还各有两个相互垂直的 未参加杂化的p轨道, 不同碳原子的p轨道又 是相互平行的. • 一个碳原子的两个p轨道和另一个碳原子 对应的两个p轨道,在侧面交盖形成两个碳 碳键. ③乙炔的键
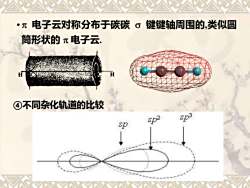
电子云对称分布于碳碳σ键键轴周围的,类似圆 筒形状的π电子云 ④不同杂化轨道的比较 SD3 sp
• 电子云对称分布于碳碳 键键轴周围的,类似圆 筒形状的 电子云. ④不同杂化轨道的比较
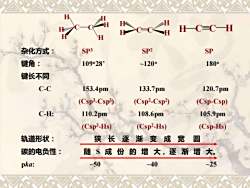
H C C=C—H 杂化方式: SP3 SP2 SP 键角: 10928 ~1200 1800 键长不同 C-C 153.4pm 133.7pm 120.7pm (Csp3-Csp) (Csp2-Csp2) (Csp-Csp) C-H: 110.2pm 108.6pm 105.9pm (Csp3-Hs) (Csp2-Hs) (Csp-Hs) 轨道形状: 狭长逐渐变成宽 圆 碳的电负性: 随S成份的增大,逐渐增大。 pka: ~50 ~40 ~25
杂化方式: SP3 SP2 SP 键角: 109o28’ ~120o 180o 键长不同 C-C 153.4pm 133.7pm 120.7pm (Csp3 -Csp3 ) (Csp2 -Csp2 ) (Csp-Csp) C-H: 110.2pm 108.6pm 105.9pm (Csp3 -Hs) (Csp2 -Hs) (Csp-Hs) 轨道形状: 狭 长 逐 渐 变 成 宽 圆 碳的电负性: 随 S 成 份 的 增 大, 逐 渐 增 大。 pka: ~50 ~40 ~25 C C H H H H H H H H H H C C H C C H
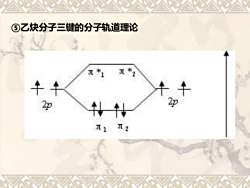
⑤乙炔分子三键的分子轨道理论 *2 2p J2
⑤乙炔分子三键的分子轨道理论

4.2炔烃的异构和命名 4.2.1异构体一从丁炔开始有异构体 同烯烃一样,由于碳链不同和叁键位置不同所引起的由于在 碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比 同碳原子数的烯烃要少, 由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反 异构现象. 戊炔的构造异构体: CH:CH,CH,C=CH CH CHC =CH 1-戊炔 CH, CH3CH,C≡CCH3 3-甲基-1-丁炔 2-戊炔
4.2 炔烃的异构和命名 • 同烯烃一样,由于碳链不同和叁键位置不同所引起的.由于在 碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比 同碳原子数的烯烃要少. • 由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反 异构现象. • 戊炔的构造异构体: CH3CH2CH2C CH CH3CHC CH 1-戊炔 CH3 CH3CH2C CCH3 2-戊炔 3-甲基-1-丁炔 4.2.1 异构体——从丁炔开始有异构体
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)03 烯烃(alkenes).pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)02 烷烃.ppt
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)12 醛和酮.ppt
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)11 酚醌.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)10 醇、酚、醚.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)01 绪论 Organic Chemistry(主讲:苏荣国).ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第6章 氧化还原反应.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第4章 化学反应的方向、速率和限度.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第3章 化学反应中的能量变化.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第1章 原子结构和元素周期表.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第5章 溶液 5.5 配合物溶液.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第5章 溶液 5.4 难溶电解质溶液(沉淀溶解平衡).ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第5章 溶液 5.3 弱电解质溶液(酸碱解离平衡).ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第5章 溶液 5.2 酸碱理论.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第5章 溶液 5.1 稀溶液的依数性.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第2章 化学键与物质结构 2.5 分子间作用力、氢键和分子晶体.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第2章 化学键与物质结构 2.4 金属键与金属晶体.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第2章 化学键与物质结构 2.3 配位键和配位化合物.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第2章 化学键与物质结构 2.2 共价键与共价晶体.ppt
- 天津工业大学:《生物无机化学》课程教学资源(PPT课件)第2章 化学键与物质结构 2.1 离子键与离子晶体.ppt
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)05 脂环烃.ppt
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)06 单环芳烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)07 多环芳烃及非苯芳烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)08 立体化学.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)09 卤代烃.pdf
- 《药学仪器分析》课程教学课件(讲稿)第16章 气相色谱法.pdf
- 《药学仪器分析》课程教学课件(讲稿)第二章 光分析法导论——以物质的光学性质为基础而建立的分析方法.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)读书笔记.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)化学方法鉴别化合物.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化学反应方程式总结.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化合物中文命名原则(PDF电子书,2017,科学出版社).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)邢其毅《基础有机化学》书籍PDF电子版(共二十六章).pdf
- 重庆医科大学:《分析化学》课程理论教学大纲 Analytic Chemistry.doc
- 重庆医科大学:《分析化学》课程实验教学大纲 Analytic Chemistry Experiments.doc
- 重庆医科大学:《分析化学》课程理论授课教案(讲义).doc
- 《分析化学》课程实验授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程教学实验指导 Analytic Chemistry Experiments.doc
- 《分析化学》课程教学资源(PPT课件)第一章 绪论 Analytical Chemistry.ppt
- 《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论.ppt
- 《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法 acid-base titration.ppt
