《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法 acid-base titration

第四章酸碱滴定法acid-base titration是以质子转移反应为基础的滴定分析法。用于一般的酸碱以及能与酸碱直接或间接发生质子转移的物质的测定
第四章 酸碱滴定法 acid-base titration 是以质子转移反应为基础的滴定分析 法。用于一般的酸碱以及能与酸碱直 接或间接发生质子转移的物质的测定

(基本内容)本章内容包括各种酸碱溶液pH值的计算:酸碱指示剂的变色原理和变色范围及其影响因素,常用酸碱指示剂及混合指示剂:强酸(碱)、一元弱酸(碱)、多元酸(碱)的滴定曲线特征,影响其滴定跃范围的因素及指示剂的选择;一元弱酸(碱)、多元酸(碱)准确滴定可行性的判断;强酸(碱)、一元弱酸(碱)滴定终点误差的计算:酸碱标准溶液的配制与标定:非水溶液中酸碱滴定法基本原理:溶剂的分类,溶剂的性质(离解性、酸碱性、极性、均化效应和区分效应),溶剂的选择:非水溶液中酸的滴定和碱的滴定
【基本内容】 本章内容包括各种酸碱溶液pH值的计算;酸碱指 示剂的变色原理和变色范围及其影响因素,常用酸碱指 示剂及混合指示剂;强酸(碱)、一元弱酸(碱)、多 元酸(碱)的滴定曲线特征,影响其滴定突跃范围的因 素及指示剂的选择;一元弱酸(碱)、多元酸(碱)准 确滴定可行性的判断;强酸(碱)、一元弱酸(碱)滴 定终点误差的计算;酸碱标准溶液的配制与标定;非水 溶液中酸碱滴定法基本原理:溶剂的分类,溶剂的性质 (离解性、酸碱性、极性、均化效应和区分效应),溶 剂的选择;非水溶液中酸的滴定和碱的滴定

【基本要求)掌握酸碱指示剂的变色原理、变色范围、影响因素;各种类型酸碱滴定过程中尤其是化学计量点pH的计算,滴定突跃范围,并据此选择恰当的指示剂;各种类型酸、碱能否被准确滴定,多元酸、碱能否分步滴定的判断条件:酸碱滴定分析结果的有关计算和滴定误差的计算;溶剂的酸碱性对溶质酸碱强度的影响,溶剂的均化效应和区分效应,非水酸碱滴定中溶剂的选择,非水溶液中碱的滴定熟悉影响各类型滴定曲线的因素:几种常用指示剂的变色范围及终点变化情况。非水溶剂的离解性和极性(介电常数)及其对溶质的影响,非水酸碱滴定常用的标准溶液、基准物质和指示剂。了解酸碱标准溶液的配制与标定;非水滴定法的特点,非水溶剂的分类,非水溶液中酸的滴定
【基本要求】 掌握酸碱指示剂的变色原理、变色范围、影响因素;各种 类型酸碱滴定过程中尤其是化学计量点pH的计算,滴定突跃范 围,并据此选择恰当的指示剂;各种类型酸、碱能否被准确滴 定,多元酸、碱能否分步滴定的判断条件;酸碱滴定分析结果 的有关计算和滴定误差的计算;溶剂的酸碱性对溶质酸碱强度 的影响,溶剂的均化效应和区分效应,非水酸碱滴定中溶剂的 选择,非水溶液中碱的滴定。 熟悉影响各类型滴定曲线的因素;几种常用指示剂的变色 范围及终点变化情况。非水溶剂的离解性和极性(介电常数) 及其对溶质的影响,非水酸碱滴定常用的标准溶液、基准物质 和指示剂。 了解酸碱标准溶液的配制与标定;非水滴定法的特点,非 水溶剂的分类,非水溶液中酸的滴定

第一节酸碱溶液中氢离子浓度的计算元酸(碱)、多元酸(碱)、两性物质及缓冲溶液的氢离子浓度的计算第二节酸碱指示剂指示剂的变色原理、3变色范围和影响因素混合指示剂第三节酸碱滴定法的基本原理滴定曲线,准确滴定条件,滴定方式第四节酸碱滴定的滴定终点误差第五节非水滴定中的酸碱滴定法
第一节 酸碱溶液中氢离子浓度的计算 一元酸(碱)、多元酸(碱)、两性物质 及缓冲溶液的氢离子浓度的计算 第二节 酸碱指示剂 指示剂的变色原理、变色范围和影响因素 混合指示剂 第三节 酸碱滴定法的基本原理 滴定曲线,准确滴定条件,滴定方式 第四节 酸碱滴定的滴定终点误差 第五节 非水滴定中的酸碱滴定法
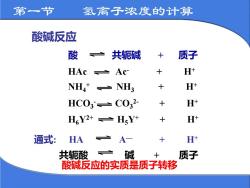
第一节氢离子浓度的计算酸碱反应酸共轭碱质子1++H+HAc 一 AcH++NH+ 一 NH3H+HCO3'— CO32-+H++H,Y2+ H,Y+通式:H++HAA-碱质子共轭酸+酸碱反应的实质是质子转移
酸碱反应 酸 共轭碱 + 质子 HAc Ac- + H+ NH4 + NH3 + H+ HCO3 - CO3 2- + H+ H6Y2+ H5Y+ + H+ 通式: HA A— + H+ 共轭酸 碱 + 质子 酸碱反应的实质是质子转移 第一节 氢离子浓度的计算

1.酸碱平衡与平衡常数一元酸碱的离解反应HA +H,O=HO++AK. = [H +I[A] / [HA]A-+H,O = HA+OHK,=[HA][OH -1 / [A-]Ka K, =Kw
1.酸碱平衡与平衡常数 ✓ 一元酸碱的离解反应 HA + H2O = H3O+ + A - Ka = [H + ][A - ] / [HA] A- +H2O = HA +OH - Kb =[HA][OH - ] / [A - ] Ka · Kb = Kw
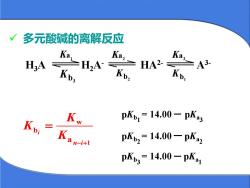
多元酸碱的离解反应KaKazKaHA2-43-HKpKbsKpKb, = 14.00 - pKKKbiKpKbz= 14.00 - pkmza n-i+lpKb,= 14.00 - pKa1
✓ 多元酸碱的离解反应 b1 K b2 K b3 K 2 Ka 3 Ka 1 Ka H3A H2A- HA2- A3- 1 w b a i n i K K K − + = pKb1 = 14.00 – pKa 3 pKb2 = 14.00 – pKa 2 pKb3 = 14.00 – pKa 1
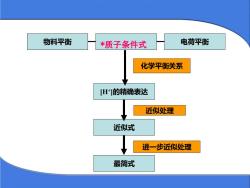
物料平衡电荷平衡*质子条件式化学平衡关系[H+]的精确表达近似处理近似式进一步近似处理最简式
近似式 [H+ ]的精确表达 最简式 化学平衡关系 近似处理 进一步近似处理 物料平衡 *质子条件式 电荷平衡

强酸(碱)溶液H+浓度的计算现以HCl(浓度为Cmol/L)为例讨论:在HCI溶液中存在以下离解作用:[HC]] = [H+] + [C1-][H,O]=H++[OH-]该溶液体系的PBE式为:[H+] = [CI-]+[OH-] = C+Kw/[H+][H+]2 - C[H+] - Kw = 0(精确式)[H+]=[C+(C2+4K)1/2] /2
一、强酸(碱)溶液H+浓度的计算 现以HCl(浓度为Cmol/L)为例讨论: 在HCl溶液中存在以下离解作用: [HCl] = [H+ ] + [ C1- ] [ H2O]= [H+ ] + [ OH- ] 该溶液体系的PBE式为: [H+ ]=[Cl- ]+[OH- ]=C+KW/[H+ ] [H+ ] 2﹣C [H+ ] ﹣KW =0 [H+ ]=[C+(C2+4Kw) 1/2] /2 (精确式)

一般只要HCI溶液的浓度c≥10-molL-1,可近似求解[H+] = [OH-]+[CI-]=[CI-]=C(近似式)pH=-IgC-元强碱溶液pH的计算对于NaOH溶液(浓度为Cmol/L)也按上述方法处理。即:C≥10-°mol·L-1[OH-]~CpOH= -logCpH= pKw-lgCC < 10-°molL-1[OH]=[C+(C2+4Kw)1/2] /2
一般只要HCl溶液的浓度c≥10-6mol·L-1,可近似求解 [H+ ]=[OH- ]+[Cl- ]≈[Cl- ]=C pH=-lgC (近似式) 一元强碱溶液pH的计算 对于NaOH溶液(浓度为Cmol/L)也按上述方法 处理。即: C≥10-6mol·L-1 [OH- ]≈C pOH=-logC pH= pKW -lgC C<10-6mol·L-1 [OH- ]=[C+(C2+4Kw ) 1/2 ] /2
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论.ppt
- 《分析化学》课程教学资源(PPT课件)第一章 绪论 Analytical Chemistry.ppt
- 重庆医科大学:《分析化学》课程教学实验指导 Analytic Chemistry Experiments.doc
- 《分析化学》课程实验授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程理论授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程实验教学大纲 Analytic Chemistry Experiments.doc
- 重庆医科大学:《分析化学》课程理论教学大纲 Analytic Chemistry.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)邢其毅《基础有机化学》书籍PDF电子版(共二十六章).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化合物中文命名原则(PDF电子书,2017,科学出版社).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化学反应方程式总结.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)化学方法鉴别化合物.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)读书笔记.pdf
- 《药学仪器分析》课程教学课件(讲稿)第二章 光分析法导论——以物质的光学性质为基础而建立的分析方法.pdf
- 《药学仪器分析》课程教学课件(讲稿)第16章 气相色谱法.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)09 卤代烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)08 立体化学.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)07 多环芳烃及非苯芳烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)06 单环芳烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)05 脂环烃.ppt
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)04 炔烃和二烯烃.ppt
- 《分析化学》课程教学资源(PPT课件)第七章 沉淀滴定法和重量分析法.ppt
- 《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法.ppt
- 《分析化学》课程教学资源(PPT课件)第九章 电位法和永停滴定法.ppt
- 《分析化学》课程教学资源(PPT课件)第六章 配位滴定法(compleximetry).ppt
- 《分析化学》课程教学资源(PPT课件)第十章 光谱分析法概论(optical analysis).ppt
- 《分析化学》课程教学资源(PPT课件)第九章 光谱分析法概论(optical analysis).ppt
- 《分析化学》课程教学资源(PPT课件)第十二章 荧光分析法 fluorescence analysis.ppt
- 《分析化学》课程教学资源(PPT课件)第十六章 质谱(Mass Spectrum, MS).ppt
- 《分析化学》课程教学资源(PPT课件)第十九章 气相色谱分析法(gas chromatographic analysis ,GC).ppt
- 《分析化学》课程教学资源(PPT课件)第十八章 平面色谱法 plane chromatography.ppt
- 《分析化学》课程教学资源(PPT课件)第二十一章 高效毛细管电泳(High performance capillary electrophoresis,HPCE).ppt
- 《分析化学》课程教学资源(PPT课件)第二十章 高效液相色谱法(high performance liquid chromatograph,HPLC).ppt
- 《分析化学》课程教学资源(习题解答)第4章 酸碱滴定法.doc
- 《分析化学》课程教学资源(习题解答)第5章 配位滴定法.doc
- 《分析化学》课程教学资源(习题解答)第6章 氧化还原滴定法.doc
- 《分析化学》课程教学资源(习题解答)第7章 沉淀滴定法和重量分析法.doc
- 《分析化学》课程教学资源(习题解答)第8章 电位法和永停滴定法.doc
- 《分析化学》课程教学资源(习题解答)第15章 质谱法.doc
- 《分析化学》课程教学资源(习题解答)第17章 气相色谱法.doc
- 《分析化学》课程教学资源(习题解答)第18章 高效液相色谱法.doc
