《分析化学》课程教学资源(PPT课件)第九章 电位法和永停滴定法

第九章日电位法和永停滴定法【基本内容】本章内容包括电化学分析法及其分类;化学电池的组成,相界电位,液接电位;指示电极及其分类,常见的参比电极;pH玻璃电极构造、响应机制、Nernst方程式和性能,测量溶液pH的原理和方法,复合pH电极;离子选择电极基本结构、Nernst方程式、选择性系数,电极分类及常见电极、测量方法及测量误差:电化学生物传感器与微电极技术;电位滴定法的原理和特点,确定终点的方法;永停滴定法的原理、I-V滴定曲线
第九章 电位法和永停滴定法 【基本内容】 本章内容包括电化学分析法及其分类;化学电池的组 成,相界电位,液接电位;指示电极及其分类,常见的 参比电极;pH玻璃电极构造、响应机制、Nernst方程式 和性能,测量溶液pH的原理和方法,复合pH电极;离 子选择电极基本结构、Nernst方程式、选择性系数,电 极分类及常见电极、测量方法及测量误差;电化学生物 传感器与微电极技术;电位滴定法的原理和特点,确定 终点的方法;永停滴定法的原理、I-V滴定曲线

【基本要求】掌握电位法常用指示电极及参比电极的结构、电极反应、电极电位;pH玻璃电极构造、响应机制、Nernst方程式和性能;测定溶液pH的电极、测量原理、方法;电位滴定法的原理及确定终点的方法,永停滴定法的原理及滴定曲线;本章有关计算。熟悉化学电池组成及分类,离子选择电极响应机制测量方法、测量误差,离子选择电极结构、分类、常见电极。了解电化学分析法及其分类,各种类型的电位滴定,电化学生物传感器与微电极技术
【基本要求】 掌握电位法常用指示电极及参比电极的结构、电极 反应、电极电位;pH玻璃电极构造、响应机制、Nernst 方程式和性能;测定溶液pH的电极、测量原理、方法; 电位滴定法的原理及确定终点的方法,永停滴定法的原 理及滴定曲线;本章有关计算。 熟悉化学电池组成及分类,离子选择电极响应机制、 测量方法、测量误差,离子选择电极结构、分类、常见 电极。 了解电化学分析法及其分类,各种类型的电位滴定, 电化学生物传感器与微电极技术

第一节电化学分析概述1、电化学分析法(electrochemicalanalysis):将试样溶液和适当的电极组成电化学电池,用专门的仪器测量电池的电化学参数(电压、电流、电阻和电量等),根据电化学参数强度或变化进行分析的方法
第一节 电化学分析概述 1、电化学分析法(electrochemical analysis): 将试样溶液和适当的电极组成电化学电池,用 专门的仪器测量电池的电化学参数(电压、电 流、电阻和电量等),根据电化学参数强度或 变化进行分析的方法

2、分类:根据所测电化学参数不同电位分析法:将合适的指示电极与参比电极插入被测溶液中组成电化学电池,通过测定电动势或电位的变化进行分析的方法。直接电位法、电位滴定法电解分析法:以电解现象为基础的分析方法■电导分析法:以溶液的电导性质进行分析的方法伏安法:是以测量电解过程中电流-电位曲线(伏安曲线)为基础的分析方法
2、分类:根据所测电化学参数不同 ◼ 电位分析法:将合适的指示电极与参比电极插入 被测溶液中组成电化学电池,通过测定电动势或 电位的变化进行分析的方法。 直接电位法、电位滴定法 ◼ 电解分析法:以电解现象为基础的分析方法 ◼ 电导分析法:以溶液的电导性质进行分析的方法 ◼ 伏安法:是以测量电解过程中电流-电位曲线 (伏安曲线)为基础的分析方法

3.特点:准确度高,重现性和稳定性好灵敏度高,10-4~10-8mol/L10-10~10-12mol/L(极谱,伏安)选择性好(排除干扰)应用广泛(常量、微量和痕量分析)仪器设备简单,易于实现自动化
3.特 点: ◼ 准确度高,重现性和稳定性好 ◼ 灵敏度高,10-4~10-8 mol/L 10-10~10-12 mol/L(极谱,伏安) ◼ 选择性好(排除干扰) ◼ 应用广泛(常量、微量和痕量分析) ◼ 仪器设备简单,易于实现自动化

第二节基本原理一、 化学电池化学电池的组成原电池电解池二、指示电极金属基电极膜电极三、参比电极饱和甘汞电极银-氯化银电极
第二节 基本原理 一、化学电池 化学电池的组成 原电池 电解池 二、指示电极 金属基电极 膜电极 三、参比电极 饱和甘汞电极 银-氯化银电极

一、化学电池化学电池(chemicalcell):两个电极(相同或不同)插入电解质溶液中组成有液接界电池:两电极插入不同电解质溶液中,但能相互连通无液接界电池:两电极插入相同电解质溶液中原电池(galvaniccell):能自发地进行电化学反应,将化学能转变为电能的装置,电位高的为正极,低的为负极电解池(electrolyticcell):由外部电源提供能量以实现电池内部发生化学反应,将电能转变为化学能的装置
一、化学电池 化学电池(chemical cell): 两个电极(相同或不同) 插入电解质溶液中组成 有液接界电池:两电极插入不同电解质溶液中,但能 相互连通 无液接界电池:两电极插入相同电解质溶液中 原电池(galvanic cell):能自发地进行电化学反应,将 化学能转变为电能的装置,电位高的为正极,低的为 负极 电解池(electrolytic cell):由外部电源提供能量以实现 电池内部发生化学反应,将电能转变为化学能的装置
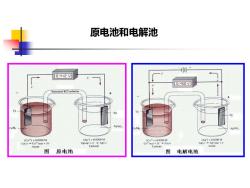
原电池和电解池NENO[Ag1-0.0200MAg1=0.0200M(Cu2"]=0.0200M(Cu*1=0.0200MAg(sAgn-Ag(ag)+eAglaqCu(s)91+2sCathodeCathodeAnodeAnod图原电池图电解电池
原电池和电解池

Daniel电池:铜一锌原电池结构-Zn/Zn2+(1mol/L)Cu2+(1mol/L)/Cu(+)Φcu2 /cu = 0.377VPzn2/zn=-0.763VQ电极反应Zn2+(-)Zn极(氧化反应Zn -2e+)Cu极Cu2+ + 2eCu(还原反应)电池反应Zn + Cu2+(氧化还原反应)Zn?+ + Cu阳极发生氧化反应电位较正的为正极 anode阴极发生还原反应电位较负的为负极cathode上述反应的结果:Zn片溶解,Zn+进入溶液,金属铜沉积在铜片上
Daniel 电池:铜—锌原电池结构 (-) Zn ︱Zn2+(1mol/L) Cu2+(1mol/L)︱Cu (+) 0.763V Cu2+ Cu = 0.377V Zn Zn 2+ = − 电极反应 (-) Zn极 Zn – 2e Zn2+ (氧化反应) (+)Cu极 Cu2+ + 2e Cu (还原反应) 电池反应 Zn + Cu2+ Zn2+ + Cu (氧化还原反应) 阳极发生氧化反应 电位较正的为正极 anode 阴极发生还原反应 电位较负的为负极 cathode 上述反应的结果:Zn片溶解, Zn2+ 进入溶液,金属铜沉积 在铜片上

(-) Zn I ZnSO4(C,mol/L)/CuSO4(Czmol/L) I Cu (+)表示形式:用化学式表示电池中各物质的组成并注明状态,溶液注明浓度(活度),气体注明压力用「表示能产生电位差的两相界面用表示盐桥,表明具有两个接界面发生氧化反应的一极写在左(负极cathode)发生还原反应的一极写在右(正极anode)零电流条件下电池电动势:E = Φcu*/cu -Φzn*/zn = 0.377+ 0.763 =1.100V
表示形式: 用化学式表示电池中各物质的组成并注明状 态,溶液注明浓度(活度),气体注明压力 用︱表示能产生电位差的两相界面 用 表示盐桥,表明具有两个接界面 发生氧化反应的一极写在左(负极cathode) 发生还原反应的一极写在右(正极anode) 零电流条件下电池电动势: (-) Zn ︱ZnSO4 (C1mol/L) CuSO4 (C2mol/L)︱Cu (+) E 0.377 0.763 1.100V Cu Cu Zn Zn = 2+ − 2+ = + =
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法.ppt
- 《分析化学》课程教学资源(PPT课件)第七章 沉淀滴定法和重量分析法.ppt
- 《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法 acid-base titration.ppt
- 《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论.ppt
- 《分析化学》课程教学资源(PPT课件)第一章 绪论 Analytical Chemistry.ppt
- 重庆医科大学:《分析化学》课程教学实验指导 Analytic Chemistry Experiments.doc
- 《分析化学》课程实验授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程理论授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程实验教学大纲 Analytic Chemistry Experiments.doc
- 重庆医科大学:《分析化学》课程理论教学大纲 Analytic Chemistry.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)邢其毅《基础有机化学》书籍PDF电子版(共二十六章).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化合物中文命名原则(PDF电子书,2017,科学出版社).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化学反应方程式总结.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)化学方法鉴别化合物.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)读书笔记.pdf
- 《药学仪器分析》课程教学课件(讲稿)第二章 光分析法导论——以物质的光学性质为基础而建立的分析方法.pdf
- 《药学仪器分析》课程教学课件(讲稿)第16章 气相色谱法.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)09 卤代烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)08 立体化学.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)07 多环芳烃及非苯芳烃.pdf
- 《分析化学》课程教学资源(PPT课件)第六章 配位滴定法(compleximetry).ppt
- 《分析化学》课程教学资源(PPT课件)第十章 光谱分析法概论(optical analysis).ppt
- 《分析化学》课程教学资源(PPT课件)第九章 光谱分析法概论(optical analysis).ppt
- 《分析化学》课程教学资源(PPT课件)第十二章 荧光分析法 fluorescence analysis.ppt
- 《分析化学》课程教学资源(PPT课件)第十六章 质谱(Mass Spectrum, MS).ppt
- 《分析化学》课程教学资源(PPT课件)第十九章 气相色谱分析法(gas chromatographic analysis ,GC).ppt
- 《分析化学》课程教学资源(PPT课件)第十八章 平面色谱法 plane chromatography.ppt
- 《分析化学》课程教学资源(PPT课件)第二十一章 高效毛细管电泳(High performance capillary electrophoresis,HPCE).ppt
- 《分析化学》课程教学资源(PPT课件)第二十章 高效液相色谱法(high performance liquid chromatograph,HPLC).ppt
- 《分析化学》课程教学资源(习题解答)第4章 酸碱滴定法.doc
- 《分析化学》课程教学资源(习题解答)第5章 配位滴定法.doc
- 《分析化学》课程教学资源(习题解答)第6章 氧化还原滴定法.doc
- 《分析化学》课程教学资源(习题解答)第7章 沉淀滴定法和重量分析法.doc
- 《分析化学》课程教学资源(习题解答)第8章 电位法和永停滴定法.doc
- 《分析化学》课程教学资源(习题解答)第15章 质谱法.doc
- 《分析化学》课程教学资源(习题解答)第17章 气相色谱法.doc
- 《分析化学》课程教学资源(习题解答)第18章 高效液相色谱法.doc
- 《分析化学》课程教学资源(习题解答)第19章 平面色谱法.doc
- 《分析化学》课程教学资源(习题解答)第20章 毛细管电泳法.doc
- 《无机化学》课程教学大纲.pdf
