《分析化学》课程教学资源(PPT课件)第七章 沉淀滴定法和重量分析法

第七章沉淀滴定法和重量分析法【基本内容】本章内容包括银量法的基本原理:三种确定滴定终点的方法,每种方法的指示终点的原理、滴定条件和应用范围。重量分析法中的沉淀法,沉淀的形态和沉淀的形成;沉淀的完全程度及其影响因素,溶度积与溶解度,条件溶度积;影响沉淀溶解度的主要因素同离子效应、盐效应、酸效应和配位效应;影响沉淀纯度的因素:共沉淀、后沉淀;沉淀条件的选择:晶形沉淀和无定形沉淀的条件选;沉淀的滤过、洗涤干燥、灼烧和恒重:称量形式和结果计算;挥发法干燥失重
【基本内容】 本章内容包括银量法的基本原理;三种确定滴定 终点的方法,每种方法的指示终点的原理、滴定条件 和应用范围。重量分析法中的沉淀法,沉淀的形态和 沉淀的形成;沉淀的完全程度及其影响因素,溶度积 与溶解度,条件溶度积;影响沉淀溶解度的主要因素: 同离子效应、盐效应、酸效应和配位效应;影响沉淀 纯度的因素:共沉淀、后沉淀;沉淀条件的选择:晶 形沉淀和无定形沉淀的条件选择;沉淀的滤过、洗涤、 干燥、灼烧和恒重;称量形式和结果计算;挥发法, 干燥失重。 第七章 沉淀滴定法和重量分析法

【基本要求】掌握银量法中三种确定滴定终点方法的基本原理、滴定条件和应用范围:沉淀溶解度及其影响因素,沉淀的完全程度及其影响因素,溶度积与溶解度,条件溶度积及其计算;重量分析法结果的计算。熟悉银量法滴定曲线、标准溶液的配制和标定:沉淀重量分析法对沉淀形式和称量形式的要求晶形沉淀和无定形沉淀的沉淀条件了解沉淀的形态和形成过程,沉淀重量分析法的操作过程,挥发法,干燥失重
【基本要求】 掌握银量法中三种确定滴定终点方法的基本 原理、滴定条件和应用范围;沉淀溶解度及其影响 因素,沉淀的完全程度及其影响因素,溶度积与溶 解度,条件溶度积及其计算;重量分析法结果的计 算。 熟悉银量法滴定曲线、标准溶液的配制和标 定;沉淀重量分析法对沉淀形式和称量形式的要求, 晶形沉淀和无定形沉淀的沉淀条件。 了解沉淀的形态和形成过程,沉淀重量分析 法的操作过程,挥发法,干燥失重

第一节沉淀滴定法定义:沉淀滴定法(Precipitationtitration)是以沉淀反应为基础的滴定分析法Ag++CI→AgCllAg++ SCN--→ AgSCNCa2+ +C,02 =CaC,04 ↓ Ksp= 2.0×10-92Ag+CrO=Ag,CrO4↓(砖红色)Ksp=2.0×10-12
第一节 沉淀滴定法 定义: 沉淀滴定法(Precipitation titration)是以 沉淀反应为基础的滴定分析法。 Ag++Cl- → AgCl↓ Ag++SCN-→ AgSCN↓ 9 2 4 2 2 4 2 Ca C O CaC O Ksp 2.0 10 + − − + = = 12 2 4 2 2Ag CrO4 Ag CrO Ksp 2.0 10 + − − + = (砖红色) =

用于沉淀滴定分析的化学反应必须符合的条件:1.沉淀溶解度必须很小,反应能定量完成2.反应速度要快,不易形成过饱和溶液3.有确定终点的简单方法4.沉淀吸附现象不严重,无站污5.沉淀要有固定的组成,便于计算自前应用较广的为生成难溶性银盐的反应利用生成难溶性银盐的滴定法,习惯上称为银量法(aregentometricmethod)。本法可用来测定含CI、Br、I、SCN-及Ag+等离子的化合物
用于沉淀滴定分析的化学反应必须符合的条件: 1.沉淀溶解度必须很小,反应能定量完成 2.反应速度要快,不易形成过饱和溶液 3.有确定终点的简单方法 4.沉淀吸附现象不严重 ,无玷污 5.沉淀要有固定的组成,便于计算 目前应用较广的为生成难溶性银盐的反应 利用生成难溶性银盐的滴定法,习惯上称为银量法 (aregentometric method)。本法可用来测定含 Cl-、Br-、I -、SCN-及Ag+等离子的化合物

银量法基本原理Ag+ +X- →AgXl其中X代表CI、Br、I及SCN-等离子。(一)滴定曲线以AgNO,溶液(0.1000mol/L)滴定20.00mlNaCl溶液(0.1000mol/L)为例:
一、银量法基本原理 Ag++X- → AgX↓ 其中X代表Cl-、Br-、I -及SCN-等离子。 (一)滴定曲线 以 AgNO3溶液(0.1000 mol/L)滴定20.00 ml NaCl溶液(0.1000 mol/L)为例:

1.滴定开始前溶液中氯离子浓度为溶液的原始浓度[Cl-] =0.1000mol/LpCl =-lgl.000×10-1 = 1.002.滴定至化学计量点前加入AgNO,溶液18.00ml时,溶液中TCI-浓度为0.1000 ×2.00° =5.26×10-3 pCl=2.279[CI-20.00 +18.00而Ag+浓度则因为[Ag+][C1-] =Ksp =1.56×10-10pAg + pCl = -lgKsp = 9.74故pAg = 9.74 - 2.28 = 7.46同理,当加入AgNO,溶液19.98ml时,溶液中剩余的CI-浓度为 : [CI-]= 5.0 ×10-5pCI= 4.30pAg = 5.44
1. 滴定开始前 溶液中氯离子浓度为溶液的原始浓度 [Cl-]= 0.1000 mol/L pCl = -lgl.000×10-1 = l.00 2. 滴定至化学计量点前 加入 AgNO3溶液 18.00ml时,溶液中 Cl-浓度为: 而Ag+浓度则因为 [Ag+ ][Cl- ] = Ksp = 1.56×10-10 pAg+pCl = -lgKsp = 9.74 故 pAg = 9.74 - 2.28 = 7.46 同理,当加入AgNO3溶液 19.98ml时,溶液中剩余的Cl-浓度 为:[Cl- ]= 5.0 ×10-5 pCl = 4.30 pAg = 5.44 5.26 10 pCl 2.279 20.00 18.00 0.1000 2.00 [Cl ] 3 = = + = − −

3.化学计量点时溶液是AgC的饱和溶液pAg =pCl=pKsp/2= 4.874.化学计量点后[Ag]浓度由过量的AgNO3浓度决定,当滴入AgNO3溶液20.02ml时(过量AgNO30.02ml时则[Ag+] =5.0×10-5mol / L。pAg = 4.30pCl = 9.74- 4.30 = 5.44
3. 化学计量点时 溶液是AgCl的饱和溶液 pAg = pCl = pKsp/2= 4.87 4. 化学计量点后 [Ag+ ]浓度由过量的AgNO3浓度决 定,当滴入 AgNO3溶液 20.02ml时(过量 AgNO3 0.02ml时 则[Ag+]= 5.0×10-5 mol/L。 pAg = 4.30 pCl = 9.74- 4.30 = 5.44
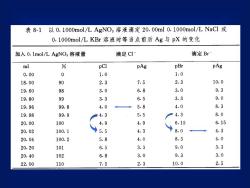
以0.1000mol/LAgNO3溶液滴定20.00ml0.1000mol/LNaCl或表 8-10.1000mol/LKBr溶液时等当点前后Ag与pX的变化滴定 Br滴定CI-加入0.1mol/LAgNO溶液量%pBrpAgmlpClpAg01.01.00.007. 52.310.0902.318.006. 83.09.33.019.60983.39.06.519.80993.34.08.35.899.84.019.968.05. 54.399.914.319.986.156.154. 91004.920.008.04.35.54.3100.120.028.34.05.84. 020.04100.23.39.01016. 53.320.203.09.36.83. 020.401022.57. 52.310.022.00110

LpAg108/ pAg86644pClpBr20.91.110.911.1所需AgNO溶液体积比所需AgNO,溶液体积比图8-1AgNO,溶液(0.1000mol/L)滴定NaCl溶液(0.1000mo1/L)(左)与KBr溶液(0.01mol/L)(右)的滴定曲线
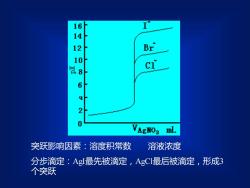
160238d62VAgH03ML溶液浓度突跃影响因素:溶度积常数分步滴定:AgI最先被滴定,AgCl最后被滴定,形成3个突跃
突跃影响因素:溶度积常数 溶液浓度 分步滴定:AgI最先被滴定,AgCl最后被滴定,形成3 个突跃
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学资源(PPT课件)第四章 酸碱滴定法 acid-base titration.ppt
- 《分析化学》课程教学资源(PPT课件)第三章 滴定分析法概论.ppt
- 《分析化学》课程教学资源(PPT课件)第一章 绪论 Analytical Chemistry.ppt
- 重庆医科大学:《分析化学》课程教学实验指导 Analytic Chemistry Experiments.doc
- 《分析化学》课程实验授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程理论授课教案(讲义).doc
- 重庆医科大学:《分析化学》课程实验教学大纲 Analytic Chemistry Experiments.doc
- 重庆医科大学:《分析化学》课程理论教学大纲 Analytic Chemistry.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)邢其毅《基础有机化学》书籍PDF电子版(共二十六章).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化合物中文命名原则(PDF电子书,2017,科学出版社).pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)有机化学反应方程式总结.doc
- 《有机与药物合成化学》课程教学资源(书籍文献)化学方法鉴别化合物.pdf
- 《有机与药物合成化学》课程教学资源(书籍文献)读书笔记.pdf
- 《药学仪器分析》课程教学课件(讲稿)第二章 光分析法导论——以物质的光学性质为基础而建立的分析方法.pdf
- 《药学仪器分析》课程教学课件(讲稿)第16章 气相色谱法.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)09 卤代烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)08 立体化学.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)07 多环芳烃及非苯芳烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)06 单环芳烃.pdf
- 中国海洋大学:《有机与药物合成化学》课程教学课件(讲稿)05 脂环烃.ppt
- 《分析化学》课程教学资源(PPT课件)第六章 氧化还原滴定法.ppt
- 《分析化学》课程教学资源(PPT课件)第九章 电位法和永停滴定法.ppt
- 《分析化学》课程教学资源(PPT课件)第六章 配位滴定法(compleximetry).ppt
- 《分析化学》课程教学资源(PPT课件)第十章 光谱分析法概论(optical analysis).ppt
- 《分析化学》课程教学资源(PPT课件)第九章 光谱分析法概论(optical analysis).ppt
- 《分析化学》课程教学资源(PPT课件)第十二章 荧光分析法 fluorescence analysis.ppt
- 《分析化学》课程教学资源(PPT课件)第十六章 质谱(Mass Spectrum, MS).ppt
- 《分析化学》课程教学资源(PPT课件)第十九章 气相色谱分析法(gas chromatographic analysis ,GC).ppt
- 《分析化学》课程教学资源(PPT课件)第十八章 平面色谱法 plane chromatography.ppt
- 《分析化学》课程教学资源(PPT课件)第二十一章 高效毛细管电泳(High performance capillary electrophoresis,HPCE).ppt
- 《分析化学》课程教学资源(PPT课件)第二十章 高效液相色谱法(high performance liquid chromatograph,HPLC).ppt
- 《分析化学》课程教学资源(习题解答)第4章 酸碱滴定法.doc
- 《分析化学》课程教学资源(习题解答)第5章 配位滴定法.doc
- 《分析化学》课程教学资源(习题解答)第6章 氧化还原滴定法.doc
- 《分析化学》课程教学资源(习题解答)第7章 沉淀滴定法和重量分析法.doc
- 《分析化学》课程教学资源(习题解答)第8章 电位法和永停滴定法.doc
- 《分析化学》课程教学资源(习题解答)第15章 质谱法.doc
- 《分析化学》课程教学资源(习题解答)第17章 气相色谱法.doc
- 《分析化学》课程教学资源(习题解答)第18章 高效液相色谱法.doc
- 《分析化学》课程教学资源(习题解答)第19章 平面色谱法.doc
