《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration)

第五章酸碱滴定法 Cacid-base titration) 本章主要内容: 1、酸碱质子理论; 2、酸碱平衡体系中各型体的分布; 3、酸碱平衡体系pH值的计算; 4、酸碱缓冲溶液; 5、酸碱指示剂; 6、酸碱滴定基本原理; 7、终点误差计算; 8、酸碱滴定法的应用
1 第五章 酸碱滴定法 (acid-base titration) 本章主要内容: 1、酸碱质子理论; 2、酸碱平衡体系中各型体的分布; 3、酸碱平衡体系pH值的计算; 4、酸碱缓冲溶液; 5、酸碱指示剂; 6、酸碱滴定基本原理; 7、终点误差计算; 8、酸碱滴定法的应用

概述 酸碱滴定法是基于酸碱反应的滴定分析方法 其理论基础为酸碱平衡理论 §5.1溶液中的酸碱反应与平衡 一、活度与浓度 活度:在化学反应中表现出来的有效浓度,通常用α 表示 ai=Yi ci 活度系数Y:表达实际溶 溶液无限稀时:y=1 液和理想溶液之间的差 中性分子:y=1 异大小 溶剂活度:a=1
2 概述 酸碱滴定法是基于酸碱反应的滴定分析方法 其理论基础为酸碱平衡理论 §5.1 溶液中的酸碱反应与平衡 一、 活度与浓度 活度:在化学反应中表现出来的 ,通常用a 表示 ai = gi ci 溶液无限稀时: g =1 中性分子: g =1 溶剂活度: a =1 活度系数γi表达实际溶 液和理想溶液之间的差 异大小
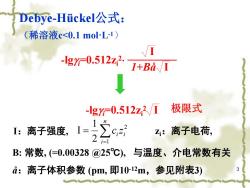
Debye-.Huickel公式: (稀溶液c<0.1moL-1) -lg0.512z2. 1+Ba/I -lg=0.512z2/1 极限式 1:离子强度,1=)c z:离子电荷, 2 B:常数,(=0.00328@25℃),与温度、介电常数有关 a:离子体积参数(pm,即10-12m,参见附表3)
3 Debye-Hückel公式: (稀溶液c<0.1 mol·L-1) -lggi=0.512zi 2 I 1+Bå I -lggi=0.512zi 2 I 极限式 I:离子强度, 2 2 1 1 I i n i i c z zi:离子电荷, B: 常数, (=0.00328 @25℃), 与温度、介电常数有关 å:离子体积参数 (pm, 即10 -12m,参见附表3)

酸碱理论简介 1、十七世纪中叶,Boyle,原始酸碱概念; 2、1889年,瑞典S.A.Arrhenius,电离理论; 3、1905年,美国E.C.Franklin,溶剂理论; 4、1923年,丹麦J.N.Bonstead-英T.M. Lowry,质子理论; 5、1923年,美国G.N.Lewis,电子理论; 6、其他:正负性理论;给体受体理论;软硬酸 碱理论. 由浅到深,由感性到理性,由低级到高级, 发展成为现代酸碱理论
4 二、 酸碱理论简介 1、十七世纪中叶,Boyle原始酸碱概念; 2、1889年,瑞典S. A. Arrhenius,电离理论; 3、1905年,美国E. C. Franklin,溶剂理论; 4、1923年,丹麦J. N. Bonstead-英T. M. Lowry,质子理论; 5、1923年,美国G. N. Lewis,电子理论; 6、其他:正负性理论;给体受体理论;软硬酸 碱理论. . 由浅到深,由感性到理性,由低级到高级, 发展成为现代酸碱理论

主、酸碱质子理论 1、布劳酸碱定义: 酸:凡是能给出质子H+的物质(质子给予体) 。 碱:凡是能接受质子H+的物质(质子接受体) 。 布-劳酸碱可为分子,也可为阴阳离子。 如HLAC;PO43-;NH4+;Al(H20)63+。 2、两性物质: 1) 两性物质是既能放出质子(作酸)又能接受质 子(作碱)的物质。 如:H2PO4、HPO42-、NH4Ac、NH2CH2COOH
5 三、酸碱质子理论 1、布-劳酸碱定义: 酸:凡是能给出质子H+的物质(质子给予体)。 碱:凡是能接受质子H+的物质(质子接受体)。 布-劳酸碱可为分子,也可为阴阳离子。 如 HAc; PO4 3-;NH4 +;Al(H2O)6 3+ 。 2、两性物质: 1)两性物质是既能放出质子(作酸)又能接受质 子(作碱)的物质。 如:H2PO4 -、 HPO4 2-、NH4Ac、NH2CH2COOH

2)两性物质的类型: 电离理论的多元弱酸的酸式酸根离子; 电离理论的弱酸弱碱盐; 两性溶剂; 氨基酸类。 3、共轭酸碱对和酸碱半反应: 1)共轭酸碱对:组成仅相差一个质子的两种酸碱 如:NH4-NH3,HAc-Ac等 2)酸碱半反应:共轭酸碱对相互转化的反应 HAc =Ac-+H+ 酸=碱+H+
6 3、共轭酸碱对和酸碱半反应: 1) 共轭酸碱对: 组成仅相差一个质子的两种酸碱 如: NH4 +-NH3 , HAc-Ac -等 2) 酸碱半反应:共轭酸碱对相互转化的反应 HAc =Ac -+H+ 酸 =碱 + H+ 2) 两性物质的类型: ——电离理论的多元弱酸的酸式酸根离子; ——电离理论的弱酸弱碱盐; ——两性溶剂; ——氨基酸类

同一物质在不同的共轭酸碱对中,可表 现出不同的酸碱性 酸碱是相对的: HPO4≌H++HPO H3POH*+H2PO
7 同一物质在不同的共轭酸碱对中,可表 现出不同的酸碱性 v酸碱是相对的:
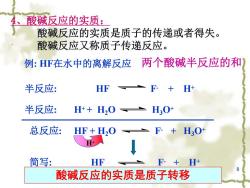
4、酸碱反应的实质: 酸碱反应的实质是质子的传递或者得失。 酸碱反应又称质子传递反应。 例:F在水中的离解反应 两个酸碱半反应的和 半反应: HF 半反应: H++H2O L30 总反应: HF+H,O F+H3O+ + 简写: HF F-+H+ 酸碱反应的实质是质子转移
8 4、酸碱反应的实质: 酸碱反应的实质是质子的传递或者得失。 酸碱反应又称质子传递反应。 酸碱反应的实质是质子转移 H+ 例: HF在水中的离解反应 半反应: HF F- + H+ 半反应: H+ + H2O H3O+ 总反应: HF + H2O F- + H3O+ 简写: HF F- + H+ 两个酸碱半反应的和

四、酸碱反应类型及平衡常数 一元弱酸(碱)的解离反应 HA H2OA+H;O+ K 4HA A+H20 HA OH Kp= CHA QOH A Ka— 酸的解离常数 Kb 碱的解离常数 9
9 四、酸碱反应类型及平衡常数 一元弱酸(碱)的解离反应 HA + H2O A- + H3O+ A- + H2O HA + OH - aH + aA - Ka = aHA aHA aOH - Kb= aA - Ka——酸的解离常数 Kb——碱的解离常数
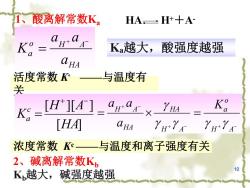
1、 酸离解常数K HA,±H+十A K K越大,酸强度越强 HA 活度常数 与温度有 关 K=HJ[A-“ga1x YHA Ko 「HAI CHA 浓度常数K一与温度和离子强度有关 2、碱离解常数Kb K越大,碱强度越强 10
10 HA o H A a a a a K 1、酸离解常数Ka HA H++A- 活度常数 K◦ ——与温度有 关 浓度常数 Kc——与温度和离子强度有关 [ ] [ ][ ] HA H A K c a H A HA HA H A a a a g g g H A o Ka g g Ka越大,酸强度越强 2、碱离解常数Kb Kb越大,碱强度越强
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)络合滴定2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)滴定分析法概述.ppt
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析2/2.ppt
- 《分析化学》课程教学资源(课件讲稿,英文)Chapter 2 Errors and data treatment in quantitative analysis.pdf
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 4 Acid-base equilibria.ppt
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 6 Oxidation-reduction titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论 Analytical chemistry(化学分析部分).ppt
- 《分析化学》课程各章 思考题(含答案)第七章.doc
- 《分析化学》课程各章 思考题(含答案)第九章.doc
- 《分析化学》课程各章 思考题(含答案)第八章.doc
- 《分析化学》课程各章 思考题(含答案)第十章.doc
- 《分析化学》课程教学资源(各章知识点)第六章 配位滴定法、第七章 氧化还原滴定法、第八章 沉淀滴定法.doc
- 《分析化学》课程教学资源(各章知识点)第一章 概论、第三章 误差及数据处理、第五章 酸碱滴定法.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 三聚氰胺甲醛树脂的合成及层压板的制备.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 本体聚合MMA及其透光率测定.doc
- 《高分子化学实验》课程实验指导(讲义)实验二 丙烯酰胺溶液聚合及其干燥加工.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 醋酸乙烯酯的乳液聚合及固含量测定.doc
- 《生物仪器分析》课程教学课件(讲稿)气相色谱液相色谱导论(气相色谱法、高效液相色谱法).ppt
- 高等教育出版社:《现代仪器分析》教材书籍PDF电子版(扫描版,第三版,主编:刘约权).pdf
- 《生物仪器分析》课程教学课件(讲稿)第一章 绪论(山东理工大学:徐征豹).pdf
