《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium

第五章 多相平衡 Chapter 5 Phase Equilibrium §5.1相律(Phase rule) 一、基本概念 1.相和相数④; 2.物种数S和组分数K; 3.自由度数f 二、相律:=K-Φ+2
一、基本概念 1. 相和相数; 2. 物种数S和组分数K; 3. 自由度数 f 二、相律:f = K – Φ + 2 §5.1 相律(Phase rule) 第五章 多相平衡 Chapter 5 Phase Equilibrium

1.相和相数Φ: 系统中物理及化学性质完全均一的部分称为相。 相与相之间称为界面(interface)。 气相:Φ=1,均相(homogeneous), 液相: Φ=1,2,≤3(根据互溶情况而定), Φ≥2,为复相或多相(heterogeneous)。 固相: Φ=1,固溶体(solid solution), Φ≥2,除了固溶体之外,有几种物质就有几相
1. 相和相数Φ: 系统中物理及化学性质完全均一的部分称为相。 相与相之间称为界面(interface)。 气相: Φ =1,均相(homogeneous), 液相: Φ = 1, 2, 3(根据互溶情况而定), Φ 2,为复相或多相(heterogeneous)。 固相: Φ =1, 固溶体(solid solution), Φ 2,除了固溶体之外,有几种物质就有几相

2.物种数S和组分数K 物种数S:系统中所含化学物质的数量。 说明(1)不同聚集状态的同一种化学物质不 能算两个物种。如水和水蒸气,S=1。 (2)一个系统的物种数是可以随着人们 考虑问题的出发点不同而不同的
物种数S:系统中所含化学物质的数量。 2. 物种数S和组分数K 说明(1)不同聚集状态的同一种化学物质不 能算两个物种。如水和水蒸气, S=1。 (2)一个系统的物种数是可以随着人们 考虑问题的出发点不同而不同的

例:NaC-H2O系统 1.NaCI,H2O:S=2 2.NaC不饱和水溶液:Na+,CI-,H20:S=3 3.NaCI饱和水溶液,有NaCI(s)存在:NaCI(s),Na+,CI-, H20:S=4, 4.NaC饱和水溶液,有NaCI(s)存在:NaCl(s),Na+,CI-, H20,H+,OH-:S=6
例:NaCl-H2O系统 1. NaCl,H2O: S=2 2. NaCl不饱和水溶液:Na+ , Cl-, H2O : S=3 3. NaCl饱和水溶液,有NaCl(s)存在:NaCl(s), Na+ , Cl-, H2O : S=4 , 4. NaCl饱和水溶液,有NaCl(s)存在: NaCl(s), Na+ , Cl-, H2O ,H+ , OH-: S=6

组分数K:能够表示系统组成的独立物质数。 K-S-R-R 说明:(1)R:独立的化学平衡数; 例系统中有Cs),H20g),C02(g),C0(g),H2(g)共存, R=? 答:系统中有反应: C(s)+H2O(g)CO(g)+H2(g) C(s)+C02(g)台C0(g) CO(g)+H2O(g)CO2(g)+H2(g) 其中S=5,独立化学平衡数R≠3=2
组分数K:能够表示系统组成的独立物质数。 K=S – R– R’ 说明:(1)R: 独立的化学平衡数; 例 系统中有C(s), H2O(g), CO2 (g), CO(g), H2 (g)共存, R=? 答:系统中有反应: C(s)+H2O(g) CO(g)+H2 (g) C(s)+CO2 (g) CO(g) CO(g)+H2O(g) CO2 (g)+H2 (g) 其中S=5, 独立化学平衡数 R3=2

说明:(2)R:独立的浓度关系数; 可能是由于化学反应的进行而产生,也可能是指定的, 但只对同相的物质有意义。 例:1.在一抽空的容器中放入PCL5,达分解平衡后 , 生成PCL(g)和C2(g)。问K=? 答:R=1,R'=1,故K=1。 2.在抽空的容器中放入CaC03,让其发生分解 反应。问K=? 答:R=1,R=0,故K=2
说明: (2)R’:独立的浓度关系数; 可能是由于化学反应的进行而产生,也可能是指定的, 但只对同相的物质有意义。 例:1. 在一抽空的容器中放入PCl5,达分解平衡后 ,生成PCl3(g)和Cl2 (g)。问K=? 答:R=1,R’=1,故K=1。 2.在抽空的容器中放入CaCO3,让其发生分解 反应。问K=? 答:R=1,R’=0,故K=2

说明:(3)一个系统的物种数可以随着考虑问题的出 发点不同而不同,但在平衡系统中组分数是确定的。 例3NaC-H2O系统 1.NaCl,H20:S=2,R=0,R'=0,K=2 2.NaC不饱和水溶液 Na+,CI-,H20:S=3, R=0,R'=1:[Na+]=[CI], K=3-1=2 3.NaCI饱和水溶液,有NaCI(s)存在 NaCI(s),Na,CI,H2O:S=4, R=1:NaCI(s)→Nat+CI, R'=1:[Na+]=[CI-], K=4-1-1=2
说明: (3)一个系统的物种数可以随着考虑问题的出 发点不同而不同,但在平衡系统中组分数是确定的。 例3 NaCl-H2O系统 1. NaCl,H2O: S=2, R=0, R’=0, K=2 2. NaCl不饱和水溶液 Na+ , Cl-, H2O : S=3, R=0, R’=1: [Na+ ]=[Cl-], K= 3– 1=2 3. NaCl饱和水溶液,有NaCl(s)存在 NaCl(s), Na+ , Cl-, H2O : S=4, R=1: NaCl(s) Na++ Cl-, R’=1: [Na+ ]=[Cl-], K= 4 – 1– 1=2

4.NaCI(s),Na,CI,H2O,H+,OH: S=6, R=2:NaCl(s→Na++CI-,H2O台Ht+OH-, R'=2:Na]=[CI-],Ht=OH-], 电中性Na+H]=[CI-]+[OH-, K=6-2-2=2 练习:P144,习题1
4. NaCl(s), Na+ , Cl-, H2O ,H+ , OH-: S=6, R=2: NaCl(s) Na++ Cl-, H2O H+ + OH-, R’=2: [Na+ ]=[Cl-], [H+ ]=[OH-], 电中性 [Na+ ]+[H+ ]=[Cl-]+[OH-], K=6– 2–2=2 练习:P144,习题1

3.自由度f(degrees of freedom) 在不引起旧相消失和新相形成的前提下,能够在一 定范围内独立变动的强度性质称作系统的自由度。 即能确立系统状态的独立变量。如T,p,c 例:①一杯水和一桶水: 工,P,尸2,状态相同,不用确定系统的大小; ②NaCl(sln): T,p,C,尺3 ③NaCI(饱和):T,p,仁2(浓度确定c=f(TD) ④H200-H20(g)共存系统: 1。因工,p中只有一个独立变量p=f(①
3. 自由度f (degrees of freedom) 例: ①一杯水和一桶水: 在不引起旧相消失和新相形成的前提下,能够在一 定范围内独立变动的强度性质称作系统的自由度。 即能确立系统状态的独立变量。如T, p, c T, p, f=2,状态相同,不用确定系统的大小; T, p, c, f=3 T, p, f=2(浓度确定c=f (T)) f=1。因T, p中只有一个独立变量 p=f (T) 。 ② NaCl(sln): ③ NaCl(饱和): ④ H2O(l)-H2O(g)共存系统:
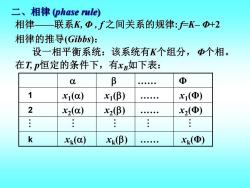
二、相律(phase rule) 相律—联系K,中,f之间关系的规律:户K-+2 相律的推导(Gibbs): 设一相平衡系统:该系统有K个组分,Φ个相。 在T,p恒定的条件下,有xB如下表: 0 B Φ 1 x1(a) x1(β) x1(Φ) 2 X2(a) x2(β) x2(Φ) k xk(a) X(β) X(④)
二、相律 (phase rule) 相律——联系K, Φ , f 之间关系的规律: f=K– Φ+2 . Φ 1 2 k 相律的推导(Gibbs): 设一相平衡系统:该系统有K个组分,Φ个相。 在T, p恒定的条件下,有xB如下表: x1 () x2 () xk () x1 () x2 () xk () . . . x1 (Φ) x2 (Φ) xk (Φ)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 山东理工大学:《物理化学》课程教学大纲(F).doc
- 《物理化学》课程教学课件(PPT讲稿)课程总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学资源(书籍教材)《物理化学简明教程》倒题与习题(高等教育出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)滴定分析法概述.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析2/2.ppt
- 《分析化学》课程教学资源(课件讲稿,英文)Chapter 2 Errors and data treatment in quantitative analysis.pdf
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 4 Acid-base equilibria.ppt
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 6 Oxidation-reduction titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论 Analytical chemistry(化学分析部分).ppt
- 《分析化学》课程各章 思考题(含答案)第七章.doc
