《物理化学》课程教学课件(PPT讲稿)热力学第一定律

热力学概论 基本概念 能量守恒 体积功 热与烤 内能与給 一 熟力学 一鬼牌 热容 绝热过程 节流膨胀 反应热 反应热计算 反应热与温度 习题课
热 容 绝 热 过 程 节 流 膨 胀 反 应 热 反 应 热 计 算 反 应 热 与 温 度 习 题 课 热 力 学 概 论 基 本 概 念 能 量 守 恒 体 积 功 热 与 焓 内 能 与 焓

§1.1 热力学概论 一、 热力学的内容 1、 热力学第一定律 ——变化过程中的能量转换的定 量关系。 2、热力学第二定律 变化过程的方向和限度。 3、热力学第三定律 规定熵,解决化学平衡的计 算问题。 在设计新的反应路线或试制新的化学产品时,变化的方向和限度 问题,显然是十分重要的。只有确知存在反应的可能性的前提下 再去考虑反应的速率问题,否则将徒劳无功:如在上世纪末进行 了从石墨制造金刚石的尝试,所有的实验都以失败告终。以后通 过热力学计算知道,只有当压力超过15000倍时,石墨才有可能 转变成金刚石。现在已经成功地实现了这个转变过程, 2
2 §1.1 热力学概论 1、热力学第一定律 ——变化过程中的能量转换的定 量关系。 2、热力学第二定律 ——变化过程的方向和限度。 3、热力学第三定律——规定熵,解决化学平衡的计 算问题。 一、热力学的内容 在设计新的反应路线或试制新的化学产品时,变化的方向和限度 问题,显然是十分重要的。只有确知存在反应的可能性的前提下, 再去考虑反应的速率问题,否则将徒劳无功:如在上世纪末进行 了从石墨制造金刚石的尝试,所有的实验都以失败告终。以后通 过热力学计算知道,只有当压力超过15000倍时,石墨才有可能 转变成金刚石。现在已经成功地实现了这个转变过程

§1.2 基本概念 一、系统和环境 二、状态和状态函数 三、相 四、过程与途径 五、热力学平衡系统 3
3 §1.2 基本概念 一、系统和环境 二、状态和状态函数 三、相 四、过程与途径 五、热力学平衡系统

一、系统和环境 System and Surroundings 系统:研究对象 环境:系统以外的,与系统有关的部分 系统与环境有实际的或想象的界面分开 系统的分类: System 敬开系统 密闭系统 孤立(隔离)系 open closed 统isolated 物质交换 可以 不可能 不可能 能量交换 可以 可以 不可能
4 System 敞开系统 open 密闭系统 closed 孤立(隔离)系 统isolated 物质交换 可以 不可能 不可能 能量交换 可以 可以 不可能 系统的分类: 一、系统和环境 System and Surroundings 系统:研究对象 环境:系统以外的,与系统有关的部分 系统与环境有实际的或想象的界面分开
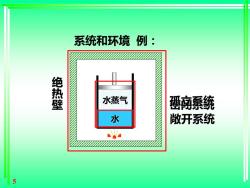
系统和环境例: 绝热壁 水蒸气 高系统 水 敞开系统 a 5
5 系统和环境 例: 绝 热 壁 水 水蒸气 敞开系统 孤立系统 密闭系统

二、状态和状态函数 State and State function 状态:系统的物理,化学性质的综合表现; 状态性质:系统处于某一状态时的性质,是系统 本身所属的宏观物理量。 如:T,p,p,V,m,U,H,S. 状态性质之间互相联系的,不是独立的,在数学 上有函数关系,所以又称状态函数。 如:单相纯物质密闭系统=∫(T,p)或p=f(T,) 6
6 二、状态和状态函数 State and State function 状态:系统的物理,化学性质的综合表现; 状态性质:系统处于某一状态时的性质,是系统 本身所属的宏观物理量。 如:T,p, ,V,m, U,H,S. 状态性质之间互相联系的,不是独立的,在数学 上有函数关系,所以又称状态函数。 如:单相纯物质密闭系统V=f (T, p) 或 p=f (T,V)

1.状态函数的分类 容量性质:extensive properties 其数值与系统中物质的量成正比,且有加和性 如:Vcn/总)=V+V+. 强度性质:intensive properties 其数值与系统中物质的量无关,且不具有加和性 如:T,p,p 注意:两个容量性质相除得强度性质。 如:p=m/W,Vm=Vn
7 1. 状态函数的分类 容量性质:extensive properties 其数值与系统中物质的量成正比,且有加和性 如:Vi ∝ni V(总)=V1+V2+. 强度性质:intensive properties 其数值与系统中物质的量无关,且不具有加和性 如:T,p, 注意:两个容量性质相除得强度性质。 如: =m /V, Vm =V /n

2.状态函数的特点 ① 状态函数的改变量只与始、终态有关,与变化途 径无关;AX=∫x=X,-X △X=手dK=0 ② 状态函数的微小变化可以用全微分表示。 如:p=T,W 积分 ∫-j器)r+小〔) 8
8 2. 状态函数的特点 ① 状态函数的改变量只与始、终态有关,与变化途 径无关; dV V p dT T p dp V T + = 积分 ② 状态函数的微小变化可以用全微分表示。 如: p=f(T,V) = = − 2 1 2 1 X X X dX X X X = dX = 0 V T p p dp dT dV T V = +

三、相 系统中物理性质和化学性质完全均匀的部分 称为相。可分为均相和复相
9 系统中物理性质和化学性质完全均匀的部分 称为相。可分为均相和复相。 三、相

四、过程与途径 系统状态发生的变化为过程,变化的具体步骤称为途径 按照系统中物质变化前后的状态过程可分为三类: 1、简单状态变化过程 2、相变过程:系统物态发生变化,如 气化vpo):液-→气 熔化(fusion):固-→液 升华过程(sublimation):固→气。 3、化学变化过程:化学反应 10
10 系统状态发生的变化为过程,变化的具体步骤称为途径 。按照系统中物质变化前后的状态过程可分为三类: 1、简单状态变化过程 2、相变过程:系统物态发生变化,如 气化(vapor):液→气 熔化(fusion):固→液 升华过程(sublimation):固→气。 3、化学变化过程: 化学反应 四、过程与途径
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 山东理工大学:《物理化学》课程教学大纲(F).doc
- 《物理化学》课程教学课件(PPT讲稿)课程总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学资源(书籍教材)《物理化学简明教程》倒题与习题(高等教育出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体 表面化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学.ppt
- 山东理工大学:《物理化学》课程教学资源(课件讲稿)物理化学各章总结.pdf
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
