《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律

摘变的计算PhyChenistry第三定律卡诺定理第定律馆第二享热力学第二定律热力学关系应用热力学关系热力学原理的计算习题课自由能
自由能 热力学关系 热力学关系应用 ΔG 的计算 习题课 第二定律 卡诺定理 熵 熵变的计算 第三定律 热力学原理PhyChemistry

S2.1自发过程的共同特征在一定条件下,一化学变化或物理变化能不能自动发生?能进行到什么程度?这就是过程的方向、限度问题。历史上曾有人试图用第一定律中的状态函数U、H来判断过程的方向,其中比较著名的是"Thomson-Berthelot规则其结论:凡是放热反应都能自动进行:而吸热反应均不能自动进行。但研究结果发现,不少吸热反应仍能自动进行。高温下的水煤气反应C(s)+H,O(g)→CO(g)+H(g)就是一例。热力学第一定律只能告诉人们一化学反应的能量效应,但不能解决化学变化的方向和限度问题2
2 §2.1 自发过程的共同特征 在一定条件下,一化学变化或物理变化能不能自动 发生? 能进行到什么程度? 这就是过程的方向、限度 问题。 历史上曾有人试图用第一定律中的状态函数U、H来判断过 程的方向,其中比较著名的是“Thomson-Berthelot 规则 ” 。 其结论:凡是放热反应都能自动进行;而吸热反应均不能自动 进行。 但研究结果发现,不少吸热反应仍能自动进行。高温下的水 煤气反应C(s)+H2O(g)→CO(g)+H2 (g)就是一例。 热力学第一定律只能告诉人们一化学反应的能量效 应,但不能解决化学变化的方向和限度问题

人类经验说明:自然界中一切变化都是有方向和限度的,且是自动发生的,称为“自发过程Spontaneousprocess这些变化过程的决定因素是什么?决定因素方向限度如:温度热:高温一→低温温度均匀电势电流:高电势一→低电势电势相同压力气体:高压→低压压力相同热功转化静止钟摆:动能→热那么决定一切自发过程的方向和限度的共同因素是什么?这个共同因素既然能判断一切自发过程的方向和限度,自然也能判断化学反应的方向和限度3
3 人类经验说明:自然界中一切变化都是有方向和限 度的,且是自动发生的,称为“自发过程” Spontaneous process 。 如: 方向 限度 热: 高温→低温 温度均匀 电流:高电势→低电势 电势相同 气体:高压→低压 压力相同 钟摆:动能→热 静止 这些变化过程的决定因素是什么? 决定因素 温度 电势 压力 热功转化 那么决定一切自发过程的方向和限度的共同因素是 什么?这个共同因素既然能判断一切自发过程的方 向和限度,自然也能判断化学反应的方向和限度
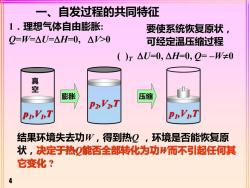
一、自发过程的共同特征1.理想气体自由膨胀要使系统恢复原状AV>O0-W-U-4H-0可经定温压缩过程()T △U=0,△H=0,Q=-W+0真空膨胀压缩P2,V2,TP,V,TPi,V,T结果环境失去功W,得到热Q,环境是否能恢复原状,决定于热Q能否全部转化为功W而不引起任何其它变化?
4 一、自发过程的共同特征 1.理想气体自由膨胀: Q=W=U=H=0, V>0 结果环境失去功W,得到热Q ,环境是否能恢复原 状,决定于热Q能否全部转化为功W而不引起任何其 它变化 ? 要使系统恢复原状, 可经定温压缩过程 真 空 p1 ,V1 ,T p2 ,V2 ,T p1 ,V1 ,T ( )T U=0, H=0, Q= –W0 膨胀 压缩
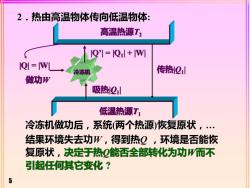
2.热由高温物体传向低温物体高温热源T,1Q'/=Q:l+/WQI =WI传热Ql冷冻机做功W吸热Q低温热源T冷冻机做功后,系统(两个热源)恢复原状,结果环境失去功W,得到热Q,环境是否能恢复原状,决定于热Q能否全部转化为功W而不引起任何其它变化?5
5 2.热由高温物体传向低温物体: 冷冻机做功后,系统(两个热源)恢复原状,. 结果环境失去功W,得到热Q ,环境是否能恢 复原状,决定于热Q能否全部转化为功W而不 引起任何其它变化 ? 低温热源T1 高温热源T2 传热|Q1 | 吸热|Q1 | 做功W |Q’| = |Q1 | + |W| |Q| = |W|
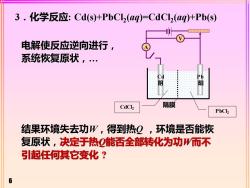
3.化学反应:Cd(s)+PbCl(ag)=CdCl2(aq)+Pb(s)1V电解使反应逆向进行,系统恢复原状,CdT阴阳隔膜CdChPbCl2结果环境失去功W,得到热Q,环境是否能恢复原状,决定于热Q能否全部转化为功W而不引起任何其它变化?1
6 3.化学反应: Cd(s)+PbCl2 (aq)=CdCl2 (aq)+Pb(s) 电解使反应逆向进行, 系统恢复原状,. 结果环境失去功W,得到热Q ,环境是否能恢 复原状,决定于热Q能否全部转化为功W而不 引起任何其它变化 ? Cd 阴 Pb 阳 A V 隔膜 PbCl2 CdCl2

人类经验总结:“功可以自发地全部变为热,但热不可能全部变为功,而不留任何其它变化”一切自发过程都是不可逆过程,而且他们的不可逆性均可归结为热功转换过程的不可逆性因此,他们的方向性都可用热功转化过程的方向性来表达
7 人类经验总结: “功可以自发地全部变为热,但热不可 能全部变为功,而不留任何其它变化”。 一切自发过程都是不可逆过程, 而 且他们的不可逆性均可归结为热功转换 过程的不可逆性, 因此,他们的方向性都可 用热功转化过程的方向性来表达

S2.2热力学第二定律的经典表述19世纪初,资本主义工业生产已经很发达,迫切需要解决动力问题。当时人们已经认识到能量守恒原理,试图制造第一类永动机已宣告失败,然而人们也认识到能量是可以转换的。于是,人们就想到空气和大海都含有大量的能量,应该是取之不尽的。有人计算若从大海中取热做功,使大海温度下降1℃,其能量可供全世界使用100年..。于是人们围绕这一设想,设计种种机器,结果都失败了。这个问题的实质可归结为热只能从高温物体自动传向低温物体,没有温差就取不出热来(即从单一热源吸热)。8
8 §2.2 热力学第二定律的经典表述 19世纪初,资本主义工业生产已经很发达,迫切需要解决动力 问题。当时人们已经认识到能量守恒原理,试图制造第一类永动 机已宣告失败,然而人们也认识到能量是可以转换的。于是,人 们就想到空气和大海都含有大量的能量,应该是取之不尽的。 有人计算若从大海中取热做功,使大海温度下降1℃,其能量 可供全世界使用100年.。于是人们围绕这一设想,设计种种 机器,结果都失败了。这个问题的实质可归结为热只能从高温 物体自动传向低温物体,没有温差就取不出热来(即从单一热源 吸热)

Kelvin&Plank总结这一教训来表述热力学第二定律:“不可能造成这样一种机器,这种机器能够循环不断地工作,它仅仅从单一热源吸热变为功而没有任何其它变化。上述这种机器称为第二类永动机热力学第二定律的经典叙述可简化为:第二类永动机是不可能造成的Clausius的表述为:不可能把热从低温物体传到高温物体而不引起其它变化。9
9 Kelvin & Plank总结这一教训来表述热力学第二定律: “不可能造成这样一种机器,这种机器能够循环 不断地工作,它仅仅从单一热源吸热变为功而没 有任何其它变化。”上述这种机器称为第二类永动机。 热力学第二定律的经典叙述可简化为: “第二类永动机是不可能造成的。” Clausius的表述为: “不可能把热从低温物体传到高温物体而不引 起其它变化

强调说明:1所谓第二类永动机,它是符合能量守恒原理的,即从第一定律的角度看,它是存在的,它的不存在是失败教训的总结2.关于“不能从单一热源吸热变为功,而没有任何其它变化”这句话必须完整理解,否则就不符合事实列如理想气体定温膨胀U-0.0=-W,就是从环境中吸热全部变为功,但体积变大了,压力变小了。3.“第二类永动机不可能造成”可用来判断过程的方向热力学第二定律的提出是起源于热功转化的研究,寻找相应的热力学函数需从进一步分析热功转化入手(热机效率)。10
10 强调说明: 1.所谓第二类永动机,它是符合能量守恒原理的,即 从第一定律的角度看,它是存在的,它的不存在是 失败教训的总结。 2.关于“不能从单一热源吸热变为功,而没有任何其 它变化”这句话必须完整理解,否则就不符合事实。 例如理想气体定温膨胀U=0, Q= –W,就是从环境中吸热全 部变为功,但体积变大了,压力变小了。 3.“第二类永动机不可能造成”可用来判断过程的方向。 热力学第二定律的提出是起源于热功转化的研究,寻找相 应的热力学函数需从进一步分析热功转化入手(热机效率)
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体 表面化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学.ppt
- 山东理工大学:《物理化学》课程教学资源(课件讲稿)物理化学各章总结.pdf
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)复合反应动力学.ppt
- 《物理化学》课程教学资源(D)物理化学(D)热力学第二定律.pdf
- 《物理化学》课程教学资源(D)物理化学(D)热力学第一定律.pdf
- 《物理化学》课程教学资源(D)物理化学(D)多相平衡.pdf
- 《物理化学》课程教学资源(D)物理化学(D)化学平衡.pdf
- 《物理化学》课程教学资源(D)物理化学(D)化学势.pdf
- 《物理化学》课程教学资源(D)物理化学(D)表面与胶体.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《物理化学》课程教学资源(书籍教材)《物理化学简明教程》倒题与习题(高等教育出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)课程总结.ppt
- 山东理工大学:《物理化学》课程教学大纲(F).doc
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
