《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics

《热力学第一定律》基本教学要求 1.基本概念:状态函数和过程量,等温过程, 等压过程,绝热过程,可逆过程 2.基本内容:W、Q、△U和△H的计算,理想 气体各种过程的计算 3.基本方法:解题“三步曲” 求△U和△H经常使用设计途径的方法 (求W和Q不可使用设计途径的方法) 科学表述
1 《热力学第一定律》基本教学要求 1. 基本概念:状态函数和过程量,等温过程, 等压过程,绝热过程,可逆过程 2. 基本内容:W、Q、U和H的计算,理想 气体各种过程的计算 3. 基本方法:解题“三步曲” 求U和H经常使用设计途径的方法 (求W和Q不可使用设计途径的方法) 科学表述

第二章 热力学第二定律 Chapter 2 The Second Law of Thermodynamics >不违背第一定律的事情是否一定能成功呢? 例1.H2(g)+1/202(g→】 H200① △Hm(298K)=-286kJmo1 加热,不能使之反向进行。 例2.25C及9下,Ht+O→H,0①极易进行, 但最终H][OH=1014mol2.dm-6,即 反应不进行到底。 >第二定律的任务:方向,限度 2
2 第二章 热力学第二定律 Chapter 2 The Second Law of Thermodynamics ➢ 不违背第一定律的事情是否一定能成功呢? 例1. H2 (g) + 1/2O2 (g) H2O(l) rH m(298K) = -286 kJ.mol-1 加热,不能使之反向进行。 例2. 25 C及p 下,H+ + OH- H2O(l)极易进行, 但最终[H+ ][OH- ] = 10-14 mol2 .dm-6,即 反应不进行到底。 ➢ 第二定律的任务:方向,限度

§2.1自发过程的共同特征 一、自发过程的方向和限度 人类经验说明:自然界中一切变化都是有方向和限度的,且是自动 发生的,称为“自发过程”Spontaneous process。 >自发过程(spontaneous process)):在一定环境条件下,(环境) 不作非体积功,系统中自动发生的过程。反之,只有(环境)作 非体积功方能发生的过程为非自发过程。通常所说的“过程 方向”即是指自发过程的方向。 限度 ①气流:高压→ 低压 压力相同 ②传热:高温一 低温 温度相同 ③扩散: 高浓度 低浓度 浓度相同 ④反应:HCI+NaOH→NaCI+H,O 化学平衡 3
3 §2.1 自发过程的共同特征 一、自发过程的方向和限度 ➢ 自发过程(spontaneous process):在一定环境条件下,(环境) 不作非体积功,系统中自动发生的过程。反之,只有(环境)作 非体积功方能发生的过程为非自发过程。通常所说的“过程 方向”即是指自发过程的方向。 ① 气流:高压 低压 压力相同 ② 传热:高温 低温 温度相同 ③ 扩散:高浓度 低浓度 浓度相同 ④ 反应:HCl + NaOH NaCl + H2O 化学平衡 人类经验说明:自然界中一切变化都是有方向和限度的,且是自动 发生的,称为“自发过程” Spontaneous process 。 限度

>具有普遍意义的过程:热功转换的不等价性 功无代价,全部 热 不可能无代价,全部 ①W二Q不等价,是长期实践的结果。 ②不是Q1 W不可能,而是热全部变功必 须付出代价(系统和环境),若不付代价只能 部分变功。 “功可以自发地全部变为热,但热不可能全部变为功,而不 留任何其它变化”。 一切自发过程都是不可逆过程,而且他们的不可逆性均可 归结为热功转换过程的不可逆性,因此,他们的方向性都可用热 功转化过程的方向性来表达
4 “功可以自发地全部变为热,但热不可能全部变为功,而不 留任何其它变化”。 一切自发过程都是不可逆过程, 而且他们的不可逆性均可 归结为热功转换过程的不可逆性, 因此,他们的方向性都可用热 功转化过程的方向性来表达。 ➢ 具有普遍意义的过程:热功转换的不等价性 功 无代价,全部 热 不可能无代价,全部 ① W Q 不等价,是长期实践的结果。 ② 不是 Q W 不可能,而是热全部变功必 须付出代价(系统和环境),若不付代价只能 部分变功

二、自发过程的共同特征 (General character of spontaneous process) (①)自发过程单向地朝着平衡。 (2)自发过程都有作功本领。 (3)自发过程都是不可逆的。 5
5 二、自发过程的共同特征 (General character of spontaneous process) (1) 自发过程单向地朝着平衡。 (2) 自发过程都有作功本领。 (3) 自发过程都是不可逆的
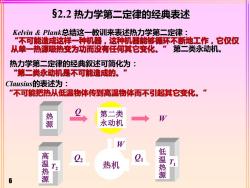
§2.2热力学第二定律的经典表述 Kelvin&Plank总结这一教训来表述热力学第二定律: “不可能造成这样一种机器,这种机器能够循环不断地工作,它仅仅 从单一热源吸热变为功而没有任何其它变化。”第二类永动机。 热力学第二定律的经典叙述可简化为: ”第二类永动机是不可能造成的。” Clausius的表述为: “不可能把热从低温物体传到高温物体而不引起其它变化。” 第二类 永动机 W 源 W 高温热 22 热机 低温热源 T 6
6 Kelvin & Plank总结这一教训来表述热力学第二定律: “不可能造成这样一种机器,这种机器能够循环不断地工作,它仅仅 从单一热源吸热变为功而没有任何其它变化。” 第二类永动机。 热力学第二定律的经典叙述可简化为: “第二类永动机是不可能造成的。” Clausius的表述为: “不可能把热从低温物体传到高温物体而不引起其它变化。” §2.2 热力学第二定律的经典表述 热 源 第二类 永动机 Q W 高 温 热 源 热机 Q2 T2 W 低 温 热 源 T1 Q1
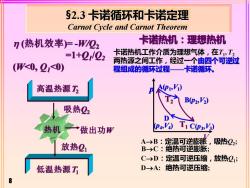
§2.3卡诺循环和卡诺定理 Carnot Cycle and Carnot Theorem n(热机效率)=-W/02 卡诺热机:理想热机 =1+0/02 卡诺热机工作介质为理想气体,在T,T2 两热源之间工作,经过一个由四个可逆过 (W<0,2<0) 程组成的循环过程—卡诺循环。 高温热源2 12 B(P2,V2) 吸热22 D下 热机一→做出功W PAVA TiCO0,囹 放热21 A→B:定温可逆膨涨, 吸热Q2; B-→C:绝热可逆膨胀; C→D:定温可逆压缩,放热21; 低温热源 D→A:绝热可逆压缩;
8 §2.3 卡诺循环和卡诺定理 Carnot Cycle and Carnot Theorem (热机效率)= -W/Q2 =1+Q1 /Q2 (W<0, Q1<0) 低温热源T1 高温热源T2 吸热Q2 放热Q1 做出功W 卡诺热机:理想热机 卡诺热机工作介质为理想气体,在T1 , T2 两热源之间工作,经过一个由四个可逆过 程组成的循环过程——卡诺循环。 p V A(p1 ,V1 ) B(p2 ,V2 ) T1 C(p3 ,V3 ) D (p4 ,V4 ) T2 B→C:绝热可逆膨胀; D→A: 绝热可逆压缩; A→B:定温可逆膨胀,吸热Q2 ; C→D:定温可逆压缩,放热Q1 ;
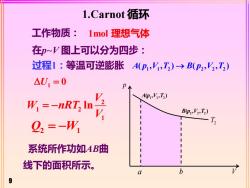
1.Carnot循环 工作物质:1mol理想气体 在印~V图上可以分为四步: 过程1:等温可逆膨胀A(P,Y,I)→B(P2,2,T) △U1=0 W.=-nRT, A,T2) B(p,V,T) Q2=-W T 系统所作功如AB曲 线下的面积所示。 a b 9
9 工作物质: 过程1:等温可逆膨胀 1 1 2 2 2 2 A p V T B p V T ( , , ) ( , , ) → 1 = U 0 2 1 2 1 lnV W nRT V = − 系统所作功如AB曲 线下的面积所示。 Q W 2 1 = − 1.Carnot 循环 在p~V 图上可以分为四步: 1mol 理想气体 p 1 1 2 A p V T ( , , ) 2 2 2 B p V T ( , , ) V T2 a b
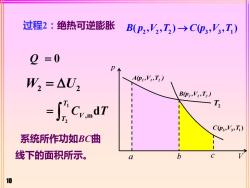
过程2:绝热可逆膨胀 B(p2,V,T2)→Cp3,V,T) 2 =0 W,=△U, Ap1,',T2) Bp2,V2,T2) T C3,T) 系统所作功如BC曲 线下的面积所示。 a b 10
10 过程2:绝热可逆膨胀 2 2 2 3 3 1 B p V T C p V T ( , , ) ( , , ) → Q = 0 W U 2 2 = 系统所作功如BC曲 线下的面积所示。 1 2 ,md T V T = C T p A(p ,V ,T ) 1 1 2 B(p ,V ,T ) 2 2 2 3 3 1 C p V T ( , , )V T2 a b c

过程3:等温可逆压缩 C(P3,V,T)→Dp4,V4,T) △U3=0 A(PV,T) W3=-nRT In Bp2,'3,T2) T 2=-W3 D(PVT) C0,',T) 环境对系统所作功如 DC曲线下的面积所示 a d b C 11
11 3 = U 0 环境对系统所作功如 DC曲线下的面积所示 Q W 1 3 = − 4 3 1 3 lnV W nRT V = − 过程3:等温可逆压缩 3 3 1 4 4 1 C p V T D p V T ( , , ) ( , , ) → p 1 1 2 A p V T ( , , ) 2 2 2 B p V T ( , , ) 3 3 1 C p V T ( , , ) 4 4 1 D p V T ( , , ) V T2 T1 a d b c
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 山东理工大学:《物理化学》课程教学大纲(F).doc
- 《物理化学》课程教学课件(PPT讲稿)课程总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学资源(书籍教材)《物理化学简明教程》倒题与习题(高等教育出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《物理化学》课程教学课件(PPT讲稿)胶体 表面化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学.ppt
- 山东理工大学:《物理化学》课程教学资源(课件讲稿)物理化学各章总结.pdf
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
