《物理化学》课程教学课件(PPT讲稿)第七章 电化学

电解质溶液 可逆电池 事电 不可逆电极过程 习题课 高子的迁移 电学 电导 电导测定应用 開 电动势测定 电极的极化
电极的极化 电动势测定 pH计 电导测定应用 电导 离子的迁移 习题课 不可逆电极过程 可逆电池 电解质溶液

(一)电解质溶液 §7.1离子的迁移 §72电解质溶液的电导 §7.3电导测定的应用示例 §7.4强电解质的活度 *§7.5强电解质溶液理论简介 2
2 (一) 电解质溶液 §7.1 离子的迁移 §7.2 电解质溶液的电导 §7.3 电导测定的应用示例 §7.4 强电解质的活度 *§7.5 强电解质溶液理论简介

§7.1离子的迁移 一、电解质溶液的导电机理 二、法拉第定律Faraday3Law 三、离子的迁移数 3
3 §7.1 离子的迁移 一、电解质溶液的导电机理 二、法拉第定律 Faraday’s Law 三、离子的迁移数
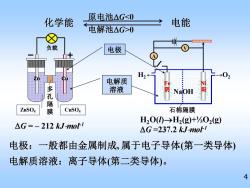
化学能 原电池△G0 负载 电极 H2 01 电解质 溶液 孔 阴NaOH 阳 ZnSO4 膜 CuSO4 石棉隔膜 H,00→H2(g)+h02(g) △G=-212 kJ-mol1 △G=237.2kJ-mot1 电极:一般都由金属制成,属于电子导体(第一类导体) 电解质溶液:离子导体(第二类导体)。 4
4 化学能 电能 原电池G0 G = – 212 kJmol-1 ZnSO4 CuSO4 Zn Cu – + 负载 多 孔 隔 膜 电极:一般都由金属制成, 属于电子导体(第一类导体) H2O(l)→H2 (g)+½O2 (g) G =237.2 kJmol-1 NaOH Fe 阴 Ni 阳 A V H2 ← →O2 石棉隔膜 电极 电解质 溶液 电解质溶液:离子导体(第二类导体)

1.电解质溶液的导电机理 1.1基本概念 (1)导体:能导电的物质称为导电体,通常分为两类: 第一类导体又称电子导体,如金属、石墨等 第一类导体的特点是: A.自由电子作定向移动而导电 B.导电过程中导体本身不发生变化 C.温度升高,电阻升高 5
5 A. 自由电子作定向移动而导电 B. 导电过程中导体本身不发生变化 第一类导体又称电子导体,如金属、石墨等 (1)导体:能导电的物质称为导电体,通常分为两类: 第一类导体的特点是: 1.电解质溶液的导电机理 1.1 基本概念 C. 温度升高,电阻升高

第二类导体又称离子导体,如电解质溶液、熔融电解质等 第二类导体的特点是: A.正、负离子作反向移动而导电,导电总量分别 由正、负离子分担 B.电解质溶液的连续导电过程必须在电化学装置中实现, 而且总是伴随有电化学反应和化学能与电能相互转换发 生。 C.温度升高,电阻下降 6
6 第二类导体又称离子导体,如电解质溶液、熔融电解质等 第二类导体的特点是: A. 正、负离子作反向移动而导电,导电总量分别 由正、负离子分担 B. 电解质溶液的连续导电过程必须在电化学装置中实现, 而且总是伴随有电化学反应和化学能与电能相互转换发 生。 C. 温度升高,电阻下降

1.1基本概念 (2)电极 正极、负极 正极: 电势高的极称为正极,电流从正极 流向负极。 负极: 电势低的极称为负极,电子从负极 流向正极。 7
7 正极、负极 电势低的极称为负极,电子从负极 流向正极。 负极: 电势高的极称为正极,电流从正极 流向负极。 正极: 1.1 基本概念 (2)电极

1.1基本概念 (2)电极 阴极、阳极 阴极: 发生还原作用的极称为阴极。 (Cathode) 阳极: 发生氧化作用的极称为阳极。 (Anode) 8
8 阴极、阳极 阴极: 发生还原作用的极称为阴极。 (Cathode) 发生氧化作用的极称为阳极。 阳极: (Anode) 1.1 基本概念 (2)电极

1.1基本概念 (2)电极 电极反应:电极上进行的有电子得失的化学反应 阳极:HL2(g)→2Ht(m)+2e 阴极:C2(g+2e→2C(m) 电池反应:两个电极反应的总结果表示电池反应 以上电极反应的总反应为: H2(g)+Cl2(g)->2HCI(m) 9
9 1.1 基本概念 (2)电极 电极反应:电极上进行的有电子得失的化学反应 电池反应:两个电极反应的总结果表示电池反应 阳极: H2 (g)→2H+ (m)+ 2e- 阴极: Cl2 (g)+2e - →2Cl- (m) 以上电极反应的总反应为: H2 (g)+Cl2 (g)→2HCl(m)
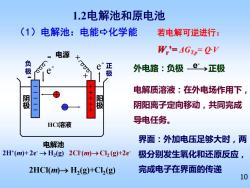
1.2电解池和原电池 (1)电解池:电能→化学能 若电解可逆进行: 电源 W'=AGTD=QV X 负 正 极 外电路:负极e→正极 极 电解质溶液:在外电场作用下, 极 极 阴阳离子定向移动,共同完成 HCI溶液 导电任务。 界面:外加电压足够大时,两 电解池 2H(m)+2e-→H2(g)2C(m)→Cl2(g+2e 极分别发生氧化和还原反应, 2HCI(m)>H2(g)+Cl(g) 完成电子在界面的传递 10
10 HCl溶液 - 电源 + 电解池 + - e - e - 电解质溶液:在外电场作用下, 阴阳离子定向移动,共同完成 导电任务。 (1)电解池:电能化学能 1.2电解池和原电池 负 极 正 极 2HCl(m)→ H2 (g)+Cl2 (g) 2Cl- (m)→Cl2 (g)+2e- 2H+ (m)+ 2e- → H2 (g) 阴 极 阳 极 外电路:负极 ⎯⎯→ e 正极 - 界面:外加电压足够大时,两 极分别发生氧化和还原反应, 完成电子在界面的传递 若电解可逆进行: Wr ’= ΔGT,p= Q·V - - - - - + + + + +
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律.ppt
- 山东理工大学:《物理化学》课程教学大纲(F).doc
- 《物理化学》课程教学课件(PPT讲稿)课程总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第二定律.ppt
- 《物理化学》课程教学资源(书籍教材)《物理化学简明教程》倒题与习题(高等教育出版社).pdf
- 《物理化学》课程教学课件(PPT讲稿)第零章 绪论.ppt
- 《物理化学》课程教学课件(PPT讲稿)第四章 化学平衡.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象与分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)滴定分析法概述.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析2/2.ppt
- 《分析化学》课程教学资源(课件讲稿,英文)Chapter 2 Errors and data treatment in quantitative analysis.pdf
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 4 Acid-base equilibria.ppt
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 6 Oxidation-reduction titration.ppt
