《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律

S1.1热力学概论 一、热力学的内容 1、热力学第一定律—一 变化过程中的能量转换的定 量关系。 2、 热力学第二定律—变化过程的方向和限度。 3、热力学第三定律一规定熵,解决化学平衡衡的计 算问题。 二、热力学的方法:逻辑推理法 1、研究对象为太量质点的宏观体系,不考虑微观 性质和个别分子的行为。 2、只须知道系统的始、终态,既不管过程进行的 机理,也无须知道其结构变化。 3、在热力学研究中无时间概念
1 §1.1 热力学概论 1、热力学第一定律 ——变化过程中的能量转换的定 量关系。 2、热力学第二定律 ——变化过程的方向和限度。 3、热力学第三定律——规定熵,解决化学平衡的计 算问题。 一、热力学的内容 1、研究对象为大量质点的宏观体系,不考虑微观 性质和个别分子的行为。 2、只须知道系统的始、终态,既不管过程进行的 机理,也无须知道其结构变化。 3、在热力学研究中无时间概念。 二、热力学的方法:逻辑推理法

二、热力学的方法:逻辑推理法 热力学的方法特点: 1、研究对象为大量质点的宏观体系 即只研究物质的宏观性质,不考虑微观性质和 个别分子的行为。 2、只须知道系统的始、终态,既不管过程进行的 机理,也无须知道其结构变化。 3、在热力学研究中无时间概念,即不管(反应) 变化速率。 例:根据热力学计算,金刚石可自发地变成石 墨,但这个过程需用多少时间?发生变化的根 本原因和机理?热力学中无法知道
2 热力学的方法特点: 1、研究对象为大量质点的宏观体系 即只研究物质的宏观性质,不考虑微观性质和 个别分子的行为。 2、只须知道系统的始、终态,既不管过程进行的 机理,也无须知道其结构变化。 3、在热力学研究中无时间概念,即不管(反应) 变化速率。 例:根据热力学计算,金刚石可自发地变成石 墨,但这个过程需用多少时间?发生变化的根 本原因和机理?热力学中无法知道。 二、热力学的方法:逻辑推理法

§1.2 基本概念 系统和环境System and Surroundings 系统:研究对象 环境:系统以外的,与系统有关的部分 系统与环境有实际的或想象的界面分开 系统的分类: System 敞开系统 密闭系统 孤立(隔离)系 open closed 统isolated 物质交换 可以 不可能 不可能 能量交换 可以 可以 不可能
3 System 敞开系统 open 密闭系统 closed 孤立(隔离)系 统isolated 物质交换 可以 不可能 不可能 能量交换 可以 可以 不可能 系统的分类: 一、系统和环境 System and Surroundings 系统:研究对象 环境:系统以外的,与系统有关的部分 系统与环境有实际的或想象的界面分开 §1.2 基本概念
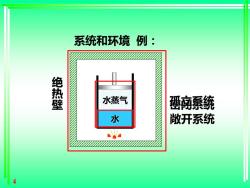
系统和环境例: 绝热壁 水蒸气 高系统 水 敞开系统 a
4 系统和环境 例: 绝 热 壁 水 水蒸气 敞开系统 孤立系统 密闭系统

二、状态和状态函数 State and State function 状态:系统的物理,化学性质的综合表现; 状态性质:系统处于某一状态时的性质,是系统 本身所属的宏观物理量。 如:T,p,p,V,m,U,H,S. 状态性质之间互相联系的,不是独立的,在数学 上有函数关系,所以又称状态函数。 如:单相纯物质密闭系统=∫(T,p)或p=f(T,) 5
5 二、状态和状态函数 State and State function 状态:系统的物理,化学性质的综合表现; 状态性质:系统处于某一状态时的性质,是系统 本身所属的宏观物理量。 如:T,p, ,V,m, U,H,S. 状态性质之间互相联系的,不是独立的,在数学 上有函数关系,所以又称状态函数。 如:单相纯物质密闭系统V=f (T, p) 或 p=f (T,V)

1.状态函数的分类 容量性质:extensive properties 其数值与系统中物质的量成正比,且有加和性 如:V∝n(总)=V+V+. 强度性质:intensive properties 其数值与系统中物质的量无关,且不具有加和性 如:T,卫,P 6
6 1. 状态函数的分类 容量性质:extensive properties 其数值与系统中物质的量成正比,且有加和性 如:Vi ∝ni V(总)=V1+V2+. 强度性质:intensive properties 其数值与系统中物质的量无关,且不具有加和性 如:T,p,

2.状态函数的特点 ① 状态函数的改变量只与始、终态有关,与变化途 径无关;AX=N=X,-X, △X=手dK=0 ② 状态函数的微小变化可以用全微分表示。 如:p=T,W 积分 ∫-j〔器)r+f)
7 2. 状态函数的特点 ① 状态函数的改变量只与始、终态有关,与变化途 径无关; dV V p dT T p dp V T + = 积分 ② 状态函数的微小变化可以用全微分表示。 如: p=f(T,V) = = − 2 1 2 1 X X X dX X X X = dX = 0 V T p p dp dT dV T V = +

三、过程与途径 系统状态发生的变化为过程, 变化的具体步骤称为途径。 按照系统中物质变化前后的状态过程可分为三类: 1、简单状态变化过程(P、V、T) 2、相变过程:系统物态发生变化,如 气化(vapor):液→气 熔化fusion):固-→液 升华过程sublimation):固→气。 3、化学变化过程:化学反应 8
8 系统状态发生的变化为过程, 变化的具体步骤称为途径。 按照系统中物质变化前后的状态过程可分为三类: 1、简单状态变化过程 (P、V、T) 2、相变过程:系统物态发生变化,如 气化(vapor):液→气 熔化(fusion):固→液 升华过程(sublimation):固→气。 3、化学变化过程: 化学反应 三、过程与途径
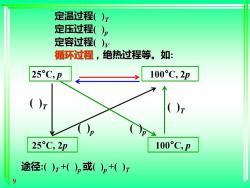
定温过程()T 定压过程()p 定容过程()v 循环过程,绝热过程等。如: 25°C,p 100°C,2p ()r 25°C,2p 100°C,p 途径:()r+()p或()pt()i 9
9 25°C, p 100°C, 2p 25°C, 2p 100°C, p 定温过程( )T 定压过程( )p 定容过程( )V 循环过程,绝热过程等。如: ( )T ( )T ( )p ( )p 途径:( )T +( )p 或( )p +( )T

四、热力学平衡系统 系统与环境间无物质、能量的交换,系统各 状态性质均不随时间而变化时,称系统处于热力 学平衡 热力学平衡系统必须同时处于下列四个平衡: 1.热平衡 2.机械平衡 3.化学平衡 4.相平衡 10
10 四、热力学平衡系统 系统与环境间 无物质、能量的交换,系统各 状态性质均不随时间而变化时,称系统处于热力 学平衡 热力学平衡系统必须同时处于下列四个平衡: 1. 热平衡 2. 机械平衡 3. 化学平衡 4. 相平衡
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)沉淀滴定法.ppt
- 《分析化学》课程教学课件(PPT讲稿)滴定分析法概述.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析2/2.ppt
- 《分析化学》课程教学资源(课件讲稿,英文)Chapter 2 Errors and data treatment in quantitative analysis.pdf
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 4 Acid-base equilibria.ppt
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 6 Oxidation-reduction titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论 Analytical chemistry(化学分析部分).ppt
- 《分析化学》课程各章 思考题(含答案)第七章.doc
- 《分析化学》课程各章 思考题(含答案)第九章.doc
- 《分析化学》课程各章 思考题(含答案)第八章.doc
- 《分析化学》课程各章 思考题(含答案)第十章.doc
- 《分析化学》课程教学资源(各章知识点)第六章 配位滴定法、第七章 氧化还原滴定法、第八章 沉淀滴定法.doc
- 《分析化学》课程教学资源(各章知识点)第一章 概论、第三章 误差及数据处理、第五章 酸碱滴定法.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
