《分析化学》课程教学课件(PPT讲稿)沉淀滴定法

沉淀滴定法 利用沉淀反应来进行滴定分析的方法。 进行滴定的条件是: 沉淀有固定的组成,反应物之间有准确的计量关系 沉淀溶解度小,反应完全 沉淀吸附杂质少 反应速度快,有合适的指示终点的方法 东大军
沉淀滴定法 利用沉淀反应来进行滴定分析的方法。 进行滴定的条件是: 沉淀有固定的组成,反应物之间有准确的计量关系 沉淀溶解度小,反应完全 沉淀吸附杂质少 反应速度快,有合适的指示终点的方法

【简介】 沉淀反应虽然很多,但能用于滴定分析的不多,原因是 很多沉淀的组成不恒定,或溶解度大,或容易形成过饱 和溶液;有些沉淀反应速度慢,或共沉淀现象严重,或 缺少合适的指示剂。目前,比较有实际意义的是生成难 溶性银盐的沉淀反应: Ag+X=AgX↓ (为C、Br、CN-和SCN等) 利用上述沉淀反应的滴定分析法称为银量法。 边东理力大
【简介】 沉淀反应虽然很多,但能用于滴定分析的不多,原因是 很多沉淀的组成不恒定,或溶解度大,或容易形成过饱 和溶液;有些沉淀反应速度慢,或共沉淀现象严重,或 缺少合适的指示剂。目前,比较有实际意义的是生成难 溶性银盐的沉淀反应: Ag+ + X-= AgX↓ (X-为Cl-、Br-、I -、CN-和SCN-等) 利用上述沉淀反应的滴定分析法称为银量法

8.1滴定曲线 0.10moL的AgNO3滴20.00mL0.10mol/L的NaCl: 1.sp前:(0.1%)H长2○ ICI-(V)er-(eV)A V总 HPO 0.02 =0.1× 39.98 =5×105=10-4.3 pC=4.3 Ksp_ .2×10-10 故[Ag]= =10-5.2 CH 5×10-5 少水理大 pAg-5.2
0.10mol/L的AgNO3滴20.00mL0.10mol/L的NaCl: 1. sp前:(- 0.1%) (cV)Cl- - (cV)Ag+ [Cl - ]= cCl = ——————— V总 0.02 =0.1× ——39.98 =5 ×10-5 =10-4.3 8.1 滴定曲线 Ksp 3.2×10-10 故[Ag+ ]= —— = ———— =10-5.2 Cl- 5×10 -5 pCl=4.3 pAg=5.2

2.sp时: IAg'IICF]=KsP H长P© [Ag]p=√Kp=1.79x105=10?P=pg=4.7 3.sp后:根据过量的Ag+计算(+0.1%) [Ag]=0.1× 0.02 =10-4.3 40.02 pAg=4.3 pC=5.2 △pC=0.9 少东理大等
3.sp后:根据过量的Ag+计算(+0.1%) 0.02 [Ag+ ]= 0.1× —— = 10 -4.3 40.02 pAg=4.3 pCl=5.2 ΔpCl=0.9 2.sp时: [Ag+ ][Cl- ]=Ksp 5 4.7 [ ] 1.79 10 10 + − − Ag s p = Ks p = = = = 4.7 Cl sp Ag psp p
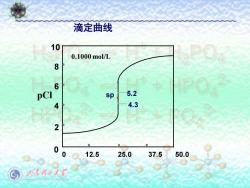
滴定曲线 10 0.1000mol/L 8 6 PCI sp 5.2 4 4.3 2 00 12.5 25.0 37.5 50.0 少水理少大
0 12.5 25.0 37.5 50.0 pCl 0.1000 mol/L 5.2 4.3 0 2 4 6 8 10 sp 滴定曲线

8.2银量法概述 根据所用的指示不同,银量法按创立者的名字命 名划分为: 莫尔Mohr)法 HPO 佛尔哈德(Volhard)法 法扬司(Fajans)法 少东理大
根据所用的指示剂不同,银量法按创立者的名字命 名划分为: 莫尔(Mohr)法 佛尔哈德(Volhard)法 法扬司(Fajans)法 8.2 银量法概述

莫尔法 1、原理 滴定反应:Ag++C=AgC(白色) P0 Kp(AgCl)=1.8X10-H0S=√Kp=1.35×105mol/L 终点反应:2Ag++CrO42-=Ag2CrO4(砖红色) Kp(Ag2Cr04)=1.2X10-2S=K。=1.3x10~mol/L 少东理力大
滴定反应:Ag+ + Cl- = AgCl↓(白色) Ksp(AgCl)= 1.8×10-10 终点反应:2Ag+ + CrO4 2-= Ag 2CrO4 ↓(砖红色) Ksp( Ag 2CrO4 )= 1.2×10-12 一 莫尔法 1、 原理 S K 1.35 10 mol /L 5 sp − = = S K 1.3 10 mol / L 4 3 sp − = =

卷2、滴定条件 (1)指示剂的用量 化学计量点时:长H已O [Ag]p=[C]p=VKp(AgCD=V1.8×10-10=1.35x10 若要求此时的Ag+浓度满足 [Ag'p[CrO p=Kp (Ag2CrO) 则 ICro Ksp(Ag2CrO) 1.2×10-12 =6.6×10-3 [Ag"P (1.35×105)2 少东理大等
2、滴定条件 -10 -5 s p - [Ag ] =[Cl ] = (AgCl) = 1.810 =1.3510 + s p s p K [Ag ] [CrO ] (Ag CrO ) sp 2 4 2- 4 2 sp sp = K + -3 -5 2 -12 2 2- s p 2 4 4 6.6 10 (1.35 10 ) 1.2 10 [Ag ] (Ag CrO ) [CrO ] = = = + K s p 则 若要求此时的Ag+浓度满足 (1)指示剂的用量 化学计量点时:

化学计量点时: K,CrO4浓度 H长Ho尼© 理论值6.6×10-3molL1。 HPO 实验值 5.8×103moL1为宜 KCrO,本身呈黄色,浓度太大会妨碍终点的观测 少水理大
化学计量点时: K2CrO4浓度 理论值 6.6×10-3mol·L-1 。 实验值 5.8×10-3 mol·L-1为宜 K2CrO4本身呈黄色,浓度太大会妨碍终点的观测

(2)溶液的酸度 莫尔法适宜的酸度为中性或弱碱性(pH=6.5~10.0)。 pH10.0时: H+HPO Ag+OH→Ag0H→Ag,0↓ 少东理大等
(2)溶液的酸度 莫尔法适宜的酸度为中性或弱碱性(pH=6.5~10.0)。 + + → − H + CrO4 HCrO4 + → → + − Ag OH AgOH Ag2 O pH<6.5时: 不能正确指示终点; pH>10.0时:
按次数下载不扣除下载券;
注册用户24小时内重复下载只扣除一次;
顺序:VIP每日次数-->可用次数-->下载券;
- 《分析化学》课程教学课件(PPT讲稿)氧化还原滴定法 Oxidation-Reduction Titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)分析化学中的误差.ppt
- 《物理化学》课程教学课件(PPT讲稿)第一章 热力学第一定律.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《物理化学》课程教学课件(PPT讲稿)电化学_电解质溶液.ppt
- 《物理化学》课程教学课件(PPT讲稿)热力学第一定律及其应用.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第八章 表面现象分散系统.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第三章 化学势.ppt
- 《物理化学》课程教学课件(PPT讲稿)第七章 电化学.ppt
- 《物理化学》课程教学课件(PPT讲稿)第九章 化学动力学基本原理.ppt
- 《物理化学》课程教学课件(PPT讲稿)总结.ppt
- 《物理化学》课程教学资源(F)课件 电化学 第八章 电解质溶液.pdf
- 《物理化学》课程教学资源(F)课件 电化学 电化学 第九章 可逆电池电动势及其应用.pdf
- 《物理化学》课程教学课件(PPT讲稿)绪论.ppt
- 《物理化学》课程教学资源(F)课件 热力学定律 热力学第一定律.pdf
- 《物理化学》课程教学课件(PPT讲稿)复习总结.ppt
- 《物理化学》课程教学课件(PPT讲稿)第五章 多相平衡 Phase Equilibrium.ppt
- 《物理化学》课程教学课件(PPT讲稿)第二章 热力学第二定律 The Second Law of Thermodynamics.ppt
- 《分析化学》课程教学课件(PPT讲稿)滴定分析法概述.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)络合滴定2/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)酸碱滴定法(acid-base titration).ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析1/2.ppt
- 《分析化学》课程教学课件(PPT讲稿)重量分析2/2.ppt
- 《分析化学》课程教学资源(课件讲稿,英文)Chapter 2 Errors and data treatment in quantitative analysis.pdf
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 4 Acid-base equilibria.ppt
- 《分析化学》课程教学课件(PPT讲稿,英文)Chapter 6 Oxidation-reduction titration.ppt
- 《分析化学》课程教学课件(PPT讲稿)绪论 Analytical chemistry(化学分析部分).ppt
- 《分析化学》课程各章 思考题(含答案)第七章.doc
- 《分析化学》课程各章 思考题(含答案)第九章.doc
- 《分析化学》课程各章 思考题(含答案)第八章.doc
- 《分析化学》课程各章 思考题(含答案)第十章.doc
- 《分析化学》课程教学资源(各章知识点)第六章 配位滴定法、第七章 氧化还原滴定法、第八章 沉淀滴定法.doc
- 《分析化学》课程教学资源(各章知识点)第一章 概论、第三章 误差及数据处理、第五章 酸碱滴定法.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 聚丙烯腈的部分水解反应.doc
- 《高分子化学实验》课程实验指导(讲义)实验四 三聚氰胺甲醛树脂的合成及层压板的制备.doc
- 《高分子化学实验》课程实验指导(讲义)实验五 本体聚合MMA及其透光率测定.doc
- 《高分子化学实验》课程实验指导(讲义)实验二 丙烯酰胺溶液聚合及其干燥加工.doc
